Degenerative Veränderungen der nassen versus trockenen Makula
Startseite / Grundlegende Überprüfung der Augenheilkunde / Netzhaut
Titel: Degenerative Veränderungen der nassen versus trockenen Makula
Autor: Nina Boal, MSIV, Thomas Jefferson University
Fotograf: James Gilman, CRA, FOPS
> II. Anatomischer Ansatz zur Augenkrankheit > NETZHAUT> 2. Die altersbedingte Makuladegeneration (AMD) ist die häufigste Ursache für irreversible Erblindung in Industrieländern bei Menschen ab 50 Jahren . Es ist eine degenerative Erkrankung der Makula (zentraler Teil der Netzhaut), die zu einem zentralen Sehverlust führt. Klinisch ist es in trocken (atrophisch) oder nass (exsudativ oder neovaskulär) unterteilt. Das Risiko, von trockener AMD zu nasser AMD zu gelangen, wird auf 1 bis 4,7 Prozent in einem Jahr und 13 bis 18 Prozent nach drei Jahren geschätzt .
Trockene altersbedingte Makuladegeneration
Makulaveränderungen bei trockener AMD sind durch subretinale Drusenablagerungen, Atrophie des retinalen Pigmentepithels (RPE), Pigmentepithelablösungen und subretinale Pigmentepithelklumpen gekennzeichnet. Es fehlt eine Neovaskularisation . Trockene AMD betrifft 85 bis 90 Prozent aller Menschen mit AMD .
- Drusen sind Ablagerungen von extrazellulärem Material, die bei der Ophthalmoskopie als hellgelbe Flecken erscheinen (siehe Abbildung 1). Das Risiko für das Fortschreiten zur feuchten AMD steigt mit zunehmender Anzahl und Größe der Drusen und dem Vorhandensein von RPE-Pigmentanomalien. Ein paar, kleine Drusen sind typisch für Menschen über 50 Jahre alt und gelten als normaler Teil des Alterns .
- Die Atrophie des retinalen Pigmentepithels (RPE) tritt bei der Ophthalmoskopie als Klumpen von Hyperpigmentierungen oder depigmentierten atrophischen Bereichen auf. Bereiche mit Gewebeverlust und Ausdünnung können fokal oder breiter auf der Makula verteilt sein, was in Abbildung 2 als geografische Atrophie bezeichnet wird.

Abbildung 1. Drusen bei trockener AMD
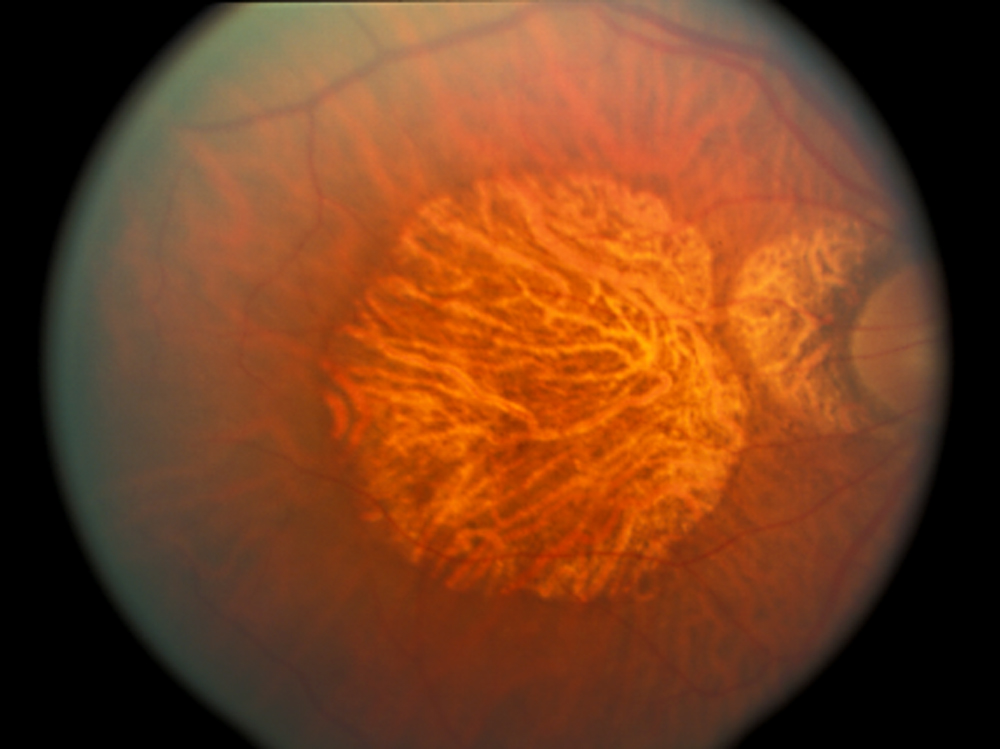
Abbildung 2. Geographische Atrophie bei trockener AMD
Nasse altersbedingte Makuladegeneration
Bei nasser (oder neovaskulärer) AMD wachsen abnormale Gefäße aus dem Aderhautkreislauf in den subretinalen Raum. Diese Gefäße können auslaufen und zu subretinalen Blutungen führen, siehe Abbildung 3, und zu subretinalen Flüssigkeitsansammlungen, was auf eine choroidale Neovaskularisation hinweist. Ziel ist es, diese neuen Gefäße zu erkennen, bevor sie bluten und eine hämorrhagische Ablösung des retinalen Pigmentepithels verursachen. Nasse AMD ist seltener als trockene AMD und betrifft nur 10 bis 15 Prozent der Menschen mit AMD. Es macht jedoch mehr als 80% der Patienten mit schwerem Sehverlust oder Rechtsblindheit aus .

Abbildung 3A. Subretinale Blutung bei feuchter AMD

Abbildung 3B. Fluorescein-Farbstoff-Netzhautangiographie eines Patienten mit feuchter AMD, der Leckbereich entspricht einer Blutung in Abbildung 3A
Präsentation
Das Hauptsymptom der AMD ist der Verlust des zentralen Sehvermögens, aber anfänglich kann AMD asymptomatisch sein. Patienten mit trockener AMD beschreiben einen allmählichen Verlust des Sehvermögens in der Mitte ihres Gesichtsfeldes. Patienten mit feuchter AMD können eine akutere visuelle Verzerrung oder einen Verlust des zentralen Sehvermögens beschreiben, da sich Flüssigkeit oder Blut unter der Netzhaut ansammelt.
Aufarbeitung
- Sehschärfe
- Erweiterte Augenuntersuchung
- Amsler Grid
- Ein nützliches Werkzeug, in Abbildung 4 zu sehen, um die Funktion der Makula zu bewerten.
- Der Patient fokussiert jeweils ein Auge auf den mittleren Punkt des Gitters von 1 Fuß entfernt und stellt dann Unregelmäßigkeiten in den Linien fest.
- Dieser Test testet speziell auf Metamophopsie (Verzerrung von geraden Linien), eine frühe Veränderung der feuchten AMD .
- Fluorescein dye retinale Angiographie
- Kann hilfreich sein, um Neovaskularisation bei feuchter AMD zu identifizieren
- Fluorescein dye wird intravenös injiziert und eine Sequenz von Fotografien wird aufgenommen. Neu gebildete choroidale neovaskuläre Gefäße lecken Fluorescein, wie in Abbildung 3B zu sehen.
- Die optische Kohärenztomographie (OCT)
- Erzeugt Querschnittsbilder der Netzhaut und kann zur Identifizierung von Drusen, Netzhautödemen und subretinaler Flüssigkeit verwendet werden.

Abbildung 4 Amsler-Gitter
Behandlung der trockenen AMD
Es gibt keine nachgewiesene wirksame Behandlung der trockenen AMD, jedoch können diese Patienten schließlich eine feuchte AMD entwickeln . Um dieses Fortschreiten zu verhindern, kann den Patienten geraten werden, mit dem Rauchen aufzuhören und eine Kombination von Vitaminen und Mineralstoffen einzunehmen, aus denen die AREDS-Formel besteht (Age-Related Eye Disease Study). Es wurde gezeigt, dass eine Kombination aus antioxidativen Vitaminen und Zink das Auge bei Patienten mit ausgedehnterer trockener und nasser AMD vor weiteren Schäden durch AMD schützt .
Behandlung der feuchten AMD
Zusätzlich zur Verwendung von Antioxidantien und Zink versucht die Behandlung der feuchten AMD, die Neovaskularisation zu stoppen und zu verhindern durch:
- VEGF-Inhibitoren
- Im Mittelpunkt der Behandlung der feuchten AMD stehen Anti-VEGF-Therapien wie Bevacizumab, Ranibizumab und Aflibercept, die monatlich oder zweimonatlich in den Glaskörper injiziert werden
- VEGF spielt eine wichtige Rolle bei der. Durch die Hemmung von VEGF wird das Fortschreiten der feuchten AMD gestoppt und der Sehverlust kann stabilisiert oder verbessert werden .
- Die photodynamische Therapie (PDT)
- Wird typischerweise angewendet, wenn die Anti-VEGF-Therapie nicht wirksam ist
- Beinhaltet die intravenöse Injektion des Photosensibilisierungsfarbstoffs Verteporfin vor der Behandlung des Auges mit einem photoaktivierenden Laser. Die Rolle dieser Therapie hat mit dem zunehmenden Einsatz der Anti-VEGF-Therapie abgenommen .
- Thermische Laser-Photokoagulation
- Die Anwendung ist aufgrund des Risikos von Skotomen und Sehverlust auf kleinere Läsionen außerhalb der zentralen Makula beschränkt .
Summary Table
| Dry AMD | Wet AMD |
| 85 to 90% of patients with AMD | 10 to 15% of patients with AMD |
| Absence of neovascularization | Choroidal neovascularization– subretinal hemorrhage and subretinal fluid collections |
| Drusen, RPE atrophy, pigment epithelial ablösungen, subretinale Pigmentepithelverklumpung | Drusen, RPE-Atrophie, Pigmentepithelablösungen, subretinale Pigmentepithelverklumpung |
| Langsames Fortschreiten | Schneller Verlust des zentralen Sehvermögens über Wochen bis Monate |
| Leichter bis schwerer zentraler Sehverlust | Schwererer Sehverlust oder legale Blindheit |
| Behandlung:
– Überwachen Sie das Fortschreiten der feuchten AMD mit Amsler grid – Raucherentwöhnung – AREDS–Antioxidantien und Zinkpräparate (wirksamer bei ausgedehnter trockener AMD) |
Behandlung:
– Raucherentwöhnung – AREDS-Antioxidantien und Zinkpräparate – Anti-VEGF-Therapie – Wenn die Anti-VEGF-Therapie betrachten Sie PDT oder thermische Laser-Photokoagulation |
Fakultätsrevisor: Griffin Jardine, MD
- Hyman L. Epidemiologie der Augenkrankheit bei älteren Menschen. Auge (Lond) 1987; 1 ( Pt 2):330.
- Bressler NM. Altersbedingte Makuladegeneration ist die häufigste Ursache für Blindheit … JAMA 2004; 291: 1900.In:
- Lietman MW. Handbuch für Augenuntersuchung und Diagnose. 9. Hoboken, NJ: John Wiley & Söhne Inc.; 2017.
- Jager RD, Mieler WF, Müller JW. Altersbedingte Makuladegeneration. N Engl J Med 2008; 358:2606.
- Altersbezogene Augenkrankheit Studie Forschungsgruppe. Eine randomisierte, placebokontrollierte klinische Studie zur hochdosierten Supplementierung mit Vitamin C und E, Beta-Carotin und Zink bei altersbedingter Makuladegeneration und Sehverlust: AREDS report no. 8. Arch Ophthalmol 2001; 119:1417.
- Tan JS, Mitchell P, Kifley A, et al. Rauchen und die langfristige Inzidenz von altersbedingter Makuladegeneration: die Blue Mountains Eye Study. Arch Ophthalmol 2007; 125:1089.
- Solomon SD, Lindsley K, Vedula SS, et al. Anti-vaskulärer endothelialer Wachstumsfaktor für neovaskuläre altersbedingte Makuladegeneration. In: Cochrane Database Syst Rev 2014.
Kennung: Moran_CORE_24645