Die Addition von Wasserstoff an eine Kohlenstoff-Kohlenstoff-Doppelbindung wird Hydrierung genannt. Der Gesamteffekt einer solchen Addition ist die reduktive Entfernung der funktionellen Doppelbindungsgruppe. Regioselektivität ist kein Problem, da an jedes der Doppelbindungskohlenstoffe dieselbe Gruppe (ein Wasserstoffatom) gebunden ist. Die einfachste Quelle für zwei Wasserstoffatome ist molekularer Wasserstoff (H2), aber das Mischen von Alkenen mit Wasserstoff führt zu keiner erkennbaren Reaktion. Obwohl die gesamte Hydrierungsreaktion exotherm ist, verhindert eine hohe Aktivierungsenergie, dass sie unter normalen Bedingungen stattfindet. Diese Einschränkung kann durch die Verwendung eines Katalysators umgangen werden, wie im folgenden Diagramm gezeigt.
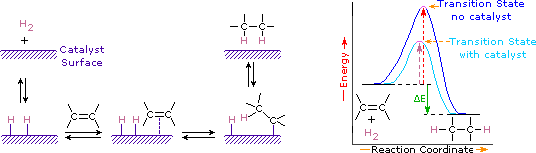
Katalysatoren sind Substanzen, die die Geschwindigkeit (Geschwindigkeit) einer chemischen Reaktion verändern, ohne verbraucht zu werden oder als Teil des Produkts zu erscheinen. Katalysatoren wirken, indem sie die Aktivierungsenergie von Reaktionen senken, aber sie ändern nicht die relative potentielle Energie der Reaktanten und Produkte. Feinteilige Metalle wie Platin, Palladium und Nickel gehören zu den am weitesten verbreiteten Hydrierkatalysatoren. Die katalytische Hydrierung erfolgt in mindestens zwei Stufen, wie im Diagramm dargestellt. Zunächst muss das Alken zusammen mit einem Teil des Wasserstoffs an der Oberfläche des Katalysators adsorbiert werden. Als nächstes verschieben sich zwei Wasserstoffatome von der Metalloberfläche zu den Kohlenstoffen der Doppelbindung, und der resultierende gesättigte Kohlenwasserstoff, der schwächer adsorbiert wird, verlässt die Katalysatoroberfläche. Die genaue Art und der Zeitpunkt der letzten Ereignisse sind nicht gut verstanden.
Wie im Energiediagramm gezeigt, ist die Hydrierung von Alkenen exotherm und Wärme wird entsprechend dem ΔE (grün gefärbt) im Diagramm freigesetzt. Diese Reaktionswärme kann verwendet werden, um die thermodynamische Stabilität von Alkenen mit unterschiedlicher Anzahl von Alkylsubstituenten an der Doppelbindung zu bewerten. In der folgenden Tabelle sind beispielsweise die Hydriertemperaturen für drei C5H10-Alkene aufgeführt, die das gleiche Alkan-Produkt (2-Methylbutan) ergeben. Da eine große Reaktionswärme einen hochenergetischen Reaktanten anzeigt, sind diese Wärme umgekehrt proportional zu den Stabilitäten der Alkenisomeren. In grober Näherung sehen wir, dass jeder Alkylsubstituent an einer Doppelbindung diese funktionelle Gruppe um etwas mehr als 1 kcal / Mol stabilisiert.
| Alkenisomer | (CH3)2CHCH=CH2 3-methyl-1-buten |
CH2=C(CH3)CH2CH3 2-methyl-1-buten |
(CH3)2C=CHCH3 2-methyl-2-buten |
|---|---|---|---|
| Reaktionswärme ( ΔHº ) |
-30,3 kcal/mol | -28,5 kcal/mol | -26,9 kcal/mol |
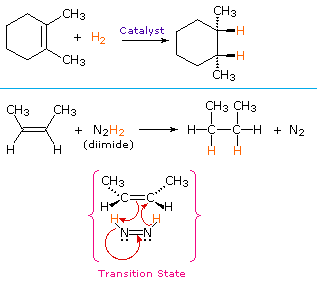
Aufgrund des hier gezeigten Mechanismus würden wir erwarten, dass die Zugabe von Wasserstoff mit Syn-Stereoselektivität erfolgt. Dies ist häufig der Fall, aber die Hydrierkatalysatoren können auch eine Isomerisierung der Doppelbindung vor der Wasserstoffaddition bewirken, wobei die Stereoselektivität unsicher sein kann.
Die Bildung von Übergangsmetallkomplexen mit Alkenen wurde durch die Isolierung stabiler Platinkomplexe wie Zeises Salz, K.H2O, und Ethylenbis (Triphenylphosphin)Platin, 2Pt (H2C =CH2), überzeugend nachgewiesen. In letzterem ist Platin dreiwertig und nullwertig, während Zeises Salz ein Derivat von Platin (II) ist. Ein Modell von Zeises Salz und eine Diskussion der ungewöhnlichen Bindung in solchen Komplexen können hier eingesehen werden. Ähnliche Komplexe wurden für Nickel und Palladium berichtet, Metalle, die auch als Katalysatoren für die Alkenhydrierung fungieren.
Ein nicht-katalytisches Verfahren zur Syn-addition von Wasserstoff nutzt die instabile Verbindung Diimid, N2H2. Dieses Reagens muss im Reaktionssystem frisch erzeugt werden, üblicherweise durch Oxidation von Hydrazin, und die stark exotherme Reaktion wird durch die Eliminierung von Stickstoffgas (einer sehr stabilen Verbindung) begünstigt. Diimid kann als Cis-trans-Isomere vorliegen; nur das cis-Isomer dient als Reduktionsmittel. Beispiele für Alkenreduktionen nach beiden Verfahren sind nachstehend aufgeführt.
Mitwirkende
- William Reusch, Emeritierter Professor (Michigan State U.), Virtuelles Lehrbuch der Organischen Chemie