A Microbial Biorealm page on the genus Enterococcus faecalis
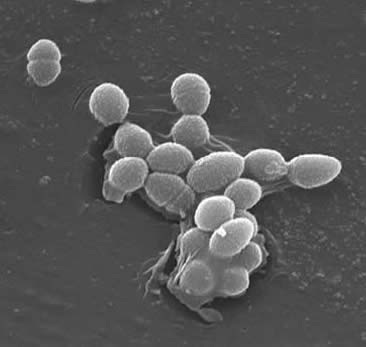
Classification
Higher order taxa
Bacteria; Firmicutes; Bacilli; Lactobacillales; Enterococcaceae; Enterococcus
Spezies
Enterococcus faecalis
Beschreibung und Bedeutung
Enterokokken sind grampositive Kokken, die raue Bedingungen in der Natur überleben können. Sie können in Boden, Wasser und Pflanzen gefunden werden. Einige Stämme werden bei der Herstellung von Lebensmitteln verwendet, während andere die Ursache für schwere Infektionen beim Menschen und Tier sind (z. B. besiedeln sie bekanntermaßen den Magen-Darm-Trakt und den Genitaltrakt des Menschen). Sie sind sowohl mit gemeinschaftlichen als auch mit im Krankenhaus erworbenen Infektionen verbunden. Enterokokken können in einem Temperaturbereich von 10 bis 42 ° C und in Umgebungen mit breiten pH-Werten wachsen. Einige sind dafür bekannt, beweglich zu sein. Während es über 15 Arten der Gattung Enterococcus gibt, sind 80-90% der klinischen Isolate E. faecalis (8). Enterokokken bilden typischerweise kurze Ketten oder sind paarweise angeordnet. Unter bestimmten Wachstumsbedingungen verlängern sie sich jedoch und erscheinen kokobazillär. Im Allgemeinen sind Enterokokken alpha-hämolytisch. Einige besitzen das Lancefield-Antigen der Gruppe D und können mit Agglutinationstests auf Basis monoklonaler Antikörper nachgewiesen werden.Enterokokken sind typischerweise Katalase-negativ und anaerob. Sie können in 6,5%iger NaCl wachsen, können Esculin in Gegenwart von 40%igen Gallensalzen hydrolysieren und sind Pyrrolidonylarylamidase- und Leucinarylamidase-positiv (8). Enterokokken haben sich aufgrund ihrer Resistenz gegen viele antimikrobielle Wirkstoffe als therapeutische Herausforderung erwiesen, „einschließlich Zellwandwirkstoffe; Aminoglykoside, Penicillin und Ampicillin sowie Vancomycin“ (1). Die Enterokokken haben die Fähigkeit, eine Vielzahl von antimikrobiellen Resistenzfaktoren zu erwerben, die ernsthafte Probleme bei der Behandlung von Patienten mit Enterokokkeninfektionen darstellen (8). Im Allgemeinen können Enterokokkenisolate mit verringerter Empfindlichkeit gegenüber Vancomycin als vanA, vanB und vanC kategorisiert werden. vanA und vanB stellen die größte Bedrohung dar, da sie am resistentesten sind und die Resistenzgene auf einem Plasmid getragen werden. Da die Resistenzgene auf einem Plasmid getragen werden, sind sie gut übertragbar, E. faecalis kann diese Plasmide durch Konjugation übertragen (2). E. Fäkalien sind auch resistent gegen Teicoplanin. Enterokokkenstämme, die Vancomycin-abhängig sind, wurden gefunden, sind aber selten und seltener als Vancomycin-resistente Stämme (bezeichnet als „Vancomycin-resistente Enterokokken“ oder „VRE“) (1).
Genomstruktur

Aufgrund vieler Gefahren für die öffentliche Gesundheit waren die Genomsequenzdaten eines Enterococcus-Stammes notwendig. Der für die Genom-DNA-Sequenzierung ausgewählte Stamm war E. faecalis V583, das erste Vancomycin-resistente Isolat in den USA. Das Genom des Stammes V583 wurde vom Institut für Genomforschung (TIGR) sequenziert. Das Enterokokken-Genom zeigt, dass E. faecalis metabolisch vielfältig ist und eine breite Palette von Regulationssystemen enthält. Stamm V583 enthält vier DNA-Moleküle: das Haupt-3.218.030 Basenpaar bakterielles Chromosom und drei zirkuläre Plasmide. Das Chromosom enthält etwa 3.500 offene Leserahmen (ORFs), von denen etwa 1/3 keine zuweisbare Funktion haben (8). Die drei Plasmide sind zirkuläre DNA-Moleküle, die als Plasmid-1, Plasmid-2 und Plasmid-3 identifiziert werden. Plasmid-1 enthält 66.320bp, Plasmid-2 enthält 17.963bp und Plasmid-3 enthält 57.660bp. Die Plasmide kodieren eine Reihe von Genen, darunter Transposasen, Multiresistenzproteine und einen ppGpp-regulierten Wachstumshemmer (8). Die durchschnittliche G + C-Zusammensetzung des E. faecalis-Chromosoms beträgt 37,38%. Da das DNA-Molekül so groß ist, treten regionale Abweichungen vom Durchschnitt auf. Einer dieser Orte ist das große Segment, das mit dem „Vancomycin-Resistenz-Gencluster in der Nähe von 2,22 Mb“ assoziiert ist und einen starken Anstieg des prozentualen G + C-Gehalts zeigt (8). Diese mit Antibiotikaresistenz oder Virulenz verbundenen Unterschiede deuteten auf den Erwerb von genetischem Material von einer fremden Spezies durch horizontalen Transfer hin. Es ist noch nicht bekannt, ob die Transfers für die Variationen in der DNA-Make-up verantwortlich sind. Die im Genom von E enthaltenen Informationen. faecalis V583 wird das Verständnis darüber, wie sich der Organismus zu einem vielseitigen menschlichen Krankheitserreger entwickelt hat, erheblich erleichtern. Mit Hilfe der vergleichenden Genomik wird die Rolle der verschiedenen regulatorischen Elemente in Bezug auf ihre Reaktion auf verschiedene Umweltbelastungen und die Expression potenzieller Virulenzfaktoren besser verstanden (8). Weitere Studien wie diese werden neue Medikamente gegen bakterielle Infektionen vorschlagen, die durch Enterokokken verursacht werden.Das Genom enthält auch 3 Ebp-Operone (encoding for the Endokarditis biofilm-associated pili), die für die Biofilmproduktion des E. faecalis-Stammes OG1RF wichtig sind. Dieser Stamm verwendet diese Operonen, um Oberflächen-Pili zu erzeugen. . Die Oberflächen-Pili werden zur „Anhaftung an die Wirtsoberflächen verwendet und sind beim Menschen während der Endokarditis antigenisch“ (9).
Der TIGR enthält eine vollständige Liste der Gene für die E. faecalis-Chromosomen.
Zellstruktur und Stoffwechsel
Zellstoffwechsel
Die Enterokokken bewohnen raue Umgebungen, wie die Darmtrakte von Mensch und Tier. Das Wachstum unter diesen feindlichen Bedingungen erfordert, dass E. faecalis einen flexiblen Stoffwechsel hat. E. Fäkalien sind nicht nur zur Fermentation zur Herstellung von Milchsäure fähig, sondern können auch „ein Spektrum von Energiequellen aus Kohlenhydraten, Glycerin, Lactat, Malat, Citrat, Diaminosäuren und Manya-Ketosäuren katabolisieren“ (3).Es wurde gezeigt, dass E. faecalis unter ausgewählten Wachstumsbedingungen das Wachstum durch oxidative Phosphorylierung unter Verwendung einer Protonenantriebskraft, die durch Elektronentransport hergestellt wird, verbessern kann. Eine Folge der „entstehenden Atmung ist die Produktion potenter Oxidationsmittel“ (z. B. Superoxid und Wasserstoffperoxid), oxidativer Stress, den E. faecalis tolerieren kann (3). Die Toleranz dieses Stresses in Kombination mit anderen schweren Wachstumsbedingungen ermöglicht es dem E. faecalis, bei 10 bis 45 ° C, in Gallensalzen und bei extrem niedrigen und hohen pH-Werten zu wachsen. Darüber hinaus kann E. faecalis Azid, Detergenzien, Schwermetallen und Ethanol widerstehen. Da E. faecalis verschiedene Zuckerquellen nutzen kann, kann es in verschiedenen Umgebungen leben, insbesondere im Darm, wo die Nährstoffe begrenzt sind (2). Im Darm beziehen E. faecalis den größten Teil ihrer Energie aus der Fermentation von nicht absorbierten Zuckern. E. Fäkalien können auch Energie gewinnen, indem sie Mucine abbauen, ein Kohlenhydrat, das stark glykosyliert ist und von Darmbecherzellen produziert wird (2).Der E. faecalis verwendet ein „Phosphoenolypyruvat-Phosphotransferase-System (PTS), um Zucker außerhalb der Zelle zu erfassen und die Aufnahme von Zuckern mit Phosphorylierung zu koppeln“ (2). Auf diese Weise wird weniger Energie (ATP) verschwendet, als wenn Zucker von Nicht-PTS-Systemen akkumuliert wird. Zu den von E. faecalis metabolisierten Zuckern gehören: D-Glucose, D-Fructose, Lactose, Maltose (alle PTS-Substrate). Bei Enterokokken reguliert PTS auch den Glycerinstoffwechsel, den Ausstoß von Induktoren und die Repression von Kataboliten (8). E. faecalis ist eines der wenigen grampositiven Bakterien mit niedrigem G + C-Gehalt, die Zucker während des Wachstums auf Glukose ausstoßen, ein Phänomen, das als Induktorausstoß bekannt ist (8). E. faecalis kann sogar Glycerin unter aeroben und mikroaerophilen Bedingungen fermentieren. E. faecalis kann auch unter anaeroben Bedingungen auf Glycerin wachsen, da es „ein Gen für NAD + -gebundene anaerobe Glycerindehydrogenaseaktivität exprimiert“ (8). Glycerin kann die Zellmembran mit einem Protein namens Glycerol Diffusion Facilitator (GlpF) durchqueren. Das GlpF macht die Konzentration von Glycerin innerhalb und außerhalb der Zelle gleich, das Protein wird durch Glykolyse gehemmt. E. faecalis können bei extrem alkalischem pH-Wert und hoher Salzkonzentration leben. Diese Eigenschaften erfordern einen Kationentransport, um die für die Homöostase wesentliche konstante zytosolische Ionenzusammensetzung aufrechtzuerhalten. Alle Zellen müssen überschüssiges Natrium ausstoßen, um die zytosolischen Konzentrationen in einem Bereich zu halten, der die Homöostase begünstigt. E. faecalis exprimiert sowohl einen Na+/H+-Antiporter als auch eine ATPase vom vakuolaren Typ (2). Kalium ist ein wichtiges intrazelluläres Kation. Die Kaliumkonzentration in E. faecalis von 0,4 bis 0,6 M ist essentiell für den normalen Zellstoffwechsel, es „neutralisiert intrazelluläre Anionen, aktiviert verschiedene Enzyme und reguliert den cytosolischen pH-Wert“ (8). E. faecalis exprimiert mindestens zwei Kaliumtransporter zur Durchführung der Regulation, KtrI und KtrII zusammen mit dem Kep-System für die K + -Extrusion (8). Obwohl bekannt ist, dass KtrI und KtrII K + -Aufnahmesysteme sind (sie sind K + / H + -Symporter), ist wenig mehr über die Proteine bekannt.
Zellstruktur
Enterokokken sind grampositive Kokken, die typischerweise kurze Ketten bilden oder paarweise angeordnet sind (3). Unter bestimmten Wachstumsbedingungen können sie sich verlängern und kokkobakteriell erscheinen. Die Zellwand von E. faecalis beträgt 20 bis 38% des Trockenzellengewichts (in den exponentiellen und stationären Phasenzellen). Da die E. faecalis ist ein grampositives Bakterium Es gibt drei Hauptkomponenten, die seine Zellwand bilden: peptidoglycan, Teichsäure und Polysaccharid. 40% der Zellwand besteht aus Peptidoglycan, während der Rest der Zellwand aus einem „rhamnosehaltigen Polysaccharid und einer ribithaltigen Teichsäure“ besteht (3). Das Peptidioglycan funktioniert (wie in den meisten grampositiven Zellen), um dem Platzen zu widerstehen, das durch hohen zytoplasmatischen osmotischen Druck induziert wird. E. faecalis wird allgemein als nicht verkapselter Organismus angesehen, was sich am „Fehlen eines nachweisbaren mukoiden Phänotyps“ (3) zeigt. Untergruppen von E. faecalis-Isolaten besitzen jedoch ein Kapselpolysaccharid. E. Fäkalien können genetisches Material (Plasmide) durch Konjugationsprozesse austauschen, die durch kleine Peptidpheromone induziert werden (2). Oberflächenprotein „Aggregationssubstanzen, die einen spezifischen Liganden auf Empfängerzellen erkennen“ sorgen für erfolgreiche Verbindungen zur Konjugation (2).E. faecalis haben auch die Fähigkeit, Oberflächenpili zu bilden, die zur Bildung eines Biofilms führen können. Die E. faecalis-Stämme, die Endokarditis verursachen, enthalten große Mengen dieser Pili. Die Pili ermöglichen die Befestigung an Wirtsoberflächen (z. B. dem Herzgewebe). Die Stämme von E. Fäkalien, die eine Endokarditis verursachen, produzieren den „Biofilm signifikant häufiger und auch stärker als Nicht-Endokarditis-Isolate“ (9).
Ökologie
E. faecalis ist eine sehr vielfältige Art von Enterokokken. Es interagiert mit vielen anderen Organismen und hat Auswirkungen auf die Umwelt. Die Enterokokken sind Mitglieder der Bakteriengemeinschaft, die den Dickdarm beim Menschen bewohnen. Sie sind auch ein natürlicher Teil der Darmflora in den meisten anderen Säugetieren und Vögeln (8). Die Enterokokken kommen auch in Boden, Pflanzen und Wasser vor. Wenn sie in Wasser gefunden werden, liegt dies typischerweise daran, dass das Wasser mit Fäkalien kontaminiert war. Obwohl E. faecalis in Pflanzen nicht allzu häufig vorkommt, wurden bei Pflanzen andere Enterokokkenstämme gefunden, die höchstwahrscheinlich mit einer kontaminierten Wasserquelle in Verbindung gebracht werden (8).Die Ökologie des Antibiotikaresistenz- und Virulenz-Gentransfers in der Umwelt ist noch nicht gut verstanden. Insekten wie Stubenfliegen (HF), die sich in zerfallendem organischem Material entwickeln, können antibiotikaresistente Bakterien aus dem Mist von Tieren und anderen zerfallenden organischen Substraten auf Wohnräume übertragen (7). HF sind aufgrund der lebenden mikrobiellen Gemeinschaften in den Lebensräumen, in denen sie sich entwickeln (z. B. Kot), perfekte Sender. Zu den guten Übertragungseigenschaften kommen die Art und Weise hinzu, wie SIE ihre Jungen füttern (Regurgitation) und ihre Anziehungskraft auf menschliche Nahrung. Da HF lange Strecken fliegen kann, ist dieses Insekt sehr gut für die Verbreitung von Fäkalbakterien geeignet, einschließlich menschlicher und tierischer Krankheitserreger und möglicherweise antibiotikaresistenter Enterokokkenstämme (7). Eine kürzlich durchgeführte Studie auf Antibiotikaresistenz und Virulenzgene in Enterokokken von HF in Fast-Food-Restaurants in Kanasas gescreent. Diese Studie zeigte, dass „Stubenfliegen in Lebensmittelhandhabungs- und Serviereinrichtungen antibiotikaresistente und potenziell virulente Enterokokken tragen können, die die Fähigkeit haben, Antibiotikaresistenzgene horizontal auf andere Bakterien zu übertragen“ (7).Die Auswirkungen, die E. die Auswirkungen von Fäkalien auf die Umwelt sind tendenziell negativer. Sie verseuchen typischerweise die Wasserversorgung, was zu infizierten Pflanzen sowie Infektionen bei Menschen führen kann (8). Die antibiotischen Faktoren können auch von verschiedenen Insekten (z. B. Stubenfliegen) und Tieren transportiert werden, was zu einer zunehmenden Anzahl virulenter E. faecalis führt.
Pathologie
Enterokokken haben sich als Hauptursache für nosokomiale Infektionen herausgestellt, und innerhalb dieser Gruppe verursacht Enterococcus faecalis die Mehrheit der menschlichen Enterokokkeninfektionen. Diese Infektionen können lokal oder systematisch sein und umfassen Infektionen der Harnwege und des Abdomens, Wundinfektionen, Bakteriämie und Endokarditis (2). Da E. faecalis in der Lage ist, zahlreiche Umweltprobleme (wie extreme Temperaturen und das Vorhandensein von Gallensalzen) zu überstehen, und weil sie Resistenzen gegen mehrere Antibiotika entwickeln können, sind diese Bakterien zu einem großen Gesundheitsproblem geworden. Das Nationale nosokomiale Infektionsüberwachungssystem (NNIS) hat seit 1989 einen Anstieg der Inzidenz von Infektionen aufgrund von Vancomycin-resistenten Enterokokken (VRE) gemeldet (1). Dies kann schwerwiegende gesundheitliche Probleme bedeuten, zu denen auch das Fehlen einer verfügbaren Antibiotikatherapie für VRE-Infektionen gehört, da die meisten VRE-Stämme neben Vancomycin (z. B. Aminoglycoide und Ampicillin) Resistenzen gegen mehrere Antibiotika aufweisen. Die Übertragung von Vanocmycin-resistenten Genen von VRE auf andere grampositive Erreger ist ein ernstes Problem für die öffentliche Gesundheit. Die häufigste Art und Weise, wie die E. faecalis-Infektion in einem Krankenhaus / einer Langzeitpflegeeinrichtung auftritt, ist die Übertragung von E. faecalis zwischen Patienten (8). Enterokokken können an den Händen von Gesundheitspersonal getragen und von einem Patienten zum anderen getragen (übertragen) werden. Es wurde gezeigt, dass VRE an den Händen bis zu 60 Minuten anhalten kann (8). Die Übertragung von den Händen eines Gesundheitspersonals auf den Patienten könnte bei Kontakt mit den intravenösen oder Harnkathetern des Patienten erfolgen. Rektalthermometer, die nach Gebrauch nicht ordnungsgemäß gereinigt werden, können die VRE auch von Patient zu Patient übertragen. Manchmal kann die Übertragung zu einer Besiedlung des Magen-Darm-Trakts des Patienten mit dem erworbenen Stamm führen. Der neue Stamm wird dann Teil der endogenen Flora des Patienten (8). Der erworbene Stamm, der Antibiotikaresistenzgene trägt, kann im Magen-Darm-Trakt leben. Infektionen entstehen dann aus diesen neu erworbenen E. faecalis-Stämmen.E. faecalis kann viele Infektionen im menschlichen Körper verursachen. Die häufigste Infektion durch Enterokokken ist eine Infektion der Harnwege. E. faecalis kann Infektionen der unteren Harnwege (UTI) wie Zystisis, Prostatitis und Epididymitis verursachen (8). E. faecalis kommt auch bei intraabdominalen, Becken- und Weichteilinfektionen vor. Das E. Fäkalien können nosokomiale Bakteriämie verursachen. Die Quelle der Bakteriämie ist meistens der Harntrakt, der von einem infizierten intravenösen Katheter ausgeht. Endokarditis ist die schwerste Enterokokkeninfektion, da sie eine Entzündung der Herzklappen verursacht. In vielen Fällen von Endokarditis schlägt die Antibiotikabehandlung fehl und eine Operation zur Entfernung der infizierten Klappe ist erforderlich (8). Weniger häufige Infektionen durch E. faecalis sind Meningitis, hämatogene, Osteomyelitis, septische Arthritis und (sehr selten) Lungenentzündung. Aufgrund der Resistenz von Enterokokken gegen viele Antibiotika ist die Behandlung dieser Infektionen schwierig.
Anwendung in der Biotechnologie
Enterokokken wurden auf ihre mögliche Verwendung als Probiotikum untersucht (ein Nahrungsergänzungsmittel, das lebende, nicht virulente mikrobielle Zellen enthält, von denen angenommen wird, dass sie bei Einnahme die Zusammensetzung der Darmflora positiv beeinflussen). Es wurde gezeigt, dass die Verabreichung des E. faecalis-Stammes Durchfall reduziert. Die E. faecalis-Probiotika werden in Hühner- / Schweine- / Rinderfutter verwendet, um Durchfall bei den Tieren zu senken (8).
Aufgrund der hohen krankheitsverursachenden Eigenschaften von E. faecalis wurde viel mehr darüber geforscht, wie die Virulenz von E. faecalis gestoppt werden kann, als über die vorteilhafte Verwendung von E. faecalis.
Aktuelle Forschung
1.) Hoffnung auf Infektionen durch Enterococcus faecalis (4)
Es ist bekannt, dass Vancomycin-resistente Bakterien (z. B. E. faecalis) der Gesellschaft viele Probleme bereiten und bakterielle Infektionen beim Menschen verursachen, die schwer zu behandeln sind. Die Enterokokkeninfektionen sind eine Herausforderung, da die Organismen die Fähigkeit haben, Resistenzgene schnell zu erwerben und zu verbreiten. Ceftobiprol (BPR) wurde als Cephalosporin-Prüfpräparat gegen grampositive Kokken eingesetzt. BPR ist ein parenterales Cephalosporin mit breitem Spektrum und hohen Affinitäten zu grampositiven und gramnegativen Penicillin-bindenden Proteinen. Es zeigt auch Stabilität gegen Hydrolyse durch β-Lactamasen.Diese Studie untersuchte die Aktivität von BRP gegen eine große Sammlung von E. faecalis und untersuchte die bakterizide Aktivität von BPR gegen Vancomycin-resistente Isolate. Die Studie ergab, dass die Empfindlichkeit gegenüber BPR bei E. faecalis nicht durch das Vorhandensein einer Vancomycinresistenz oder durch die β-Lactamase-Produktion beeinflusst wird. In den Stämmen von E. faecalis, die entweder Vancomycinresistenz (VANA- und VanB-Phänotypen) oder Ampiciliinresistenz zeigten, war die BPR bakterizid. Die Forscher zeigten, dass BPR bei einer Dosis von 750 mg bakterizide Aktivität gegen E. faecalis zeigte und 100% der E. faecalis-Aktivität hemmte. Obwohl die Anwesenheit des Enzyms β-Lactamase in E. faecalis selten ist, beeinträchtigt seine Anwesenheit die Verwendung der wirksamsten Anti-Enterokokken-β-Lactame (z. B. Ampicillin). BPR ist ein schlechtes Substrat für das β-Lactamaseenzym, was seine ausgezeichnete Aktivität gegen β-Lactamase erklärt, die E. faecalis produziert.Diese Forschung zeigte, dass BPR eine starke Aktivität gegen eine sehr große Sammlung von E. faecalis hat. Die Aktivität des BPR wurde nicht durch Vancomycinresistenz oder Produktion von β-Lactamase beeinflusst. Daher ist BPR ein vielversprechendes Mittel zur Behandlung von β-Lactamase-produzierenden und Vancomycin-resistenten E. faecalis-Infektionen beim Menschen.
2.) Untersuchen, wie Enterococcus faecalis gegen das Medikament Linezolid resistent wird (5)
Wenn Antibiotika zur Behandlung einer bakteriellen Infektion eingesetzt werden, können sie Auswirkungen auf die Darmflora haben. Resistente Bakterien können während der Behandlung ausgewählt werden, wie die Enterokokken, und sind potentiell pathogen. Das Auftreten von Resistenzen ist ein Problem für neue Antibiotika, da dies die Nützlichkeit von Antibiotika gefährden könnte.Diese Studie untersuchte die Entstehung von Resistenzen gegen Antibiotika durch E. faecalis. Insbesondere untersuchten die Forscher die Resistenz gegen Linezolid (das erste einer neuen Klasse von Antibiotika, die als „Oxazolidinone“ bekannt sind). Linezolid kann gegen multiple arzneimittelresistente grampositive Kokken, einschließlich VRE, angewendet werden. Es hemmt die bakterielle Proteinsynthese, indem es spezifisch an eine Domäne in der 50S-ribosomalen Untereinheit bindet und nicht von den Resistenzmechanismen beeinflusst wird, die andere Antibiotika beeinflussen. Diese Studie untersuchte die Rate des Auftretens von Linezolid-resistenten E. faecalis-Mutanten im Verdauungstrakt von gnotobiotischen Mäusen. Die Dosis von Linezolid wurde in Wasser mit einer Dosis von 0,5, 0,005 bis 0,005 g / l verabreicht. Die Mutanten waren alle abhängig von dem verabreichten Linezolid, die Resistenzniveaus nahmen mit der Expositionsdauer zu. In Abwesenheit von Linezolid wurden keine Mutanten isoliert, was darauf hindeutet, dass eine De-Novo-Resistenz gegen Linezolid bei den Enterokokken ungewöhnlich war.Die Forschung ergab, dass eine Mutation in einem einzelnen 23S-rRNA-Gen der entscheidende Schritt bei der Entstehung einer Linezolid-Resistenz war. Die primäre Besiedlung mit Einzelmutationsmutanten wurde bereits 5 Tage nach Behandlungsbeginn bei Mäusen beobachtet.Diese Experimente mit Mäusen helfen, das Muster des Auftretens von Resistenzen gegen Linezolid zu erklären, das in klinischen Isolaten beobachtet wurde. Das Forschungsteam zeigte, dass die Dosis für die Dynamik der Resistenz entscheidend ist. Diese Ergebnisse sollten dazu beitragen, die besten therapeutischen Strategien zu definieren, um das Auftreten von Resistenzen im klinischen Umfeld zu minimieren und möglicherweise viele Leben zu retten.
3.) Eine Ser / Thr-Kinase in Enterococcus faecalis vermittelt antimikrobielle Resistenzen (6)
Enterococcus faecalis verursacht viele der antibiotikaresistenten Infektionen in Krankenhäusern, eine Folge seiner inhärenten Resistenz gegen bestimmte Antibiotika und seiner Fähigkeit, im Darmtrakt zu überleben und sich zu vermehren.Die genetische Grundlage der Resistenz in E gesehen. faecalis ist nicht bekannt, diese Forschung versucht, eine Ursache für die Resistenz zu identifizieren. Die Forscher zeigten, dass PrkC, ein Einkomponenten-Signalprotein, das eine eukaryotische Ser / Thr-Kinase-Domäne enthält, eine inhärente antimikrobielle Resistenz und intestinale Persistenz von E. faecalis ermöglicht. Sie fanden heraus, dass eine E. faecalis-Mutante, der PrkC fehlte, in Abwesenheit von antimikrobiellem Stress mit einer Wildtyp-Rate wuchs, aber eine erhöhte Empfindlichkeit gegenüber zellhüllenaktiven Verbindungen zeigte, einschließlich Antibiotika, die auf Zellwandbiogenese und Gallendetergenzien abzielten.PrkC reguliert physiologische Prozesse in E. faecalis, die der Schlüssel zu seinem Erfolg als nosokomialer Erreger sind. Die von den Forschern vorhergesagte Struktur von PrkC war eine zytoplasmatische Kinasedomäne, die durch ein Transmembransegment getrennt war, von dem angenommen wurde, dass es nicht vernetztes Peptidoglycan bindet. Dies deutete darauf hin, dass PrkC ein Transmembranrezeptor war, der die Integrität der E. faecalis-Zellwand überwacht und adaptive Reaktionen vermittelt, um diese Intergrität aufrechtzuerhalten. PrKC ist wichtig für E. Fäkalien verursachen nosokomiale Infektionen, was darauf hindeutet, dass das Signalprotein ein Ziel für die Entwicklung von Therapien ist, um Infektionen durch antibiotikaresistente Enterokokken zu verhindern.
1.) I. T. Paulsen, L. Banerjei, G. S. A. Myers, K. E. Nelson, R. Seshadri, T. D. Read, D. E. Fouts, J. A. Eisen, S. R. Gill, J. F. Heidelberg, H. Tettelin, R. J. Dodson, L. Umayam, L. Brinkac, M. Beanan, S. Daugherty, R. T. DeBoy, S. Durkin, J. Kolonay, R. Madupu, W. Nelson, J. Vamathevan, B. Tran, J. Upton, T. Hansen, J. Shetty, H. Khouri, T. Utterback, D. Radune, K. A. Ketchum, B. A. Dougherty, C. M. Fraser. „Rolle der mobilen DNA in der Evolution von Vancomycin-resistenten Enterococcus faecalis.“ Wissenschaft. März 2003. Vol. 299, Nr. 5615. s. 2071-2074
2.) Murrary SEIN. Mai 1998. „Vielfalt unter den multiresistenten Enterokokken.“ Aufkommende Infektionskrankheiten. Vol. 4, Nr. 1. s. 46-65.
3.) De la Maza, Luis M., Marie T. Pezzlo, und Janet T. Shigei. Farbatlas der medizinischen Bakteriologie. Washington, DC: Amerikanische Gesellschaft für Mikrobiologie Presse, 2004.
4.) Arias C., Singh K., Panesso D., Murray BE. „Time-Kill- und Synergismusstudien von Ceftobiprol gegen Enterococcus faecalis, einschließlich ß-Lactamase-produzierender und Vancomycin-resistenter Isolate.“ Antimikrobielle Mittel und Chemotherapie. Juni 2007. Vol. 51, Nr. 6. s. 2043-2047.
5.) Bourgeois-Nicolaos N., Massias L., Couson B., Butel MJ, Andremont A., Doucet-Populaire F. „Dosisabhängigkeit der Entstehung von Resistenzen gegen Linezolid in Enterococcus faecalis In Vivo.“ Das Journal für Infektionskrankheiten. 2007. Vol. 195. s. 1480-1488.
6.) Kristich C., Wells C., Dunny G. „Eine Ser / Thr-Kinase vom eukaryotischen Typ in Enterococcus faecalis vermittelt antimikrobielle Resistenz und Darmpersistenz.“ Proceedings der Nationalen Akademie der Wissenschaften der Vereinigten Staaten von Amerika. Februar 2007. Vol. 104, Nr. 9. s. 3508-3513.
7.) Macovei, L., Zurek, L. „Ökologie von Antibiotikaresistenzgenen: Charakterisierung von Enterokokken aus Stubenfliegen, die in Lebensmitteln gesammelt wurden.“ Angewandte und Umweltmikrobiologie. Juni 2006. Vol. 72, Nr. 6. s. 4028-4035.
8.) Gilmore, Michael. Die Enterokokken: Pathogenese, Molekularbiologie und Antibiotikaresistenz. Washington, DC: Amerikanische Gesellschaft für Mikrobiologie Presse, 2002.
9.)Nallapareddy SR, Singh KV, Sillanpää J, Garsin DA, Höök M, Erlandsen SL, Murray BE.. „Endokarditis und Biofilm-assoziierte Pili von Enterococcus faecalis.“ Das Journal der klinischen Untersuchung. Oktober 2006. Nr.116. s.2799-2807.
Herausgegeben von Richard A. Martinez von der UC San Diego, Schüler von Rachel Larsen.