Chemguide: Core Chemistry 14 – 16
Doppel- und Dreifach-kovalente Bindungen
Diese Seite stellt die Möglichkeit von mehrfachen (doppel- oder Dreifach-) kovalenten Bindungen zwischen Atomen vor, wobei Sauerstoff, Stickstoff, Kohlendioxid und Ethen als Beispiele verwendet werden. Diese werden ausgewählt, weil sie alle häufig in britischen Lehrplänen für 14- bis 16-Jährige angegeben sind.
Ich gehe davon aus, dass Sie die Seite Einführung in die kovalente Bindung gelesen haben und Zugriff auf ein Periodensystem haben, wie Sie es von dieser Website herunterladen können.
Doppelbindung in Sauerstoff
Wenn Sie Sauerstoff im Periodensystem nachschlagen, werden Sie feststellen, dass es eine Ordnungszahl von 8 hat – und so hat das neutrale Atom 8 Protonen und 8 Elektronen. Diese werden angeordnet 2,6.
Sie haben also zwei Atome wie folgt:
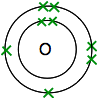
Jedes hat zwei ungepaarte Elektronen. Um die maximale energetische Stabilität zu erhalten, müssen alle diese gepaart werden.
Also teilen sich die Sauerstoffstoffe zwei Elektronenpaare:
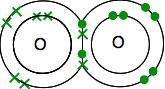
Dies ist viel einfacher zu sehen, wenn Linien verwendet werden, um Paare gemeinsamer Elektronen darzustellen:
![]()
Dreifachbindung in Stickstoff
Wenn Sie Stickstoff im Periodensystem finden, sie können herausfinden, dass seine elektronische Struktur 2,5 ist. Vergleicht man es mit Sauerstoff, hat es daher ein Elektronenpaar und drei ungepaarte Elektronen in seiner äußeren Ebene.
Um es so energetisch stabil wie möglich zu machen, muss es all diese in kovalenten Bindungen paaren. Zwei Stickstoffatome verbinden sich daher auf diese Weise:
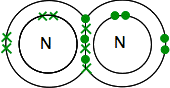
Dies ist wiederum viel einfacher zu erkennen, wenn Linien verwendet werden, um Paare gemeinsamer Elektronen darzustellen:
![]()
Doppelbindung in Kohlendioxidp Die elektronische Struktur von Kohlenstoff ist 2,4 mit 4 ungepaarten Elektronen in der äußeren Ebene.
Sauerstoff ist 2,6 mit 2 Elektronenpaaren und 2 ungepaarten Elektronen in der äußeren Ebene.
Am Ende müssen alle Elektronen gepaart sein – und es gibt nur einen Weg, dies zu tun.
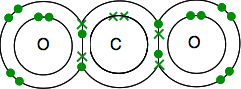
Nach wie vor ist die Bindung mit Linien zum Binden von Elektronenpaaren leichter zu erkennen.
![]()
Wenn es zwei Bindungspaare von Elektronen zwischen zwei Atomen gibt, wird es nicht überraschend eine Doppelbindung genannt. So ist jeder Sauerstoff durch eine Doppelbindung mit dem Kohlenstoffatom in der Mitte verbunden.
Doppelbindung in Ethen, C2H4
Ethen und andere ähnliche Verbindungen mit Doppelbindungen zwischen Kohlenstoffatomen sind wichtige Substanzen in der Chemie. Sie werden sie später im Kurs genauer kennenlernen.
Schauen Sie sich das Punkt-Kreuz-Diagramm genau an und stellen Sie sicher, dass Sie verstehen, wie alles zusammenpasst. Es muss so sein, damit alle einzelnen Elektronen sowohl in den Kohlenstoffen als auch in den Wasserstoffatomen in Bindungspaaren gepaart werden.
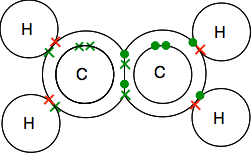
Wenn Sie auf Diagramme stoßen, die die Bindungspaare als Linien zeigen, finden Sie möglicherweise eine von zwei Versionen.
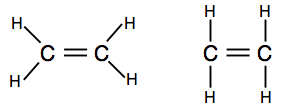
Der erste zeigt die tatsächliche Form des Moleküls besser, aber der zweite ist auch auf dieser Ebene vollkommen akzeptabel.
Wo möchten Sie jetzt hin?
Zur nächsten Seite in diesem Abschnitt über kovalente Bindung . . .
Zum Menü atomare Struktur und Bindung . . .
Zum Menü Chemie 14-16 . . .
Zum Chemguide Hauptmenü . . .