Was ist Ionenbindung?
Chemische Bindungen bilden sich, wenn die Gesamtenergie der gebundenen Atome niedriger ist als die Gesamtenergie der einzelnen Atome.Die Form der Bindung wird durch die Elektronenanordnung bestimmt, die die Energie minimiert.
In einigen Fällen werden Elektronen zwischen Atomen geteilt – dies wird als kovalente Bindung bezeichnet.
In anderen Fällen erfolgt eine vollständige Übertragung eines oder mehrerer Elektronen von einem Atom auf ein anderes.Das Atom, das Elektronen verliert, wird zu einem positiv geladenen Ion.Das Atom, das Elektronen empfängt, wird zu einem negativ geladenen Ion.
Dies führt zur Ionenbindung – der gegenseitigen elektrostatischen Anziehung von positiv und negativ charges.In in seiner reinsten Form ist die Ionenbindung nicht gerichtet. Es kann als einfache coulombsche Anziehung zwischen Punktladungen angesehen werden.Dies unterscheidet sich von der kovalenten Bindung, bei der die gemeinsame Nutzung von Elektronen zu gerichteten Bindungen führt.
Elektronentransfer
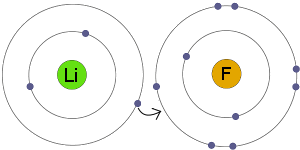
Li überträgt ein Elektron nach F. Das Ergebnis ist, dass sowohl die resultierenden Ionen elektrisch geladen werden als auch vollständige, stabile Ionen aufweisen, die elektronenschalen.
Elektrostatische Anziehung
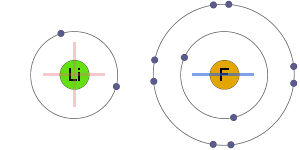
Die positiven und negativen Ionen werden elektrostatisch von einem – eine andere, was zu einer ionischen Bindung führt.
Die coulombsche Kraft hat keine Vorzugsrichtung, so dass ionische Verbindungen dazu neigen, als riesige Kristallgitterstrukturen von Ionen zu existieren, die zusammen gepackt sind.
Eine Probe des Kristallgitters von Lithiumfluorid

Elektronegativität und Ionenbindung
Zwei Elemente neigen dazu, sich ionisch zu verbinden, wenn sie sich in der Elektronegativität stark unterscheiden.
Periodensystem der Elektronegativität
Je heller der Grünton, desto höher die Elektronegativität. Grau bedeutet, dass kein Wert bekannt ist. (Bild anklicken für größere Ansicht.)

Kovalenter Bindungscharakter
Absolut reine ionisch gebundene Verbindungen existieren nicht wirklich, da das positiv geladene Ion die Elektronenwolke des negativen Ions polarisiert.Dies macht sich besonders bei kleinen, hochgeladenen Metallionen wie Al bemerkbar 3+, obwohl der polarisierende Effekt in gewissem Maße in allen ionischen Verbindungen vorhanden ist.Polarisation ist effektiv ein gerichteter Elektronenteilungseffekt, daher führt sie eine geringe Menge an Kovalenz in ionischen Verbindungen ein.
Der Anteil des ionischen / kovalenten Verhaltens in einer Bindung kann sehr grob mit der Pauling-Skala der Elektronegativität beurteilt werden.Linus Pauling schätzte, dass eine Elektronegativitätsdifferenz von 1,7 zwischen den Elementen zu einer Bindung führt, die zu 50 Prozent ionisch ist.
Werte unter 1 entsprechen dominierender kovalenter Bindung und Werte über 2 dominierender ionischer Bindung.
Electronegativity of Selected Elements (Pauling Scale)
| Element | Electronegativity |
|---|---|
| hydrogen | 2.20 |
| lithium | 0.98 |
| sodium | 0.93 |
| aluminum | 1.61 |
| carbon | 2.55 |
| oxygen | 3.44 |
| chlorine | 3.16 |
| iodine | 2.66 |
Die C-H-Bindung mit einer Differenz von 0,35 ist kovalent, während die NaCl-Bindung bei 2,23 ionisch ist.Die HCl-Bindung bei 0,96 ist polar kovalent und die LiI-Bindung bei 1,68 ist 50/50 ionisch / kovalent.
Der größte Elektronegativitätsunterschied beträgt 3,19 zwischen Cäsium (0,79) und Fluor (3,98). Die resultierende Bindung hat etwa 95 Prozent ionischen Charakter.
