Eigenschaften kovalenter Verbindungen
Als wir über feste ionische Verbindungen in ionischen Verbindungen sprachen, stellten wir fest, dass ihre Eigenschaften häufig auf die starke Anziehungskraft entgegengesetzter elektrischer Ladungen zurückzuführen sind. Es sollte nicht überraschen, dass die Eigenschaften kovalenter Verbindungen weitgehend auf die Natur kovalenter Bindungen zurückzuführen sind.
Eines der wichtigsten Dinge, an die man sich bei kovalenten Verbindungen erinnern sollte, ist, dass sie nicht ionisch sind. Dies scheint offensichtlich, aber der Unterschied ist tatsächlich subtiler als Sie sich vorstellen können. Um dieses Konzept zu veranschaulichen, schauen Sie sich die folgende Abbildung an:
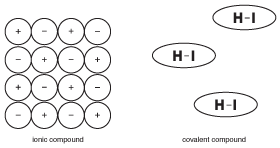
Abbildung 9.5Die Eigenschaften fester ionischer Verbindungen beruhen auf der Tatsache, dass viele Ionen mit elektrischen Kräften starr an Ort und Stelle gehalten werden. Moleküle in kovalenten Verbindungen arbeiten jedoch relativ unabhängig von benachbarten Molekülen.
Im Gegensatz zu ionischen Verbindungen, bei denen alle Ionen in einem großen Kristall dazu beitragen, sich gegenseitig zusammenzuhalten, werden die Moleküle in einer kovalenten Verbindung durch Kräfte zusammengehalten, die als „intermolekulare Kräfte“ bezeichnet werden und viel schwächer sind als chemische Bindungen (mehr über intermolekulare Kräfte in Festkörpern). Infolgedessen werden die Moleküle in einer kovalenten Verbindung nicht so stark voneinander angezogen wie die Ionen in ionischen Verbindungen. Dieser Unterschied in der Struktur ist wichtig für das Verständnis der Eigenschaften kovalenter Verbindungen.
Kovalente Verbindungen haben niedrige Schmelz- und Siedepunkte
Wie bei ionischen Verbindungen erwähnt, ist aufgrund der starken Wechselwirkungen zwischen den Kationen und Anionen in einem ionischen Kristall eine große Energiemenge erforderlich, um eine ionische Verbindung zu schmelzen. In kovalenten Verbindungen sind jedoch alle Moleküle nur schwach an benachbarte Moleküle gebunden; Daher wird sehr wenig Energie benötigt, um kovalente Moleküle voneinander zu trennen.
Viele beginnende Chemiestudenten glauben fälschlicherweise, dass kovalente Bindungen gebrochen werden, wenn ein kovalentes Molekül schmilzt. Das ist falsch. Wenn ionische Verbindungen schmelzen, versagt die ionische Anziehung. Wenn kovalente Verbindungen schmelzen, ziehen sich die Moleküle einfach voneinander weg und lassen die Bindungen intakt.
Kovalente Verbindungen sind schlechte Leiter
Ionische Verbindungen sind große elektrische Leiter, wenn sie gelöst oder geschmolzen sind. Wie in ionischen Verbindungen erwähnt, liegt dies daran, dass ionische Verbindungen bewegliche Ionen aufweisen, die elektrische Ladung von einem Ort zum anderen übertragen können. Sie leiten auch Wärme sehr gut, weil die Ionen alle direkt nebeneinander liegen, wodurch Energie effizient von einem Ort zum anderen übertragen werden kann.
Kovalente Verbindungen hingegen sind fast immer gute Isolatoren für Elektrizität und Wärme. Elektrizität kann nicht effizient durch kovalente Verbindungen leiten, da keine Ionen vorhanden sind, um die elektrische Ladung zu bewegen. Ein hervorragendes Beispiel dafür ist in Ihrem eigenen Haus, wo das Metall in Ihren Verlängerungskabeln mit Kunststoff bedeckt ist, um einen Stromschlag Ihrer Katze zu vermeiden. Wärme wandert auch nicht gut durch kovalente Verbindungen, da die Moleküle nicht so eng aneinander gehalten sind wie die Ionen in einer ionischen Verbindung, was die Wärmeübertragung weniger effizient macht. Aus diesem Grund verwenden Sie Ofenhandschuhe, um Ihre Kekse aus dem Ofen zu nehmen, anstatt Ihre Hände mit Salz zu überziehen.
Kovalente Verbindungen brennen manchmal
Organische Verbindungen sind kovalente Verbindungen, die Kohlenstoff enthalten. Sie enthalten in der Regel auch Wasserstoff. und kann kleinere Mengen anderer Elemente wie Stickstoff, Schwefel, Phosphor, Sauerstoff oder eines der Halogene enthalten.
Viele kovalente Verbindungen sind brennbar und brennen leicht unter Wärmezufuhr. Die Hauptgruppe der kovalenten Verbindungen, die brennbar sind, werden organische Verbindungen genannt. Organische Verbindungen verbrennen, weil sie Kohlenstoff und Wasserstoff enthalten, die sich bei hohen Temperaturen gut mit Sauerstoff verbinden.
Es ist wichtig zu bedenken, dass nicht alle kovalenten Verbindungen brennen?zum Beispiel ist Wasser eine kovalente Verbindung und es fällt Ihnen sehr schwer, damit ein Feuer zu entfachen. Es sind jedoch viel mehr kovalente als ionische Verbindungen brennbar.
Entflammbarkeit ist eine allgemeine Eigenschaft von kovalenten Verbindungen, da eine große Mehrheit der bekannten kovalenten Verbindungen organisch sind. Da die meisten organischen Verbindungen brennen, können wir dies sicher als eine Eigenschaft kovalenter Verbindungen auflisten, obwohl es viele kovalente Verbindungen gibt, die nicht brennen.Auszug aus The Complete Idiot’s Guide to Chemistry 2003 von Ian Guch. Alle Rechte vorbehalten, einschließlich des Rechts der Vervielfältigung ganz oder teilweise in irgendeiner Form. Wird in Absprache mit Alpha Books, einem Mitglied der Penguin Group (USA) Inc., verwendet.
Um dieses Buch direkt beim Verlag zu bestellen, besuchen Sie die Penguin USA-Website oder rufen Sie 1-800-253-6476 an. Sie können dieses Buch auch bei Amazon kaufen.com und Barnes & Edel.