Antiaromatische Verbindungen sind ungewöhnlich instabil
Was sind die Schlüsselfaktoren, die bestimmen, ob ein Molekül antiaromatisch ist?
In unseren vorherigen Beiträgen in unserer Serie über Aromatizität , , Wir haben gesehen, dass aromatische Moleküle ungewöhnlich stabil sind. Sie haben besonders große Resonanzenergien, neigen eher zu Substitutions- als zu Additionsreaktionen und haben delokalisierte Pi-Elektronen (alle C-C-Bindungslängen in Benzol sind beispielsweise gleich).
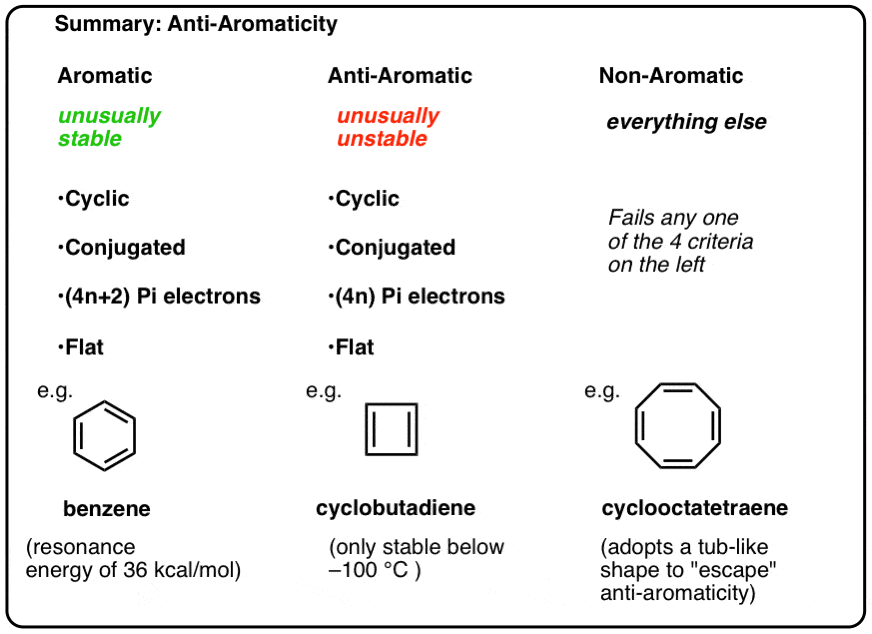
Um aromatisch zu sein, muss ein Molekül die folgenden vier strukturellen Eigenschaften besitzen:
- cyclisch
- ringsum konjugiert
- pi-Elektronen haben
- flach (planar)
Wenn diese vier Bedingungen erfüllt sind, ist das Molekül aromatisch.
Wenn es auch nur eine Frage im Test durchbrennt, ist es nicht aromatisch.
Das scheint ziemlich klar zu sein. Oder doch?
Sie könnten anhand der Art und Weise, wie ich diese Frage stelle, erraten, dass die Antwort „nicht ganz“ ist. : – )
Inhaltsverzeichnis
- Einige Moleküle sind so spektakulär und ungewöhnlich instabil und schwer zu isolieren, dass sie eine eigene Kategorie verdienen:Antiaromatisch
- Cyclopentadienylkation: Das „resonanzstabilisierte“ Carbokation, das nicht stabil ist
- Antiaromatische Dreiringe: Oxiren, 1H-Aziren, Thiiren
- Cyclobutadien ist antiaromatisch
- Ein 8 Pi-Elektronenbeispiel einer antiaromatischen Verbindung: Pentalen
- Was macht ein Molekül antiaromatisch?
- Cyclooctatetraen „entweicht“ der Antiaromatik durch Verdrehen aus der Ebenheit
- Schlussfolgerung: Antiaromatische Verbindungen
- Anmerkungen
- Erweitert: Referenzen und weiterführende Literatur
1. Spektakulär instabile Moleküle, die eine Kategorie für sich bilden: „Antiaromatisch“
Hier ist die Sache. Es gibt eine kleine Anzahl von Molekülen, die den Aromatizitätstest durchlaufen und nicht nur nicht aromatisch sind: sie haben die Eigenschaft, so spektakulär und ungewöhnlich instabil und schwer zu isolieren, dass sie einen anderen Namen verdienen.
Wir nennen diese Moleküle „antiaromatisch“.
Interessant ist, dass die Moleküle selbst in vielen Fällen von Anfang an nicht besonders instabil erscheinen, im Gegensatz zu beispielsweise Cuban. Komischerweise können Sie Cubane (mehr oder weniger) von Aldrich kaufen, aber die meisten der antiaromatischen Moleküle, die wir unten diskutieren werden, sind nur bei extrem niedrigen Temperaturen stabil – wenn sie überhaupt isoliert werden können!
2. Cyclopentadienylkation: Das „resonanzstabilisierte“ Carbokation, das nicht stabil ist
Beginnen wir unsere Reise durch das Kaninchenloch mit einem einfachen Beispiel, das aus der organischen Chemie des ersten Semesters bekannt erscheinen sollte.
Erinnerst du dich an die SN1-Reaktion? Die Katze, die zuerst den bequemen Stuhl verlässt?
Kurzer Rückblick: Beginnen Sie mit einem Alkylhalogenid. Die Abgangsgruppe verlässt und bildet ein Carbokation. Nukleophile Angriffe. Es wird SN1 genannt, weil der geschwindigkeitsbestimmende Schritt (Carbokationsbildung) unimolekular ist. Fazit: Je stabiler das Carbokat ist, desto schneller verläuft die Reaktion. Daher ist die Reaktionsgeschwindigkeit für Alkylhalogenide tertiär > sekundär > primär, und die Carbokation erhält spezielle Bonuspunkte, wenn sie durch Resonanz stabilisiert wird.
Schauen Sie sich diese beiden SN1-Reaktionen an. Welche würde Ihrer Meinung nach schneller ablaufen – die SN1-Reaktion, die ein sekundäres Carbokation durchläuft (A), oder die SN1-Reaktion, die ein sekundäres Carbokation durchläuft und mehrere Resonanzformen bilden kann (B)?
Nach allem, was Sie bisher gelernt haben, würden Sie erwarten, dass die Antwort B) .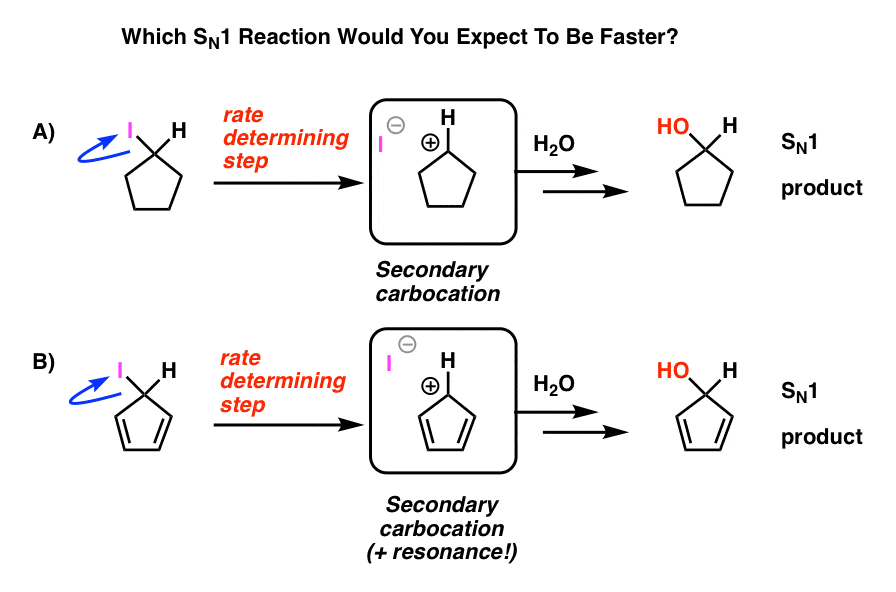
Das ist es nicht.
Die Antwort ist, dass die Reaktion A) schneller abläuft. Reaktion B findet überhaupt nicht statt.
Das sollte dir sehr seltsam vorkommen.
Das ist es!
Wie kommt es, dass dieses vermeintlich resonanzstabilisierte Carbokation weniger stabil ist als ein sekundäres Carbokation?
Wie oft wird schließlich in den Kopf gebohrt, dass Resonanz Moleküle stabilisiert, insbesondere Carbokationen?
Aber hier scheint es destabilisierend zu sein. Es ist … es ist …

Aber instabil ist es! Das Cyclopentadienylkation ist unglaublich instabil und schwierig herzustellen – und das nicht aus Mangel an Versuchen. Die Struktur des Cyclopentadienylkations hat etwas sehr Seltsames, das ihm eine ungewöhnliche Instabilität verleiht.

Zyklisch, konjugiert, flach…. und hat 4 pi-Elektronen. Interessant!
3. Antiaromatische dreigliedrige Ringe: Oxiren, 1H-Aziren, Thiiren
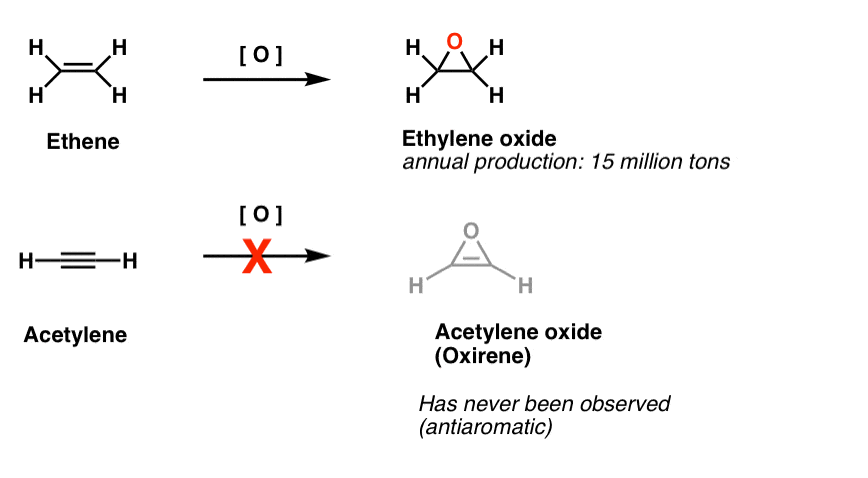
Eine andere Klasse von „schwer fassbaren“ Molekülen ist eine Familie von dreigliedrigen Ringen. Sie erinnern sich vielleicht an Org 1, dass es einfach ist, Epoxide aus Alkenen mit einem Oxidationsmittel wie m-CPBA herzustellen.
Haben Sie sich jemals gefragt, warum wir nie die gleiche Reaktion für Alkine behandelt haben?
Nun, es ist nicht aus Mangel an Versuchen. Chemiker haben alle Arten von Methoden zur Epoxidierung von Alkinen ausprobiert, und wissen Sie was? Die Reaktion funktioniert einfach nicht.
Zum Beispiel würde die Epoxidierung von Acetylen das folgende Molekül ergeben (Oxiren).
Oxirene selbst wurde nie beobachtet, obwohl es verlockende Spuren seiner flüchtigen Existenz gibt. Und übrigens hat weder das Stickstoffanalogon, 1H-Aziren, noch das Thiiren.
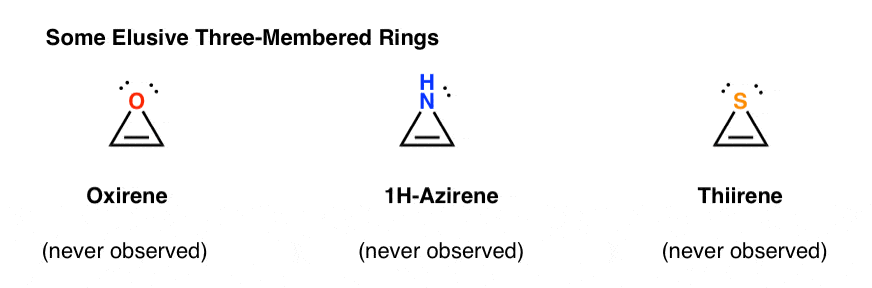
Warum nicht? Was ist das Besondere an jedem dieser Fälle?
Sie werden vielleicht bemerken, dass diese Moleküle wie das Cyclopentadienylkation zyklisch, konjugiert, flach sind und 4 pi-Elektronen haben (zwei in der Pi-Bindung und zwei aus einem einsamen Paar).
OK. Was könnte sonst noch zyklisch, konjugiert, flach sein und 4 pi-Elektronen haben?
4. Cyclobutadien ist antiaromatisch
Cyclobutadien sieht aus wie ein einfaches Molekül, wurde aber erst 1965 synthetisiert. Und selbst dann wurde festgestellt, dass es bei Temperaturen über 35 Kelvin nicht stabil ist.
Die Frage ist, warum?

Sicher, es ist ein viergliedriger Ring, und ja, es hat eine Menge Ringdehnung, aber es wurden mehr gespannte Moleküle hergestellt, die tatsächlich bei Raumtemperatur stabil sind.
Sie können auch feststellen, dass Cyclobutadien wie die obigen Beispiele ein weiteres Beispiel für ein Molekül ist, das cyclisch, konjugiert, 4 pi-Elektronen hat und flach ist.
Noch interessanter ist, was man über die Geometrie von Cyclobutadien gelernt hat. Anstatt ein Molekül mit identischen Bindungslängen (wie Benzol) zu sein, hatte Cyclobutadien eine rechteckige Form, was darauf hinweist, dass die Elektronen nicht delokalisiert waren.
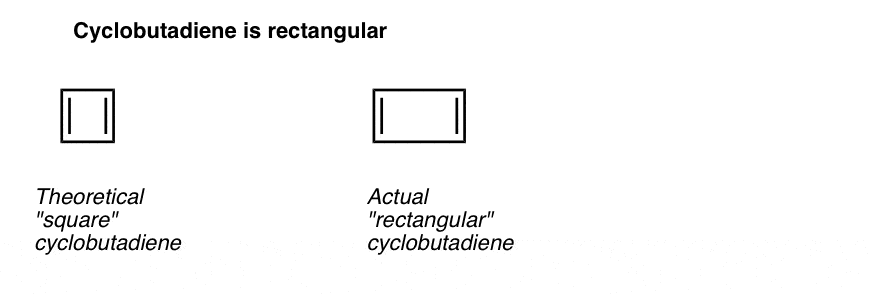
Dies sagt uns, dass selbst wenn ein Molekül alle Bedingungen erfüllt (zyklische, konjugierte, flache, 4 pi-Elektronen), die symmetrische Geometrie besonders instabil ist. . Sehr interessant!
Ein 8 Pi-Elektronen-Beispiel einer antiaromatischen Verbindung: Pentalen
Bisher hatten alle Beispiele, die wir bisher gesehen haben, 4 Pi-Elektronen. Sie fragen sich vielleicht: Gibt es Beispiele für antiaromatische Moleküle mit mehr als 4 pi-Elektronen? Warum, ja.
Das Molekül unten heißt „Pentalen“. Es wurde synthetisiert, ist aber nur unter -100 ° C stabil. Oberhalb dieser Temperatur verbindet es sich mit einem anderen Molekül von sich (Referenz). Ein weiteres Beispiel für spektakuläre Instabilität.

Pentalen hat 8 pi-Elektronen. Dies könnte einige Alarmglocken der Anerkennung auslösen. Denken Sie daran, wie die Anzahl der Pi-Elektronen in aromatischen Molekülen der Sequenz folgte (2, 6, 10, 14….) ?
Dieses Beispiel legt nahe, dass die Anzahl der Pi-Elektronen in antiaromatischen Molekülen der Sequenz folgt (4, 8, 12…)
Was macht ein Molekül antiaromatisch?
Was haben also all diese Moleküle in der Galerie dieser Schurken gemeinsam?
Jedes von ihnen ist zyklisch, konjugiert und flach – und wenn Sie die Anzahl der Pi-Elektronen zählen, ist es ein Vielfaches von 4. Während aromatische Moleküle also (4n + 2) pi-Elektronen haben, ist die „Regel“ für antiaromatische Moleküle (4n). (eine andere Sichtweise: Die Anzahl der Pi-Elektronen ist doppelt so hoch wie eine gerade Zahl).
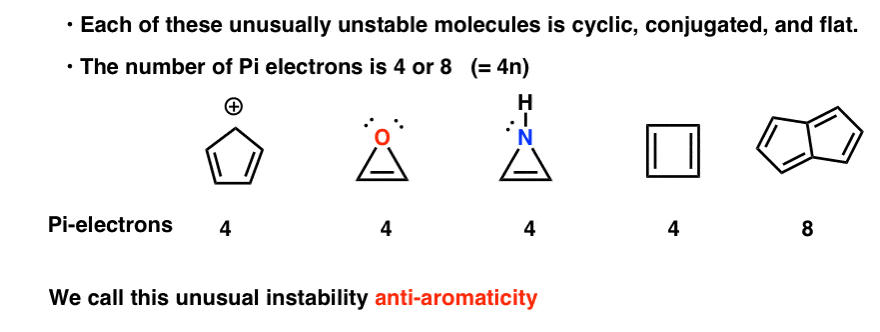
Diese ungewöhnliche Instabilität wird „Antiaromatizität“ genannt.
Dies bedeutet, dass wir nun drei Kategorien für Moleküle nach folgenden Kriterien erstellen können:
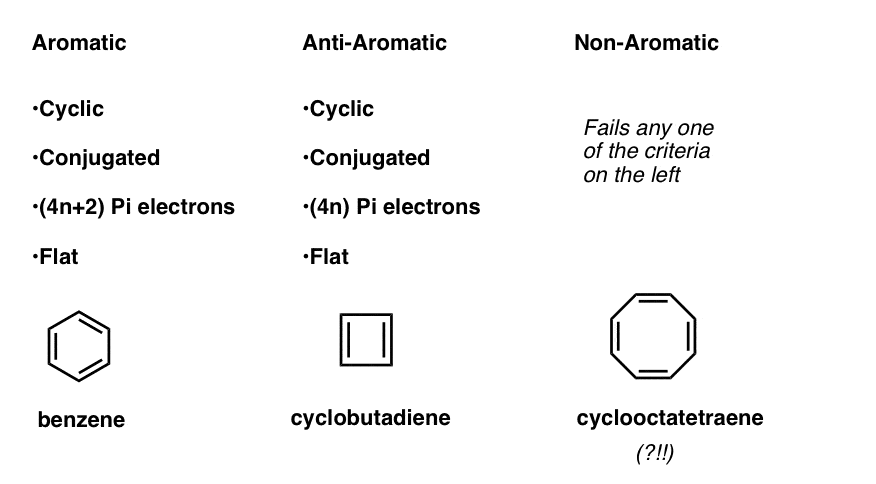
- Aromatische Moleküle sind cyclisch, konjugiert, haben (4n+2) pi-Elektronen und sind flach.
- Antiaromatische Moleküle sind zyklisch, konjugiert, haben (4n) pi-Elektronen und sind flach.
- Nichtaromatische Moleküle sind alle anderen Moleküle, die eine dieser Bedingungen nicht erfüllen.
Warten Sie eine Sekunde – Sie fragen sich vielleicht, warum Cyclooctatetraen als „nicht aromatisch“ eingestuft wird. Mit 8 pi-Elektronen (zweimal eine gerade Zahl) sollte es nicht „antiaromatisch“ sein?
Cyclooctatetraen „Entkommt“ der Antiaromatik Durch Verdrehen aus der Ebenheit
Stellen Sie sich vor, die Bedingungen für die „Antiaromatik“ zu erfüllen, als würden Sie sich für eine extrem strafende Einkommensteuer qualifizieren. Angesichts der Möglichkeit, eine Lücke zu finden, um aus der Steuer herauszukommen, würden Sie es tun? Wahrscheinlich.
Cyclooctatetraen ist nur dann antiaromatisch, wenn es flach ist. Die relativ „Floppy“ -Struktur von Cyclooctatetraen ermöglicht jedoch eine gewisse Flexibilität. Die Bindungen können sich von der Ebenheit wegdrehen, so dass das Molekül eine „wannenartige“ Form annimmt, wodurch die „Antiaromatizitätssteuer“ von 18 12 kcal / mol vermieden wird, die gezahlt würde, wenn alle p-Orbitale auf dem Molekül miteinander konjugiert wären.
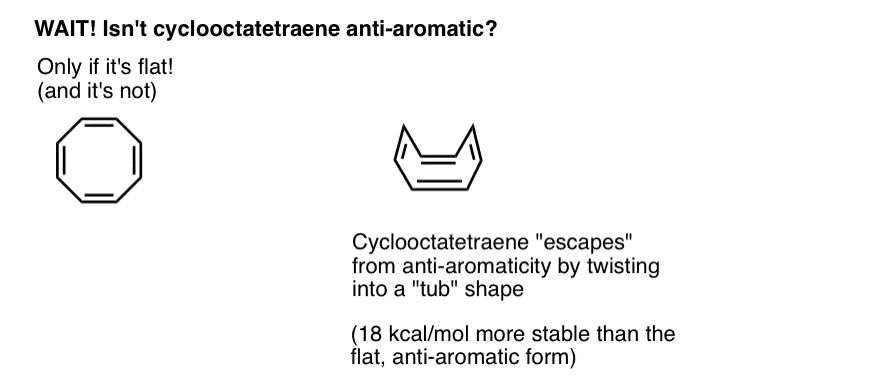
Es stellt sich heraus, dass cyclooctatetraen synthetisiert wurde, stabil ist (Sie können es zum Beispiel hier kaufen) und sich wie ein „normales“ Alken verhält, Additionsreaktionen, Hydrierung usw. durchläuft.
Pentalen (oben), das ebenfalls 8 pi-Elektronen hat, hat eine sehr starre bicyclische Struktur, die eine Bindungsrotation weg von der Ebenheit verhindert. Daher bleibt es in seiner antiaromatischen Konformation stecken.
Antiaromatizität für Moleküle mit mehr als 8 pi-Elektronen ist bekannt, aber sehr ungewöhnlich. (Hier ist ein lustiges Beispiel für eine weitere „Flucht“ aus der Aromatizität für ein Molekül mit 18 pi-Elektronen.)
Schlussfolgerung: Antiaromatische Verbindungen
Bisher war unsere Behandlung von Aromatizität und Antiaroma rein deskriptiv und empirisch. Wir haben viele Beispiele gezeigt und viele Regeln gegeben, aber in der Diskussion fehlte jede tiefe Erklärung des „Warum“.
Was ist das Besondere an dem Benzolring, der ihn so stabil macht? Warum ist es stabil?
Was ist das Besondere an dem Cyclobutadien-System, das es so instabil macht. Warum ist es instabil?
Um diese tieferen Fragen zu beantworten, müssen wir einen Schritt zurücktreten und die molekularen Orbitale dieser beiden Moleküle untersuchen und dann zu einem tieferen Verständnis von Aromatizität und Anti-Aromatizität kommen.
Das werden wir in unserem nächsten Beitrag tun.
Vielen Dank an Matthew Knowe für die Hilfe bei der Vorbereitung dieses Beitrags.
Anmerkungen
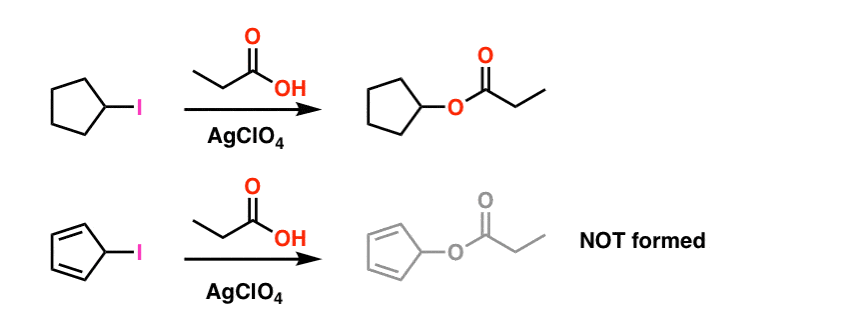
Fußnote 1. Der Einfachheit halber fudges das Bild im Hauptartikel auf den tatsächlichen Reaktionsbedingungen gezeigt. Die tatsächlichen experimentellen Bedingungen sind unten gezeigt. Das Lösungsmittel ist Propionsäure, und das Lewis-Säure-Silberperchlorat wird zugegeben, um das Abziehen des Jods zu unterstützen. .
Selbst unter diesen Bedingungen wird das Cyclopentadienylcarbokat nicht gebildet, was seine extreme Instabilität belegt.
Fußnote 2. Die Epoxidierung von Ethen (auch bekannt als Ethylen) erfolgt jährlich in Höhe von 15 Millionen Tonnen. Die Epoxidierung von Acetylen zu Oxiren ist unbekannt.
Flüchtige Beweise für die Existenz von Oxirenen gefunden. Es gibt gute Beweise aus Isotopenmarkierungsstudien, dass Oxirene flüchtige Zwischenprodukte in bestimmten Wolff-Umlagerungen sind. Es gibt auch zwei Beispiele für Oxirene, die bei extrem niedriger Temperatur eingefangen, aber oberhalb von 35 Kelvin zersetzt wurden.
Die flüchtige Existenz eines 1H-Azirins wurde bei der Addition eines Nitrens an ein Acetylen postuliert, das sich schnell zu einem (stabilen) 2H-Azirin (unten) umlagert.
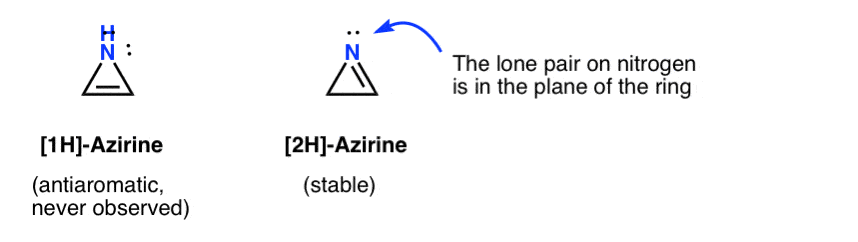
Beachten Sie, dass in 2H-Aziren das einsame Paar auf dem Stickstoff im rechten Winkel zum pi-System steht, so dass dieses System im Gegensatz zu antiaromatisch nicht aromatisch ist.
Weitere Informationen finden Sie unter Advanced Organic Chemistry vom März. Ich habe die 5. Auflage, Seiten 62-63, bearbeitet.
. Fußnote 3. Ein sehr cleveres Experiment ergab, dass 1,2-Dideutero-Cyclobutadien zwei Isomere hat, nicht eines (siehe unten). Dies deutet darauf hin, dass die Doppelbindungen in Cyclobutadien nicht wie in Benzol delokalisiert sind, sondern eher wie Doppelbindungen in einem herkömmlichen Dien.
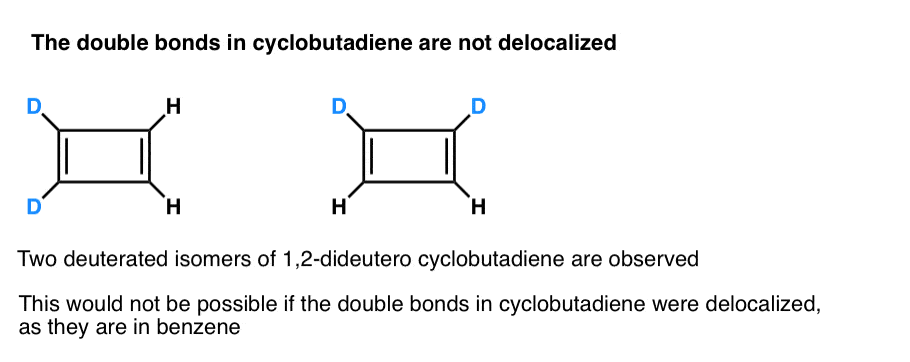
Cyclobutadien reagiert mit sich selbst bei 35 K zu einem „Dimer“, in einem Beispiel einer Diels-Alder-Reaktion.
Fußnote 4. Ja, es ist wahr, dass das einsame Paar in Azirene in ein SP3-Hybridorbital (unten) gebracht werden kann. Dies reduziert wahrscheinlich die antiaromatische „Strafe“ etwas, aber das Molekül ist immer noch unglaublich instabil. Anti-Aromatizität ist der einfachste Weg, dies zu erklären.

Fußnote 5. Die rechteckige Geometrie ist auf einen Effekt zurückzuführen, der als Jahn-Teller-Effekt bekannt ist. Erinnern Sie sich an das Pauli-Ausschlussprinzip, bei dem Elektronen nicht die gleiche Quantenzahl haben können? Nun, wie wir sehen werden, wenn wir uns das Molekülorbitaldiagramm von Cyclobutadien ansehen, hat „quadratisches“ Cyclobutadien zwei „entartete“ Elektronen, d. H. Sie haben die gleichen Energien und Quantenzahlen. Dies führt zu einem Phänomen, das als „Pauli-Abstoßung“ bekannt ist, bei dem die Bindungen verlängert werden, bis die Energieniveaus der beiden Elektronen differenziert sind. Definitiv ein fortgeschrittenes Thema.
(Fortgeschrittene) Referenzen und weiterführende Literatur
- Übergangszustandsspektroskopie von Cyclooctatetraen
Paul G. Wenthold, David A. Hrovat, Weston T. Borden, W. C. Lineberger.
Wissenschaft, 1996, 272, 1456-1459.
DOI: 10.1126/Wissenschaft.272.5267.1456
Diese Studie ist die Grundlage für die Aussage, dass der nichtaromatische Grundzustand von Cyclooctatetraen 12 kcal/mol unterhalb der „antiaromatischen“ Konformation liegt. - Die Zähmung von Cyclobutadien
Donald J. Cram, Martin E. Tanner, Robert Thomas
Chem. Int. Ed. 1991, 30 (8), 1024-1027
DOI: 10.1002/anie.199110241
Diese Arbeit von Nobelpreisträger Prof. Donald J. Cram (UCLA) beschreibt die erste spektroskopische Charakterisierung von Cyclobutadien. Dies wird erreicht, indem der Vorläufer in einen Hemikarzerand (Käfigkomplex) eingeschlossen und dann mit UV-Licht bestrahlt wird, wodurch Cyclobutadien entsteht, das nichts tun kann, da es gefangen ist. - Cyclobutadien
Thomas Bally, Satoru Masamune
Tetrahedron 1980, 36 (3), 343-370
DOI: 1016/0040-4020(80)87003-7
Dieser Artikel aus dem Jahr 1980 gibt einen Überblick über die Arbeit an Cyclobutadien bis zu diesem Zeitpunkt. Dies ist in 2 Teile unterteilt – experimentelle synthetische Bemühungen und theoretische Berechnungen. - Tetraeder und Cyclobutadien
Günther Maier
Chem. Int. Ed. 1988, 27 (3), 309-332
DOI: 10.1002/anie.198803093
In diesem Artikel werden synthetische Bemühungen in Richtung Tetraeder und Cyclobutadien untersucht – beide Moleküle haben die Formel C4H4. Bisher konnten nur substituierte (Tetra-t-butyl- und Tetra-trimethylsilyl) Tetraeder erfolgreich synthetisiert und isoliert werden. - Cyclobutadien- und Benzocyclobutadien-Eisentricarbonylkomplexe
F. Emerson, L. Watts und R. Pettit
Journal der American Chemical Society 1965, 87 (1), 131-133
DOI: 10.1021/ja01079a032 - Cyclobutadieneirontricarbonyl. Ein neues aromatisches System
D. Fitzpatrick, L. Watts, G. F. Emerson und R. Pettit
Journal of the American Chemical Society 1965, 87 (14), 3254-3255
DOI: 10.1021/ja01092a050
Ein Bonusthema: Cyclobutadien kann mit Metallen stabilisiert werden – der metallorganische Komplex Cyclobutadien-Eisentricarbonyl ist ein stabiler, kristalliner Feststoff. Wie die Autoren erwähnen, ist es unwahrscheinlich, dass freies Cyclobutadien bei der Synthese erzeugt wird. - https://www.asu.edu/courses/chm233/notes/aromatic/aromaticRL1/antiaromatic.html
Das Antipsychotikum Olanzapin nimmt eine „Schmetterlingsform“ an, um antiaromatische Wirkungen zu vermeiden, ähnlich wie Cyclooctatetraen. Dies ist offenbar entscheidend für seine Funktion. - Antiaromaticity
Ronald Breslow
Accounts of Chemical Research 1973, 6 (12), 393-398
DOI: 1021 / ar50072a001
Interessanterweise gibt Prof. Breslow (Columbia) in diesem Bericht an, dass er der erste war, der den Begriff „antiaromatisch“ für besonders destabilisierte cyclische Verbindungen mit 4n p-Elektronen vorschlug. Er zitiert auch andere Arbeiten von Prof. M. J. S. Dewar und anderen, wo die antiaromatische Destabilisierung von Cyclobutadien berechnet wird, um zwischen 18-33 kcal / mol relativ zu linearem Butadien zu sein. - Experimentelle Bestimmung der Antiaromatizität von Cyclobutadien
Ashok A. Deniz, Kevin S. Peters, Gary J. Snyder
Science 1999, 286 (5442), 1119-1122
DOI: 1126/science.286.5442.1119
Dies ist eine sehr rigorose Arbeit, die neuartige spektroskopische Techniken verwendet, um die antiaromatische Destabilisierung von Cyclobutadien zu bestimmen. Bezogen auf eine hypothetische stammlose, konjugierte Dienreferenz wird Cyclobutadien um insgesamt 87 kcal/mol destabilisiert, wovon 32 kcal/mol auf Ringstamm und 55 kcal/mol auf Antiaromatizität zurückzuführen sind (gegenüber 21 kcal/mol für die aromatische Stabilisierung von Benzol). - Unsubstituiertes Cyclopentadienylkation, ein Grundzustand-Triplett
Saunders, R. Berger, A. Jaffe, J. M. McBride, J. O’Neill, R. Breslow, J. M. Hoffmann, C. Perchonock, E. Wasserman, R. S. Hutton, V. J. Kuck
Journal der American Chemical Society 1973, 95 (9), 3017-3018
DOI : 10.1021/ja00790a049
Das Cyclopentadienylkation kann nur schwer hergestellt werden, wie dieses Papier beschreibt. Sobald es gebildet ist, hat es einen Triplett-elektronischen Grundzustand (mit 2 ungepaarten Elektronen) und kann durch EPR-Spektroskopie (Electron Paramagnetic Resonance) charakterisiert werden. - Oxirene
Errol G. Lewars
Chemische Bewertungen 1983, 83 (5), 519-534
DOI: 10.1021/cr00057a002