Ein 49-jähriger Mann mit einer Vorgeschichte von Alkoholmissbrauch präsentiert der ED in den letzten 36 Stunden Beschwerden über generalisierte Bauchschmerzen und Erbrechen. Der Patient ist der Abteilung für alkoholbedingte Besuche bekannt und trinkt weiterhin täglich. Bei der Ankunft ist er tachykardisch und tachypnotisch, und die Ergebnisse der körperlichen Untersuchung umfassen trockene Schleimhäute, verminderten Sakin-Turgor, epigastrische Empfindlichkeit und ein Zittern in beiden Händen. Laborstudien zeigen ein Serumbicarbonat von 10 mEq / l, eine Anionenlücke von 30, eine Serumglukose von 95 mg / dl, eine Laktatazidose mit pH 7,2, Hypophosphatämie und Spuren von Ketonurie. Abdominal-CT-Scan ist normal. Er bestreitet eine Vorgeschichte von Diabetes mellitus, Einnahme von toxischen Alkoholen oder kürzlich aufgetretenen Krankheiten.Dieser Patient könnte möglicherweise eine von vielen Diagnosen haben, aber seine Präsentation und Laborbefunde stimmen am besten mit der alkoholischen Ketoazidose (AKA) überein. AKA kann eine häufige ED-Diagnose sein und tritt typischerweise bei chronischen Alkoholtrinkern auf, die eine abrupte Beendigung ihres Alkoholkonsums in Verbindung mit einer verminderten glykämischen Aufnahme und einem intravaskulären Volumenmangel haben.1
In den meisten Fällen führt ein auslösendes Ereignis wie Pankreatitis, Gastritis oder eine Aspirationspneumonie zu einem abrupten Rückgang der oralen Aufnahme. Etwa 24 bis 72 Stunden nach Beendigung der PO-Aufnahme kann sich AKA entwickeln.2 Diese Patienten haben normalerweise eine niedrige oder fehlende Serumalkoholkonzentration und können einen unterschiedlich starken Alkoholentzug aufweisen. Ein klares Sensorium ist jedoch ein Kennzeichen dieses Zustands. Das Vorhandensein einer Bewusstseinsveränderung deutet stark darauf hin, dass ein anderer Prozess vorhanden ist.3
Obwohl die zugrunde liegende Pathophysiologie komplex ist, hilft ein richtiges Verständnis bei der Diagnose und Behandlung dieser Erkrankung.
Es gibt drei allgemeine Konzepte, die AKA antreiben:
- Die Einnahme von Alkohol, zusammen mit einer verringerten Kalorienaufnahme und Dehydration, begünstigt einen ketotischen Zustand.
Ketoazidose wird durch eine Kombination von Faktoren verursacht, darunter hungerinduzierte Hypoinsulinämie, Oxidation von Alkohol zu seinen verschiedenen Ketonmetaboliten, Lipolyse mit Freisetzung freier Fettsäuren (FFA) und intravaskuläre Volumenkontraktion. Der relative Hungerzustand bei AKA führt zu einer übermäßigen Glucagonsekretion und einer Verringerung der peripheren Insulinkonzentrationen, was eine Schlüsselrolle bei der Entwicklung einer Ketoazidose spielt. Metabolismus von Fetten durch Lipolyse produziert Beta-Hydroxybutyrat (BHB) und Acytyl-Acetat (ACA). Diese Ketone werden für die Zellatmung verwendet, um Energie durch Adenosintriphosphat (ATP) -Produktion bereitzustellen, tragen jedoch zur Anionenlückenazidose bei, die bei AKA beobachtet wird.
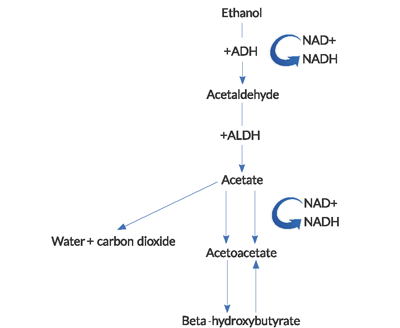
- Während des Metabolismus von Ethanol werden hohe Mengen an NADH (der reduzierten Form von Nicotinamid-Adenindinukleotid ) erzeugt.4
NAD + ist ein Coenzym, das verwendet wird, um Elektronen in intrazellulären Redoxreaktionen zu tragen. Die Reduktion von NAD + und die daraus resultierende Akkumulation und das Ungleichgewicht von NADH im Ethanolstoffwechsel haben mehrere wichtige Konsequenzen. In diesem hohen Verhältnis von NADH zu NAD + überwiegt die BHB-Erzeugung gegenüber der Produktion von ACA. Dieses abnormale Verhältnis führt zu einer Hemmung des Zitronensäurezyklus und der hepatischen Glukoneogenese, was teilweise erklärt, warum Hyperglykämie bei diesen Patienten selten ist.Fast kontraintuitiv ist es nicht möglich, normale NAD + – und ACA-Spiegel in AKA zu regenerieren. Die Reoxidation von NADH zu NAD + scheint durch eine Kombination von Faktoren, einschließlich Hypophosphatämie und einer funktionellen Blockade innerhalb der Mitochondrien, begrenzt zu sein.2Die bei AKA beobachtete Laktatazidose ist auf einen abnormalen Redoxzustand zurückzuführen. Pyruvat ist ein Substrat, das in zahlreichen Energieerzeugungswegen verwendet wird, aber bei alkoholischer Ketoazidose wird es von seinen normalen Stoffwechselwegen auf andere verlagert, die die Laktatproduktion erhöhen. Außerdem ist die Regeneration von Pyruvat aus Milchsäure beeinträchtigt.
- Ein erhöhter adrenerger Zustand und Volumenmangel verschlimmern die Ketose und hemmen die Glukoneogenese, wodurch ein Zustand entsteht, der die Bildung und Aufrechterhaltung eines ketotischen Milieus begünstigt.
Der Körper reagiert auf Hunger, Dehydration und Hypoglykämie mit der Freisetzung von gegenregulatorischen Hormonen. Diese Hormone erhöhen den sympathischen Tonus, verringern die Insulinfreisetzung und erhöhen die Ketonkonzentration durch die Freisetzung von FFAs und verringern den peripheren Ketonstoffwechsel. Alle diese Änderungen verewigen den ketotischen Zustand, bis Glukose wieder in das System eingeführt wird. Signifikante Dehydration aufgrund von Erbrechen und verminderter oraler Aufnahme führen zu einer beeinträchtigten renalen Keton-Clearance, was die Situation weiter verschärft.2Die Differentialdiagnose für AKA sollte Hungerketose und diabetische Ketoazidose (DKA) umfassen. Obwohl eine gründliche Anamnese helfen kann, das Differential einzugrenzen, ist ein metabolisches Panel unerlässlich, um die Diagnose zu bestätigen. Anionenlücken von 30 mEq / l oder mehr können in AKA gesehen werden, obwohl die Lücke durch eine begleitende primäre metabolische Alkalose aufgrund von Erbrechen verdeckt werden kann. Tatsächlich gibt es Fallberichte von Patienten mit AKA, die aufgrund von übermäßigem Erbrechen einen alkalischen Serum-pH-Wert haben.Die Anionenlücke bei der Hungerketose ist typischerweise viel niedriger, wobei der Bicarbonatspiegel selten unter 18 mEq / l und der Serum-pH-Wert typischerweise über 7,30 liegt.2 In DKA hingegen kann die Anionenlücke recht groß sein, wobei die Bikarbonatwerte häufig einstellig werden. Hyperglykämie mit Glykosurie, typischerweise bei diabetischer Ketoazidose (DKA), ist bei AKA selten.4 Chronische Unterernährung führt zu niedrigen Glykogenreserven, und der erhöhte adrenerge Tonus führt zur Hemmung der hepatischen Glukoneogenese. Ketonurie, die bei allen drei Erkrankungen auftritt, kann den Schweregrad der AKA beeinträchtigen.Ketonurie wird durch den Nitroprussid-Test gemessen, bei dem eine Farbänderung die relative Konzentration von Aceton und ACA im Urin anzeigt. Das Vorhandensein von BHB, dem prominentesten in AKA vorhandenen Keton, wird im Nitroprussid-Test nicht widergespiegelt. Dies erklärt, warum Patienten mit AKA bei der Erstpräsentation keine oder nur eine leichte Ketonurie zeigen können, mit einem paradoxen Anstieg, wenn der Zustand umgekehrt wird. Wenn sich das ACA: BHB-Verhältnis normalisiert, werden sowohl das nachweisbare ACA als auch das BHB im Urin ausgeschieden.
Differentialdiagnose
Andere lebensbedrohliche Zustände, die eine signifikante Anionenlückenazidose verursachen können, sollten ebenfalls bei der Differentialdiagnose berücksichtigt werden. Die toxischen Alkohole, insbesondere Methanol und Ethylenglykol, können absichtlich oder versehentlich in diese Patientenpopulation aufgenommen werden. Diese Einnahme kann zu erheblicher Morbidität und Mortalität führen, wenn sie nicht angemessen behandelt wird.5 Ein veränderter mentaler Status ist ein häufiges Merkmal der Einnahme von toxischem Alkohol, wird jedoch normalerweise nicht bei Erwachsenen beobachtet.5
Patienten haben typischerweise eine anfängliche osmolare Lücke, die in eine erhöhte Anionenlücke übergeht, wenn der toxische Alkohol metabolisiert wird. Erhöhte Serum-BHB-Konzentration kann in AKA ziemlich erhöht sein, aber dies schließt nicht unbedingt die Möglichkeit einer toxischen Alkoholaufnahme aus; Das Fehlen einer Osmolar- oder Anionenlücke schließt die Diagnose auch nicht aus. Während Patienten in AKA eine leichte Laktatazidose haben, sollte das Vorhandensein eines signifikant erhöhten Laktatspiegels die Suche nach einer Grunderkrankung veranlassen. In seltenen Fällen kann eine Kombination von AKA und einem dieser anderen Ereignisse auftreten und ein diagnostisches Rätsel darstellen. Eine sorgfältige Berücksichtigung des Zeitpunkts, der Art und der Menge der Einnahme sowie der damit verbundenen Symptome in Kombination mit Beobachtungs- und Laborstudien muss verwendet werden, um diese Differenzierung vorzunehmen, wenn eine klare und genaue Anamnese fehlt.
Behandlung
Die Umkehrung der Ketose und eine kräftige Rehydratation sind von zentraler Bedeutung bei der Behandlung von AKA. Zusätzlich zum isotonischen Flüssigkeitsersatz werden dextrosehaltige intravenöse Flüssigkeiten benötigt. Typischerweise liefert 5% ige Dextrose mit halbnormaler Kochsalzlösung mit einer Geschwindigkeit von 150 ml pro Stunde ausreichend Glukose, um die Bauchspeicheldrüse zur Sekretion von Insulin anzuregen, wodurch periphere Gewebe Ketone metabolisieren und die FFA-Freisetzung hemmen können.2 Es ermöglicht dem Körper auch, NAD + zu regenerieren, das durch die durch AKA verursachten Stoffwechselveränderungen gehemmt wird. Intravenöse dextrosehaltige Flüssigkeitsinfusionen sollten abgebrochen werden, sobald der Bicarbonatspiegel 18-20 mEq / l erreicht hat und der Patient die orale Einnahme verträgt. Dies tritt typischerweise 8 bis 16 Stunden nach Beginn der Behandlung auf.2 Der Alkoholentzug bei diesen Patienten sollte aggressiv mit intravenösen Benzodiazepinen behandelt werden. Thiamin, Folsäure und andere Elektrolyte, insbesondere Phosphat und Kalium, müssen bei diesen Patienten möglicherweise ergänzt werden.6 Interessanterweise ist die Mehrheit der Morbidität, die bei AKA beobachtet wird, auf den zugrunde liegenden Prozess zurückzuführen, der die Beendigung des Alkohols verursacht hat.
Fallabschluss
Der Patient erhielt 4 Liter normale Kochsalzlösung und wurde vor der Aufnahme mit D5-1/2 NS begonnen. Er erhielt IV Valium für Alkoholentzug gegeben, und Thiamin, Folsäure, und Phosphat wurden wieder aufgefüllt. Er wurde drei Tage lang wegen DROGEN- und Alkoholentzugs ins Krankenhaus eingeliefert und dann entlassen, sobald er die orale Einnahme toleriert hatte und in gutem Zustand war. Er wurde drei Wochen später in der Notaufnahme für eine ähnliche Präsentation gesehen.
Tabelle 1. Characteristics of Common Ketoacidoses
| Diabetic Ketoacidosis | Alcoholic Ketoacidosis | Starvation Ketoacidosis | |
| Bicarbonate | Can reach single digits | Can reach single digits | > 18 |
| Glucose | Elevated | Low to mildly elevated | Low to normal |
| Measurable ketonuria | Present | Absent or present | Present |
Figure 1. Weg des Alkoholstoffwechsels
(ADH = Alkoholdehydrogenase, ALDH = Acetaldehyddehydrogenase).
- Palmer, Jerry P. Alkoholische Ketoazidose: Klinische und Laborpräsentation, Pathophysiologie und Behandlung. Kliniken in Endokrinologie und Stoffwechsel 12.2 (1983): 381-389.
- Duffens K, Marx JA. Alkoholische Ketoazidosisa Bewertung.Das Journal of Emergency Medicine 5.5 (1987): 399-406.
- Wrenn KD, Slovis CM, Günstling GE, et al. Das Syndrom der alkoholischen Ketoazidose. Das American Journal of Medicine 91.2 (1991): 119-128.
- Marx JA, Hockberger RS, Walls RM, et al., eds. Rosens™ Notfallmedizin: Konzepte und klinische Praxis. Philadelphia, PA: Mosby / Elsevier; 2013. Kapitel 185 Alkoholbedingte Krankheit von John T. Finnell.Kraut JA, Kurtz I. “Toxic Alkoholkonsum: klinische Merkmale, Diagnose und Management. Klinische Zeitschrift der American Society of Nephrology 3.1 (2008): 208-225.
- Miller PD, Heinig R, Waterhouse C. Behandlung der alkoholischen Azidose: die Rolle von Dextrose und Phosphor. Archiv für Innere Medizin 138.1 (1978): 67-72.