Periodische Trends und Lösungsmitteleffekte bei der Nukleophilie
Es gibt vorhersehbare periodische Trends bei der Nukleophilie. Wenn Sie sich horizontal über die zweite Zeile der Tabelle bewegen, entspricht der Trend der Nukleophilie dem Trend der Basizität:
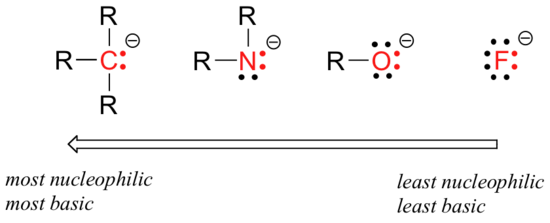
Die Argumentation hinter dem horizontalen Nukleophilie-Trend ist die gleiche wie die Argumentation hinter dem Basizitätstrend: mehr elektronegative Elemente halten ihre Elektronen fester und sind weniger in der Lage, sie zu spenden, um eine neue Bindung zu bilden.
Dieser horizontale Trend sagt uns auch, dass Amine nukleophiler sind als Alkohole, obwohl beide Gruppen sowohl bei Labor- als auch bei biochemischen Reaktionen üblicherweise als Nukleophile wirken.
Denken Sie daran, dass die Basizität der Atome abnimmt, wenn wir uns vertikal in einer Spalte des Periodensystems bewegen: Thiolationen sind beispielsweise weniger basisch als Alkoholationen und Bromidionen sind weniger basisch als Chloridionen, die wiederum weniger basisch als Fluoridionen sind. Denken Sie auch daran, dass dieser Trend durch die zunehmende Größe der Elektronenwolke um die größeren Ionen erklärt werden kann: Die der negativen Ladung innewohnende Elektronendichte verteilt sich auf eine größere Fläche, was die Stabilität erhöht (und somit die Basizität verringert).
Der vertikale periodische Trend für die Nukleophilie ist etwas komplizierter als der für die Basizität: abhängig von dem Lösungsmittel, in dem die Reaktion stattfindet, kann der Nucleophilizitätstrend in beide Richtungen gehen. Nehmen wir das einfache Beispiel der SN2-Reaktion unten:
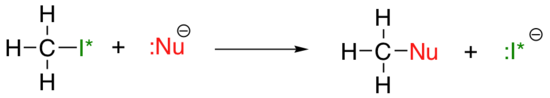
. . .wobei Nu- eines der Halogenidionen ist: Fluorid, Chlorid, Bromid oder Iodid, und die Abgangsgruppe I* ein radioaktives Isotop von Iod ist (was es uns ermöglicht, die Abgangsgruppe von dem Nukleophil zu unterscheiden, wenn beide Iodid sind). Wenn diese Reaktion in einem protischen Lösungsmittel (d. H. Einem Lösungsmittel, in dem Wasserstoff an Sauerstoff oder Stickstoff gebunden ist – Wasser, Methanol und Ethanol sind die wichtigsten Beispiele) stattfindet, verläuft die Reaktion am schnellsten, wenn Iodid das Nukleophil ist, und am langsamsten, wenn Fluorid das Nukleophil ist, was die relative Stärke des Nukleophils widerspiegelt.

Relative Nukleophilie in einem protischen Lösungsmittel
Dies ist natürlich entgegengesetzt zu dem vertikalen periodischen Trend für die Basizität, wobei Iodid am wenigsten basisch ist. Was ist hier los? Sollte nicht die stärkere Base mit ihren reaktiveren ungebundenen Valenzelektronen auch das stärkere Nukleophil sein?
Wie oben erwähnt, hat alles mit dem Lösungsmittel zu tun. Denken Sie daran, wir sprechen jetzt über die Reaktion in einem protischen Lösungsmittel wie Ethanol. Protische Lösungsmittelmoleküle bilden sehr starke Ionen-Dipol-Wechselwirkungen mit dem negativ geladenen Nukleophil, wodurch im Wesentlichen ein „Lösungsmittelkäfig“ um das Nukleophil entsteht:

Damit das Nukleophil das Elektrophil angreifen kann, muss es sich zumindest teilweise aus seinem Lösungsmittelkäfig befreien. Die einsamen Paarelektronen auf dem größeren, weniger basischen Iodidion interagieren weniger eng mit den Protonen auf den protischen Lösungsmittelmolekülen – so kann sich das Iodidnukleophil besser von seinem Lösungsmittelkäfig lösen als das kleinere, basischere Fluoridion, dessen einsame Paarelektronen enger an die Protonen des Käfigs gebunden sind.
Das Bild ändert sich, wenn wir zu einem polaren aprotischen Lösungsmittel wie Aceton wechseln, in dem es einen molekularen Dipol gibt, aber keine an Sauerstoff oder Stickstoff gebundenen Wasserstoffatome. Jetzt ist Fluorid das beste Nukleophil und Iodid das schwächste.
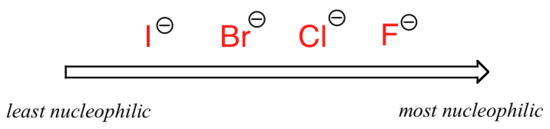
Relative Nukleophilie in einem polaren aprotischen Lösungsmittel
Der Grund für die Umkehrung ist, dass bei einem aprotischen Lösungsmittel die Ionen-Dipol-Wechselwirkungen zwischen Lösungsmittel und Nukleophil viel schwächer: Das positive Ende des Dipols des Lösungsmittels ist im Inneren des Moleküls verborgen und somit vor der negativen Ladung des Nukleophils geschützt.

Eine schwächere Lösungsmittel-Nukleophil-Wechselwirkung bedeutet einen schwächeren Lösungsmittelkäfig für den Durchbruch des Nukleophils, so dass der Lösungsmitteleffekt viel weniger wichtig ist und das basischere Fluoridion auch das bessere Nukleophil ist.
Warum nicht ein völlig unpolares Lösungsmittel wie Hexan für diese Reaktion verwenden, damit der Lösungsmittelkäfig vollständig eliminiert wird? Die Antwort darauf ist einfach – das Nukleophil muss in Lösung sein, um mit einer nennenswerten Geschwindigkeit mit dem Elektrophilen zu reagieren, und ein Lösungsmittel wie Hexan löst ein geladenes (oder hochpolares) Nukleophil überhaupt nicht auf. Deshalb verwenden Chemiker polare aprotische Lösungsmittel für nukleophile Substitutionsreaktionen im Labor: Sie sind polar genug, um das Nukleophil zu lösen, aber nicht so polar, dass sie es in einem undurchdringlichen Lösungsmittelkäfig einschließen. Neben Aceton sind drei weitere häufig verwendete polare aprotische Lösungsmittel Acetonitril, Dimethylformamid (DMF) und Dimethylsulfoxid (DMSO).

In der biologischen Chemie, wo das Lösungsmittel protisch ist (Wasser), ist die wichtigste Implikation der periodischen Trends in der Nukleophilie, dass Thiole stärkere Nukleophile als Alkohole sind. Die Thiolgruppe in einer Cystein-Aminosäure ist beispielsweise ein starkes Nukleophil und wirkt häufig als Nukleophil in enzymatischen Reaktionen, und natürlich sind negativ geladene Thiolate (RS-) noch nukleophiler. Dies bedeutet nicht, dass die Hydroxylgruppen an Serin, Threonin und Tyrosin nicht auch als Nukleophile wirken – sie tun es.