Ziele
- Bekannte und unbekannte Lösungen der Metallionen \(\ce{Ag^{+}}\), \(\ ce {Fe^{3+}}\), \(\ ce {Co^{2+}}\), \(\ ce{Cu^{2+}}\) und \(\ce{Hg^{2+}}\) werden mittels Papierchromatographie analysiert.
- Eine unbekannte Lösung, die einige dieser Kationen enthält, wird durch Vergleich mit den Rf-Werten und Farben der gefärbten Flecken bekannter Lösungen identifiziert.
Die meisten Chemiker und viele andere Wissenschaftler müssen Gemische routinemäßig trennen und ihre Bestandteile identifizieren. Die Fähigkeit, die in einer Probe gefundenen Substanzen qualitativ zu identifizieren, kann kritisch sein. Zum Beispiel wird ein Umweltchemiker, der Proben von verschmutztem Grundwasser untersucht, wissen wollen, welche toxischen Ionen in einer Probe vorhanden sein könnten.
Chromatographie ist eines der ersten Werkzeuge, die in solchen Situationen verwendet werden. Bei dieser Technik können viele Arten von Mischungen in die Komponente reine Substanzen getrennt werden; durch Vergleich mit einer Standardprobe kann jede Komponentensubstanz auch vorläufig identifiziert werden.
Es gibt viele Arten der Chromatographie, von denen jede darauf ausgelegt ist, bestimmte Arten von Mischungen zu trennen. Das gemeinsame Merkmal jeder Art von Chromatographie ist, dass eine mobile Phase (eine Flüssigkeit oder ein Gas) durch eine stationäre Phase (einen Feststoff) gedrückt wird. Tabelle 1 listet verschiedene Varianten der Chromatographie und typische Identitäten der Phasen auf. Papierchromatographie wird in diesem Experiment verwendet.
|
Type of Chromatography |
Mobile Phase |
Stationary Phase |
|---|---|---|
|
Gas (GC) |
inert gas (helium) |
waxy liquid or silicone inside narrow tubing |
|
Liquid |
solvent/solvent Mixture (organic or aqueous) |
solid packing (silica, alumina) |
|
Paper |
solvent/solvent Mixture (organic or aqueous) |
paper |
|
Thin-Layer (TLC) |
solvent/solvent Mixture (organic or aqueous) |
silica/alumina coated glass, plastic or metal |
Das Beispiel der Säulenchromatographie (Abbildung 1) zeigt die typischen Merkmale dieser Analysetechnik. Das Diagramm zeigt einen Versuch, bei dem ein Zweikomponentengemisch einer Säulenchromatographie unterzogen wird. Die Säule ist mit einem festen Material gefüllt, das als stationäre Phase bezeichnet wird. Ein flüssiges Lösungsmittel oder eine eluierende Lösung wird in die Säule gegossen und benetzt das feste Verpackungsmaterial vollständig. Dann wird das Gemisch auf den Kopf der Naßkolonne gegeben und weiteres Elutionsmittel zugegeben. Die Schwerkraft zieht die mobile Phase durch die stationäre Phase nach unten und die Komponenten in der Mischung beginnen sich mit unterschiedlichen Geschwindigkeiten durch die Säule zu bewegen. Im Diagramm bewegt sich die Komponente A schneller als die Komponente B, so dass die Komponente B länger auf der Säule verbleibt als die Komponente A. Dies ist in der Regel auf eine unterschiedliche Löslichkeit der beiden Verbindungen im Lösungsmittel und /oder auf eine unterschiedliche Anziehungskraft auf das feste Packungsmaterial zurückzuführen. Wenn mehr Eluent am oberen Rand der Säule hinzugefügt wird, verlassen die Komponenten die Säule schließlich separat. Die Zeit, die benötigt wird, um die Säule zu verlassen, die so genannte Retentionszeit, ist für jede Komponente unter den gegebenen Bedingungen reproduzierbar — mobile und stationäre Phasenidentitäten, Temperatur und Säulenbreite. Nach dem Austritt der Komponenten aus der Kolonne kann das Lösungsmittel abgedampft und die reinen Komponenten weiter analysiert bzw. identifiziert werden.
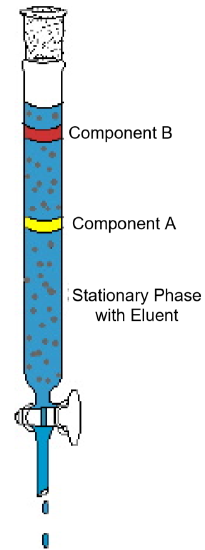
Abbildung 1: Ein typisches Säulenchromatographieexperiment demonstriert die Trennung eines Zweikomponentengemisches.
Eine vorläufige Identifizierung der Komponenten kann durch den Vergleich der unbekannten Mischung mit einer sorgfältig hergestellten bekannten Mischung erreicht werden: Wenn eine bekannte Komponente die gleiche Retentionszeit wie eine unbekannte Komponente unter den gleichen Bedingungen hat, ist es wahrscheinlich — aber nicht schlüssig — dass die beiden Komponenten gleich sind. Möglicherweise sind weitere Analysen erforderlich, um diese Hypothese zu bestätigen. Wenn das Bekannte und das Unbekannte unterschiedliche Retentionszeiten haben, ist es unwahrscheinlich, dass die beiden Komponenten identisch sind.Andere Variationen der Chromatographie verwenden Kapillarwirkung – die Anziehung einer Flüssigkeit zu einer festen Oberfläche — um ein Lösungsmittel durch festes Material zu ziehen. Eine informelle Version der Papierchromatographie kann beobachtet werden, wenn eine mit Tinte geschriebene Seite mit Wasser oder anderen Flüssigkeiten in Kontakt kommt. Die Tinte läuft und mehrere Farben werden im Tintenstreifen getrennt.
Das folgende Diagramm (Abbildung 2) zeigt das Ergebnis eines Dünnschichtchromatographieexperiments. Zwei schwarze Tintenflecken auf der festen Oberfläche wurden von einem Lösungsmittel durchströmt. Das Lösungsmittel ist Wasser oder eine andere Flüssigkeit, die durch Kapillarwirkung durch die stationäre Phase gezogen wird. In diesem Beispiel wird ein mit einem pulverförmigen Feststoff beschichtetes Stück Kunststoff als stationäre Phase verwendet. Alternativ kann ein Stück Filterpapier als stationäre Phase verwendet werden. Das Experiment zeigt, dass die schwarze Tinte eine Mischung ist, die mehrere verschiedene farbige Substanzen enthält. Wenn also die Flüssigkeit durch die stationäre Phase gezogen wird, bewegt sich jede Komponente mit einer anderen Geschwindigkeit und trennt die Tinte in Flecken unterschiedlicher Farbe.

Abbildung 2: Dünnschichtchromatographie von schwarzer Tinte nach der Entwicklung. Dieses Bild zeigt ein häufiges Problem, bei dem sich die Flecken erweitern, wenn sie sich auf der Platte nach oben bewegen und schließlich oben auf der Platte verschmelzen.In diesem Experiment werden ähnliche Prinzipien verwendet, um mehrere Metallkationen durch ein Papierchromatographieverfahren zu trennen. Die Metallionen-\(\ce{Ag^{+}}\), \(\ ce {Fe^{3+}}\),\(\ ce {Co^{2+}}\), \(\ ce {Cu ^ {2+}} \) und \(\ce{Hg ^ {2+}}\) — haben eine unterschiedliche Löslichkeit in der mobilen Phase — wässrig \ (\ce {HCl}\) mit Ethyl— und Butylalkohol – und bewegen sich mit unterschiedlichen Geschwindigkeiten das Papier hinauf. Die unterschiedlichen Metallionenlöslichkeiten sind wahrscheinlich auf die Bildung verschiedener Verbindungen mit dem Chloridion und ihre unterschiedliche Fähigkeit, sich im organischen Lösungsmittel zu lösen, zurückzuführen.
Ein Diagramm, das zeigt, wie das Papier vorbereitet wird, ist unten gezeigt. Standardlösungen, die jedes dieser Ionen enthalten, werden mit einem Kapillarrohr zusammen mit einer Standardlösung, die alle fünf Ionen enthält, auf das Papier getupft. Ein Unbekannter wird ebenfalls auf dem Papier entdeckt. Sobald das Papier vorbereitet ist, wird es durch Einlegen des Papiers in das Eluens entwickelt. Nach 75-90 Minuten wird das Papier sichtbar gemacht, indem es mit einer wässrigen Lösung benetzt wird, die Kaliumiodid, \(\ce{KI}\) und Kaliumferrocyanid, \(\ce{K4}\) enthält. Die einzigartige Farbe, die für jedes Ion beobachtet wird, wird durch eine chemische Reaktion mit der Visualisierungslösung erzeugt. Dies ist ein nützlicher Weg, um zu identifizieren, welche Ionen in einer unbekannten Mischung vorhanden sind.
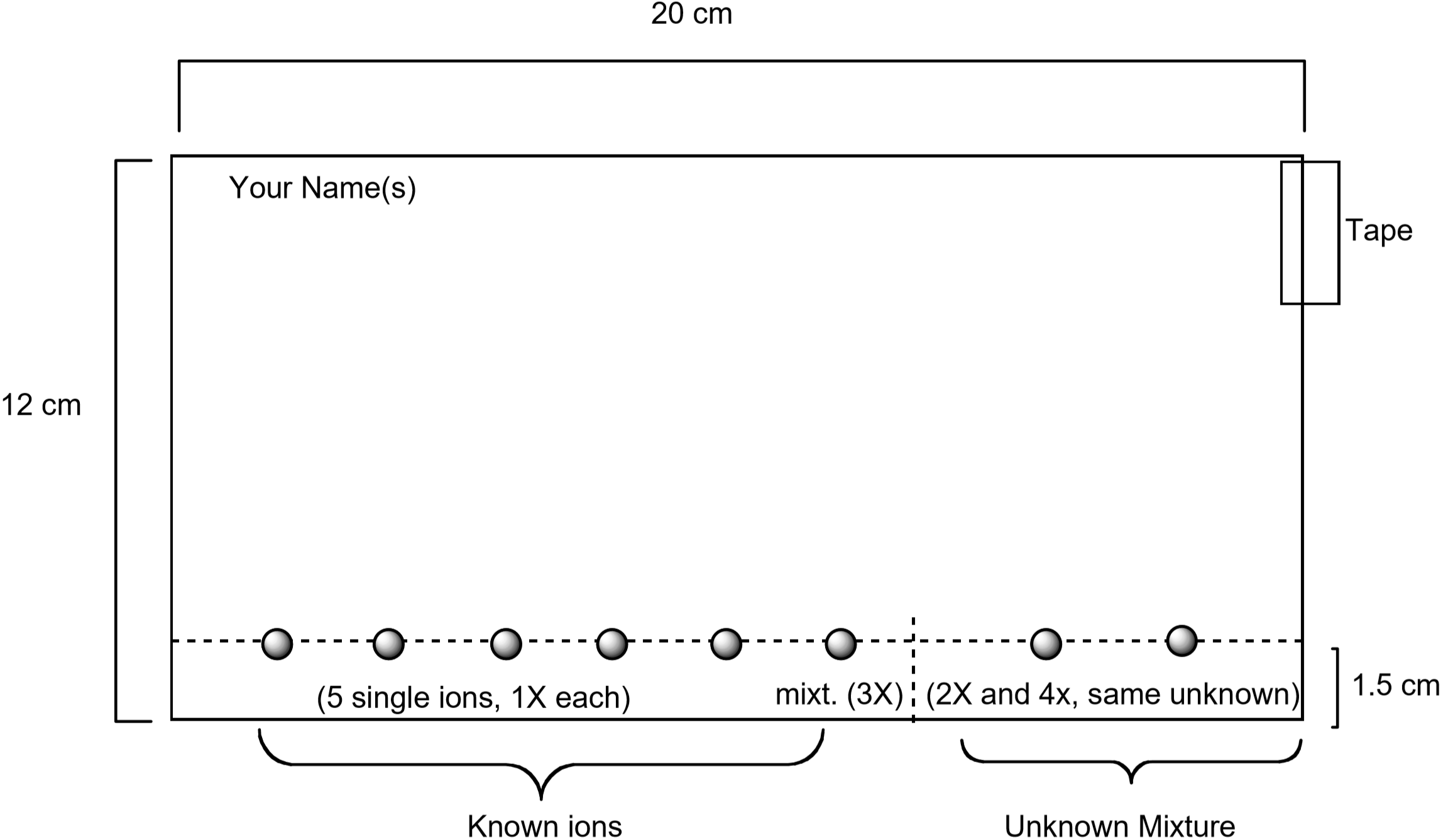
Abbildung 3: Diagramm zur Vorbereitung des Papiers für das Chromatographieexperiment
Die Entfernung, die das Ion auf dem Papier nach oben bewegt, kann auch zur Identifizierung des Ions verwendet werden. Da die Schüler ihre Chromatographieexperimente jedoch für unterschiedliche Zeiträume und unter leicht unterschiedlichen Bedingungen entwickeln, hat jeder Schüler einen etwas anderen gemessenen Abstand für ein bestimmtes Ion. Das Verhältnis der von einem Ion (\(D\)) zurückgelegten Strecke zur Entfernung des Lösungsmittels (\(F\), Lösungsmittelfront) ist charakteristisch und sollte für alle Studierenden nahezu gleich sein. Dieses Verhältnis wird Rf genannt, oder „Retentionsfaktor.“
\
Verfahren
Materialien und Ausrüstung
Chemikalien: 0.1 M wässrige Lösungen von \(\ce{AgNO3}\), \(\ce{Hg(NO3)2}\), \(\ce{Fe(NO3)3}\), \(\ce{Co(NO3)2}\) und \(\ce{Cu(NO3)2}\), jeweils mit speziellen Kapillarröhrchen; Elutionslösung (wässrige \(\ce{HCl}\) mit Ethyl- und Butylalkohol); Visualisierungslösung (wässrige Lösung von \(\ce{KI}\) und \(\ce{ ce{K4}\)).
Ausrüstung: Sauberes Stück Chromatographiepapier; Einweg-Latexhandschuhe (Nitrilhandschuhe sind im Lagerraum für Menschen mit Latexallergien erhältlich); 600 ml Becherglas; Plastikfolie; Pinzette oder Becherzange; * *
*Artikel aus dem Lager
Sicherheit
Vermeiden Sie den Kontakt mit den Metallionenlösungen, dem eluierenden Lösungsmittel und der Visualisierungslösung. Tragen Sie Einweghandschuhe, um Ihr Chromatogramm nach der Elution und für den Rest des Experiments zu berühren. Die Dämpfe des Elutionsmittels oder der Visualisierungslösung nicht einatmen. Legen Sie das Nasschromatogramm auf ein Papiertuch und nicht direkt auf den Labortisch. Verwenden Sie die Visualisierungslösung nur in dem von Ihrem Kursleiter zur Verfügung gestellten Raum. Entsorgen Sie die Handschuhe und das Chromatogramm nach Beendigung des Experiments im angegebenen Abfallbehälter. Waschen Sie Ihre Hände gründlich nach dem Kontakt mit allen Lösungen in diesem Labor.
Vorbereitung des Papiers für die Chromatographie
- Jedes Schülerpaar sollte ein Stück Filterpapier mit den in Abbildung 3 gezeigten Abmessungen erhalten. Stellen Sie sicher, dass das Papier sauber und ohne Risse oder Falten ist. Verwenden Sie einen Bleistift — keinen Stift — und ein Lineal, um eine Linie über das Papier zu zeichnen, die einen cm von der langen Kante des Papiers entfernt ist. Sie werden die Metallionenlösungen auf dieser Linie erkennen. Schreiben Sie Ihren Namen mit Bleistift in die obere linke Ecke des Papiers.
- Üben Sie, Wasser und / oder Ionenlösungen auf einem Streifen Filterpapier zu erkennen, damit Sie wissen, wie Sie Flecken der richtigen Größe erzeugen. Verwenden Sie Glaskapillarröhrchen, um die Ionen auf dem Papier zu erkennen. Die Lösung wird durch leichtes und schnelles Berühren eines Kapillarröhrchens mit der Lösung auf die Linie aufgetragen, die Sie auf das Papier gezeichnet haben. Die Flecken sollten einen Durchmesser von 5-8 mm haben. Größere Flecken breiten sich während des Experiments übermäßig aus und erschweren die Analyse.
- Bekannt 0.1 M wässrige Lösungen von \(\ce{AgNO3}\), \(\ce{Hg(NO3)2}\), \(\ce{Fe(NO3)3}\), \(\ce{Co(NO3)2}\) und \(\ce{Cu(NO3)2}\) werden in Reagenzgläsern bereitgestellt, die jeweils zwei oder drei Kapillarröhrchen enthalten. Beginnend auf der linken Seite, markieren Sie die Identität des Ions unter jeder Stelle mit einem Bleistift; dann stelle jedes bekannte Ion vorsichtig auf die Linie. Achten Sie darauf, das Kapillarröhrchen nicht mit anderen Ionen zu kontaminieren, und setzen Sie die Kapillarröhrchen wieder in das richtige Reagenzglas ein. Ein Reagenzglas, das eine bekannte Mischung aller fünf Ionen enthält, ist ebenfalls mit einem Satz Kapillarröhrchen versehen. Spot diese mischung auf die linie als gut. Da diese Lösung verdünnter ist als die bekannten Ein-Ionen-Lösungen, tragen Sie die bekannte Mischung dreimal auf und lassen Sie den Fleck zwischen jeder Anwendung trocknen. Eine Wärmelampe hilft, die Stelle schneller zu trocknen.
- Mehrere Unbekannte werden auch in Reagenzgläsern zusammen mit Kapillarröhrchen bereitgestellt. Ihr Instruktor wird Ihnen sagen, welche Übungen verwendet werden sollten. Die Unbekannten enthalten zwischen einem und vier Kationen und sind verdünnter als die bekannten Einzelionenlösungen. Die Creme muss auch zwei- bis viermal für die beiden Versuche aufgetragen werden, wobei die Stelle zwischen jeder Anwendung trocknen zu lassen ist. Im Fehlerfall sollten Sie das Unbekannte an zwei Stellen entlang der Linie erkennen, damit zwei Versuche zur Analyse zur Verfügung stehen.
Entwickeln des Chromatographiepapiers
- Legen Sie ein Stück Klebeband entlang der oberen rechten Kante, wie in Abbildung 3 gezeigt. Bilden Sie dann einen Zylinder, indem Sie die beiden kurzen Kanten des Papiers mit dem Klebeband verbinden. Stellen Sie sicher, dass sich die Kanten nicht berühren. Das Papier sollte ähnlich wie Abbildung 4 aussehen.
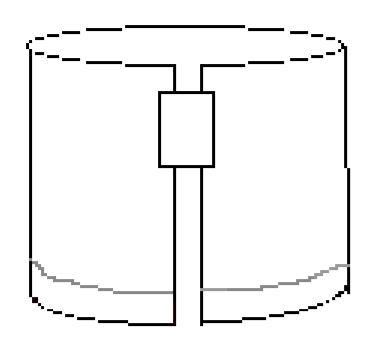
Abbildung 4: Gefaltetes Papier sollte vor der Entwicklung des Experiments so aussehen.
- 15 ml der Elutionslösung erhalten. Gießen Sie vorsichtig etwas von diesem Lösungsmittel in ein 600-ml-Becherglas und schwenken Sie es vorsichtig ein oder zwei Sekunden lang. Achtung: Atmen Sie die Dämpfe dieser Lösung nicht ein! Stellen Sie sicher, dass der Flüssigkeitsstand unter der Punktlinie auf dem Papier liegt, sobald das Papier in die Entwicklungskammer gelegt wird.
- Legen Sie den Papierzylinder mit der markierten Kante nach unten in das Becherglas. Die Flecken sollten über dem Niveau des Lösungsmittels liegen. Das Papier sollte die Seiten des Bechers nicht berühren. Decken Sie das Becherglas vorsichtig mit Plastikfolie ab und legen Sie es 75-90 Minuten lang in die Haube. Das Lösungsmittel sollte sich auf dem Papier nach oben bewegen. Sobald das Becherglas abgedeckt ist, stellen Sie sicher, dass es eben ist, und stören Sie es während der Entwicklungsphase nicht. Ihr Ausbilder hat möglicherweise eine Aufgabe, an der Sie arbeiten können, während Sie warten.
Visualisierung und Analyse des Papiers
- Tragen Sie nach Ablauf der Entwicklungszeit Einweghandschuhe und nehmen Sie das Papier aus dem Becherglas. Latexhandschuhe sind im Labor erhältlich und Nitrilhandschuhe sind im Lagerraum für Menschen mit Latexallergien erhältlich. Lassen Sie das Lösungsmittel zurück in den Becher tropfen und entfernen Sie dann das Klebeband. Legen Sie das Chromatographiepapier auf ein Papiertuch und markieren Sie sofort die Lösungsmittelfront mit einem Bleistift. Gießen Sie das verwendete Elutionsmittel in den dafür vorgesehenen Abfallbehälter. Trocknen Sie das Papier unter einer Wärmelampe in der Haube. Vorsicht: Dämpfe nicht einatmen! Achten Sie darauf, das Papier nicht unter der Lampe zu verbrennen.
- Sobald das Papier trocken ist, bringen Sie es zur Visualisierungsstation auf dem Papiertuch. Tauchen Sie das Papier kurz in die Visualisierungslösung, die sich in einer flachen Schüssel im Abzug befindet. Heben Sie das Papier sofort aus der Lösung und lassen Sie den Überschuss an der Station abtropfen. Legen Sie das nasse Papier auf ein trockenes Papiertuch und trocknen Sie es sofort unter einer Wärmelampe.
- Finde zuerst jedes bekannte Einzelion und zeichne die Farben auf, die du beobachtest. Notieren Sie die Farben daher, während das Papier noch nass ist. Messen Sie den Abstand jeder Stelle bewegt, D, mit einem Lineal. Messen Sie in der Mitte jeder Stelle. Notieren Sie Ihre Daten in der Datentabelle.
- Messen Sie den Abstand zur Lösungsmittelfront F. Der Wert von F sollte auf dem gesamten Papier ungefähr gleich sein. Verwenden Sie diese Werte, um die Rf für jedes Ion zu berechnen. Nehmen Sie Ihre Messungen wie in Abbildung 5 gezeigt vor. Jeder beobachtete Spot hat seinen eigenen Rf-Wert. Notieren Sie Ihre Ergebnisse in der Datentabelle.
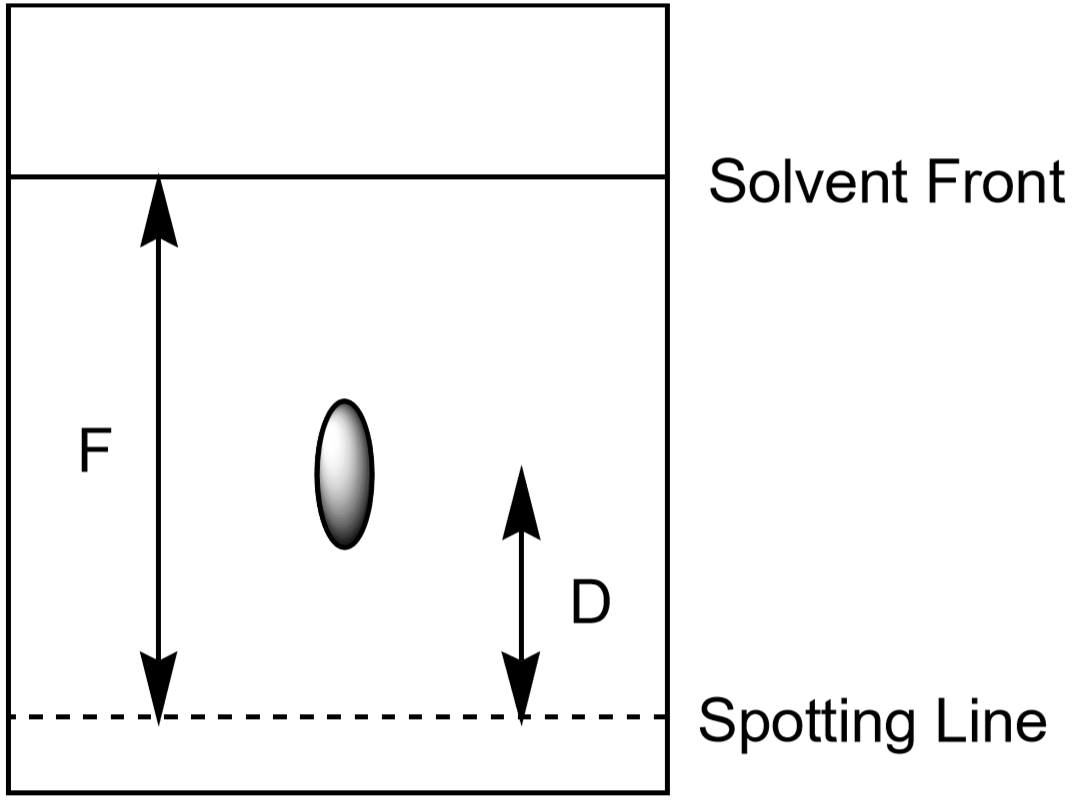
Abbildung 5: Messung von Entfernungen, die bei der Berechnung von Rf für einen Spot verwendet werden.
- Suchen Sie in der Spur, die das Gemisch enthält, jedes Ion und notieren Sie die Entfernung, die jedes Ion zurücklegt. Berechnen Sie die Rf für jedes Ion in dieser Spur. Die Werte sollten eng mit denen übereinstimmen, die in den Einzelionen-Knowns beobachtet wurden.
- Lokalisieren Sie in der Spur, die die Unbekannten enthält, die Mitte jedes beobachteten Punkts, zeichnen Sie dessen Entfernung auf und berechnen Sie die Hf-Werte. Verwenden Sie die Spur mit den klarsten Stellen. Die Farb- und Rf-Werte für die unbekannten Spots sollten eng mit einigen der bekannten Ionen übereinstimmen. Sie sollten nun in der Lage sein zu identifizieren, welche Ionen oder Ionen in Ihrem unbekannten gefunden werden. Notieren Sie Ihre Daten in der entsprechenden Tabelle.
- Zeichnen Sie eine Skizze Ihres Chromatogramms in das Feld auf Ihrem Laborberichtsformular und geben Sie dabei die Position sowie die ungefähre Größe und Form jedes Punktes auf dem Papier an. Entsorgen Sie das Papier im dafür vorgesehenen Abfallbehälter.
Reinigung
Legen Sie das Chromatographiepapier und die gebrauchten Handschuhe in den dafür vorgesehenen Abfallbehälter. Die gebrauchte Eluierlösung sollte bereits in einen anderen Abfallbehälter gegeben worden sein. Beachten Sie, dass für dieses Experiment zwei verschiedene Abfallbehälter zur Verfügung stehen, lesen Sie also unbedingt die Etiketten, damit Sie den richtigen verwenden! Waschen Sie Ihre Hände gründlich, bevor Sie das Labor verlassen.
Zuordnung vor dem Labor: Papierchromatographie
- Eine Zweikomponentenmischung wird durch Papierchromatographie analysiert. Die Komponente A ist in der mobilen Phase besser löslich als die Komponente B. Man erhält folgendes Ergebnis. Berechnen Sie die Rf für jede Komponente und beschriften Sie die Identität jedes Spots.
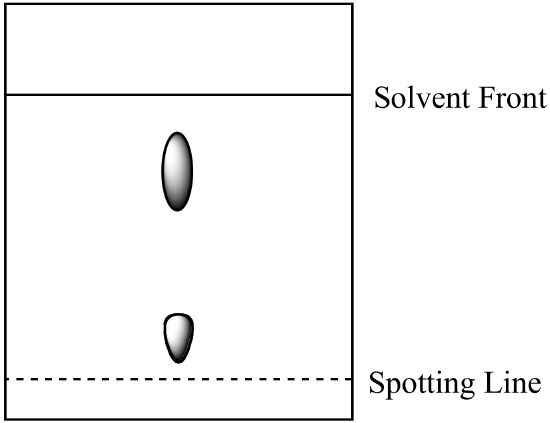
- Das Gemisch aus Frage 1 (oben) wird säulenchromatographisch unter Verwendung derselben mobilen Phase und einer stationären Kieselgelphase analysiert. Welche Komponente hat die kürzere Verweilzeit? Erklären Sie Ihre Antwort. (Angenommen, die gleiche Art von Bindungskräften zwischen den Komponenten und der stationären Phase ist sowohl in der Papierchromatographie als auch in der Säulenchromatographie vorhanden.)
- Eine unbekannte flüssige Probe wird mittels Papierchromatographie unter Verwendung von Lösungsmittel X als mobile Phase analysiert. Ein Punkt wird beobachtet, nachdem die Platte entwickelt und visualisiert wurde. Dieselbe unbekannte Substanz wird erneut mit Lösungsmittel Y als mobile Phase analysiert. Diesmal werden drei Punkte beobachtet, nachdem die Platte entwickelt und visualisiert wurde.
- Ist die unbekannte Probe ein Reinstoff oder ein Gemisch? Erklären Sie Ihre Antwort, einschließlich eines möglichen Grundes für die unterschiedlichen Beobachtungen in den beiden Experimenten.
Lab Report for Paper Chromatography
Data, Observations, Calculations and Analysis Known Ions
Known Ions
|
Ion |
Spot Color (Stained) |
D (Single- Ion) |
F (Single- Ion) |
Rf |
D (Ion Mixt.) |
F (Ion Mixt.) |
Rf |
|---|---|---|---|---|---|---|---|
|
\(\ce{Ag^{+}}\) |
|||||||
|
\(\ce{Co^{2+}}\) |
|||||||
|
\(\ce{Cu^{2+}}\) |
|||||||
|
\(\ce{Fe^{3+}}\) |
|||||||
|
\(\ce{Hg^{2+}}\) |
Unknown ID Code _________________
Unknowns
|
Spot Number (from lowest Rr) |
Spot Color (Stained) |
D (Unknown) |
F (Unknown) |
Rf |
Identity of Spot |
|---|---|---|---|---|---|
- Sketch of Chromatogram:
Summary:
| Unbekannter ID-Code | Ionen identifiziert |
|---|---|
Fragen und Schlussfolgerungen
- Welche Kriterien wurden verwendet, um das/die gefundene(n) Ion(e) in Ihrem unbekannt zu identifizieren? Erklären Sie Ihre Antwort in mindestens drei Sätzen. Schließen Sie Schwierigkeiten bei der Identifizierung von Ionen ein.
- Wenn Sie das Experiment nur 30 Minuten laufen lassen, was wäre das wahrscheinliche Ergebnis? Würden Probleme bei der Identifizierung des Unbekannten auftreten?
- Wenn \(\ce{Co^{2+}}\) und \(\ce{Cu^{2+}}\) Flecken dieselbe Farbe hätten, wäre die Identifizierung eines Unbekannten schwieriger? Erklären Sie Ihre Antwort.