Video \(\pageIndex{1}\): Eine kurze Einführung in das Genie Mendelejews.
Als frühe Chemiker daran arbeiteten, Erze zu reinigen und mehr Elemente zu entdecken, erkannten sie, dass verschiedene Elemente durch ihr ähnliches chemisches Verhalten gruppiert werden konnten. Eine solche Gruppierung umfasst Lithium (Li), Natrium (Na) und Kalium (K): Diese Elemente sind alle glänzend, leiten Wärme und Elektrizität gut und haben ähnliche chemische Eigenschaften. Eine zweite Gruppe umfasst Calcium (Ca), Strontium (Sr) und Barium (Ba), die ebenfalls glänzend sind, gute Wärme- und Stromleiter sind und gemeinsame chemische Eigenschaften haben. Die spezifischen Eigenschaften dieser beiden Gruppierungen unterscheiden sich jedoch erheblich voneinander. Zum Beispiel: Li, Na und K sind viel reaktiver als Ca, Sr und Ba; Li, Na und K bilden Verbindungen mit Sauerstoff in einem Verhältnis von zwei ihrer Atome zu einem Sauerstoffatom, während Ca, Sr und Ba Verbindungen mit einem ihrer Atome zu einem Sauerstoffatom bilden. Fluor (F), Chlor (Cl), Brom (Br) und Jod (I) weisen ebenfalls ähnliche Eigenschaften auf, aber diese Eigenschaften unterscheiden sich drastisch von denen eines der obigen Elemente.
Dimitri Mendelejew in Russland (1869) und Lothar Meyer in Deutschland (1870) erkannten unabhängig voneinander, dass es eine periodische Beziehung zwischen den Eigenschaften der damals bekannten Elemente gab. Beide veröffentlichten Tabellen mit den Elementen nach zunehmender Atommasse angeordnet. Aber Mendelejew ging noch einen Schritt weiter als Meyer: Er benutzte seine Tabelle, um die Existenz von Elementen vorherzusagen, die ähnliche Eigenschaften wie Aluminium und Silizium haben würden, aber noch unbekannt waren. Die Entdeckungen von Gallium (1875) und Germanium (1886) unterstützten Mendelejews Arbeit sehr. Obwohl Mendelejew und Meyer einen langen Streit über die Priorität hatten, sind Mendelejews Beiträge zur Entwicklung des Periodensystems heute weithin anerkannt (Abbildung \(\pageIndex {1}\)).
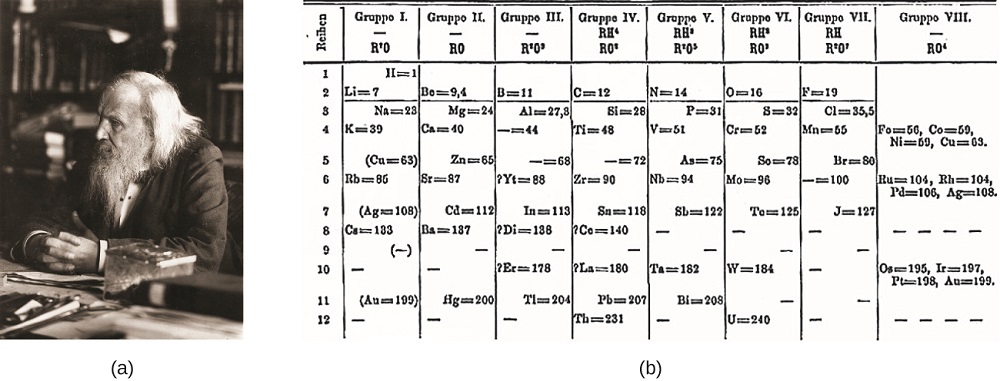
Abbildung \(\pageIndex{1}\): (a) Dimitri Mendelejew ist weithin mit der Schaffung (b) das erste Periodensystem der Elemente gutgeschrieben. (credit a: Modifikation der Arbeit von Serge Lachinov; credit b: Modifikation der Arbeit von „Den fjättrade ankan“/Wikimedia Commons)
Video \(\pageIndex{2}\): Eine Einführung in die Organisation des Periodensystems in Perioden und Gruppen. Diese Organisation wird wichtig sein, da wir weiterhin auf den Prinzipien der Chemie aufbauen.
Im zwanzigsten Jahrhundert wurde deutlich, dass die periodische Beziehung eher Ordnungszahlen als Atommassen umfasste. Die moderne Aussage dieser Beziehung, das periodische Gesetz, lautet wie folgt: Die Eigenschaften der Elemente sind periodische Funktionen ihrer Ordnungszahlen. Ein modernes Periodensystem ordnet die Elemente in aufsteigender Reihenfolge ihrer Ordnungszahlen an und gruppiert Atome mit ähnlichen Eigenschaften in derselben vertikalen Spalte (Abbildung \(\pageIndex{2}\)). Jedes Feld stellt ein Element dar und enthält seine Ordnungszahl, sein Symbol, seine durchschnittliche Atommasse und (manchmal) seinen Namen. Die Elemente sind in sieben horizontalen Zeilen angeordnet, die als Perioden oder Serien bezeichnet werden, und in 18 vertikalen Spalten, die als Gruppen bezeichnet werden. Gruppen werden oben in jeder Spalte beschriftet. In den Vereinigten Staaten waren die Etiketten traditionell Ziffern mit Großbuchstaben. Die IUPAC empfiehlt jedoch, die Nummern 1 bis 18 zu verwenden, und diese Bezeichnungen sind häufiger. Damit die Tabelle auf eine einzelne Seite passt, werden normalerweise Teile von zwei der Zeilen, insgesamt 14 Spalten, unter den Hauptteil der Tabelle geschrieben.

Abbildung \(\pageIndex{2}\): Elemente im Periodensystem sind nach ihren Eigenschaften organisiert.
Viele Elemente unterscheiden sich dramatisch in ihren chemischen und physikalischen Eigenschaften, aber einige Elemente sind in ihrem Verhalten ähnlich. Zum Beispiel erscheinen viele Elemente glänzend, sind formbar (können verformt werden, ohne zu brechen) und duktil (können in Drähte gezogen werden) und leiten Wärme und Elektrizität gut. Andere Elemente sind nicht glänzend, formbar oder duktil und sind schlechte Wärme- und Stromleiter. Wir können die Elemente in große Klassen mit gemeinsamen Eigenschaften einteilen: Metalle (Elemente, die glänzend, formbar, gute Wärme- und Stromleiter sind — gelb schattiert); Nichtmetalle (Elemente, die stumpf erscheinen, schlechte Wärme— und Stromleiter – grün schattiert); und Metalloide (Elemente, die Wärme und Elektrizität mäßig gut leiten und einige Eigenschaften von Metallen und einige Eigenschaften von Nichtmetallen besitzen — lila schattiert).
Die Elemente können auch in die Hauptgruppenelemente (oder repräsentative Elemente) in den mit 1, 2 und 13-18 bezeichneten Spalten eingeteilt werden; die Übergangsmetalle in den mit 3-12 bezeichneten Spalten; und innere Übergangsmetalle in den beiden Zeilen am unteren Rand der Tabelle (die Elemente der oberen Zeile werden Lanthaniden und die Elemente der unteren Zeile Actiniden genannt; Abbildung \(\pageIndex{3}\)). Die Elemente können durch spezifischere Eigenschaften, wie die Zusammensetzung der von ihnen gebildeten Verbindungen, weiter unterteilt werden. Zum Beispiel bilden die Elemente in Gruppe 1 (die erste Spalte) Verbindungen, die aus einem Atom des Elements und einem Atom Wasserstoff bestehen. Diese Elemente (außer Wasserstoff) sind als Alkalimetalle bekannt und haben alle ähnliche chemische Eigenschaften. Die Elemente in Gruppe 2 (die zweite Spalte) bilden Verbindungen, die aus einem Atom des Elements und zwei Wasserstoffatomen bestehen: Diese werden Erdalkalimetalle genannt, mit ähnlichen Eigenschaften unter Mitgliedern dieser Gruppe. Andere Gruppen mit spezifischen Namen sind die Pnictogene (Gruppe 15), Chalkogene (Gruppe 16), Halogene (Gruppe 17) und die Edelgase (Gruppe 18, auch Inertgase genannt). Die Gruppen können auch durch das erste Element der Gruppe bezeichnet werden: Zum Beispiel können die Chalkogene die Sauerstoffgruppe oder Sauerstofffamilie genannt werden. Wasserstoff ist ein einzigartiges, nichtmetallisches Element mit ähnlichen Eigenschaften wie Elemente der Gruppe 1 und Gruppe 17. Aus diesem Grund kann Wasserstoff an der Spitze beider Gruppen oder allein gezeigt werden.
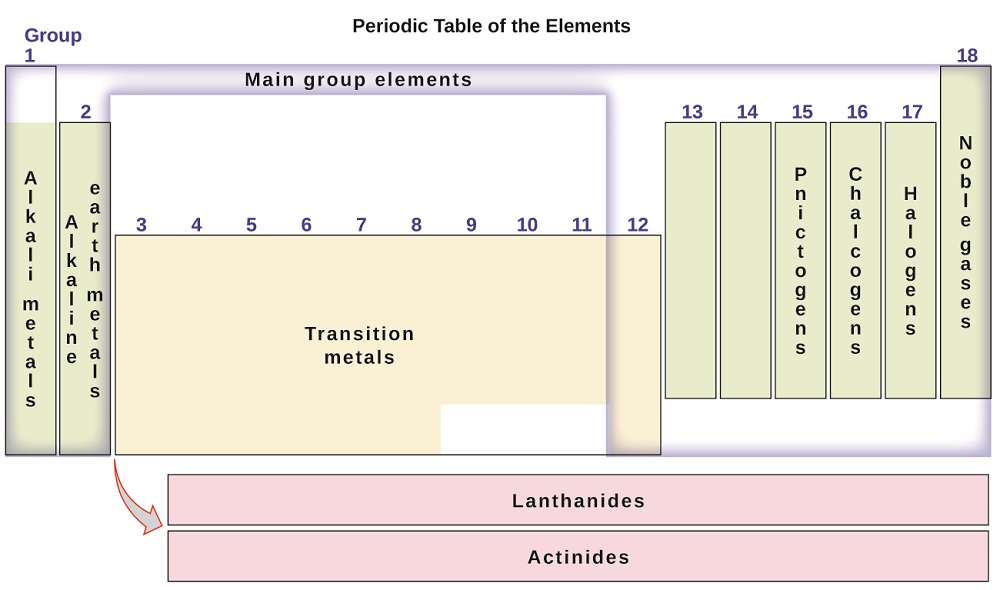
Abbildung \(\pageIndex{3}\): Das Periodensystem organisiert Elemente mit ähnlichen Eigenschaften in Gruppen.
Beispiel \(\pageIndex{1}\): Benennung von Elementgruppen
Atome jedes der folgenden Elemente sind lebensnotwendig. Geben Sie den Gruppennamen für die folgenden Elemente an:
- chlorine
- calcium
- sodium
- sulfur
Solution
The family names are as follows:
- halogen
- alkaline earth metal
- alkali metal
- chalcogen
Exercise \(\PageIndex{1}\)
Give the group name for each of the following elements:
- Krypton
- Selen
- Barium
- Lithium
Antwort a
Edelgas
Antwort b
Chalkogen
Antwort c
Erdalkalimetall
Antwort d
Alkalimetall
Beim Studium des Periodensystems haben Sie vielleicht etwas über die Atommassen einiger Elemente bemerkt. Element 43 (Technetium), Element 61 (Promethium) und die meisten Elemente mit der Ordnungszahl 84 (Polonium) und höher haben ihre Atommasse in eckigen Klammern angegeben. Dies geschieht für Elemente, die ausschließlich aus instabilen, radioaktiven Isotopen bestehen (mehr über Radioaktivität erfahren Sie im Kapitel Kernchemie). Ein durchschnittliches Atomgewicht kann für diese Elemente nicht bestimmt werden, da ihre Radioisotope je nach Quelle in relativer Häufigkeit erheblich variieren können oder in der Natur nicht einmal existieren. Die Zahl in eckigen Klammern ist die Atommassenzahl (und ungefähre Atommasse) des stabilsten Isotops dieses Elements.
Zusammenfassung
Video \(\pageIndex{3}\): Eine Zusammenfassung der Entdeckung und Eigenschaften des Periodensystems.
Die Entdeckung der periodischen Wiederholung ähnlicher Eigenschaften unter den Elementen führte zur Formulierung des Periodensystems, in dem die Elemente in der Reihenfolge zunehmender Ordnungszahl in Zeilen angeordnet sind, die als Perioden und Spalten als Gruppen bekannt sind. Elemente derselben Gruppe des Periodensystems haben ähnliche chemische Eigenschaften. Elemente können als Metalle, Metalloide und Nichtmetalle oder als Hauptgruppenelemente, Übergangsmetalle und innere Übergangsmetalle klassifiziert werden. Die Gruppen sind von links nach rechts mit 1-18 nummeriert. Die Elemente in Gruppe 1 sind als Alkalimetalle bekannt; die in Gruppe 2 sind die Erdalkalimetalle; die in 15 sind die Pnictogene; die in 16 sind die Chalkogene; die in 17 sind die Halogene; und die in 18 sind die Edelgase.