Lernziele
Am Ende dieses Abschnitts können Sie:
- Erklären Sie die Beziehungen zwischen mikroskopischen und makroskopischen Größen in einem Gas
- Lösen Sie Probleme mit Gasgemischen
- Lösen Sie Probleme mit dem Abstand und der Zeit zwischen den Kollisionen eines Gasmoleküls
Wir haben Druck und Temperatur anhand ihrer makroskopischen Definitionen untersucht. Der Druck ist die Kraft geteilt durch die Fläche, auf die die Kraft ausgeübt wird, und die Temperatur wird mit einem Thermometer gemessen. Wir können ein besseres Verständnis von Druck und Temperatur aus der kinetischen Theorie von Gasen gewinnen, der Theorie, die die makroskopischen Eigenschaften von Gasen mit der Bewegung der Moleküle in Beziehung setzt, aus denen sie bestehen. Zunächst machen wir zwei Annahmen über Moleküle in einem idealen Gas.
- Es gibt eine sehr große Anzahl N von Molekülen, die alle identisch sind und jeweils eine Masse m haben.
- Die Moleküle gehorchen den Newtonschen Gesetzen und sind in kontinuierlicher Bewegung, die zufällig und isotrop ist, dh in alle Richtungen gleich.
Um das ideale Gasgesetz und den Zusammenhang zwischen mikroskopischen Größen wie der Energie eines typischen Moleküls und makroskopischen Größen wie der Temperatur abzuleiten, analysieren wir eine Probe eines idealen Gases in einem starren Behälter, über den wir zwei weitere Annahmen treffen:
- Die Moleküle sind viel kleiner als der durchschnittliche Abstand zwischen ihnen, daher ist ihr Gesamtvolumen viel geringer als das ihres Behälters (der Volumen V hat). Mit anderen Worten, wir nehmen die Van-der-Waals-Konstante b, das Volumen eines Mols Gasmoleküle, als vernachlässigbar im Vergleich zum Volumen eines Mols Gas in dem Behälter an.
- Die Moleküle machen perfekt elastische Kollisionen mit den Wänden des Behälters und miteinander. Andere Kräfte auf sie, einschließlich der Schwerkraft und der Attraktionen, die durch die Van-der-Waals-Konstante a dargestellt werden, sind vernachlässigbar (wie es für die Annahme der Isotropie notwendig ist).
Die Kollisionen zwischen Molekülen treten bei der Ableitung des idealen Gasgesetzes nicht auf. Sie stören auch nicht die Ableitung, da Kollisionen zwischen Molekülen, die sich mit zufälligen Geschwindigkeiten bewegen, neue zufällige Geschwindigkeiten ergeben. Wenn die Geschwindigkeiten von Gasmolekülen in einem Behälter anfänglich nicht zufällig und isotrop sind, machen Molekülkollisionen sie zufällig und isotrop.
Wir treffen noch weitere Annahmen, die die Berechnungen vereinfachen, aber das Ergebnis nicht beeinflussen. Zuerst lassen wir den Behälter eine rechteckige Box sein. Zweitens betrachten wir zunächst einatomige Gase, deren Moleküle aus einzelnen Atomen bestehen, wie Helium. Dann können wir annehmen, dass die Atome keine Energie außer ihrer translatorischen kinetischen Energie haben; Zum Beispiel haben sie weder Rotations- noch Schwingungsenergie. (Später diskutieren wir die Gültigkeit dieser Annahme für reale einatomige Gase und verzichten darauf, zweiatomige und mehratomige Gase zu berücksichtigen.)
Abbildung \(\pageIndex{1}\) zeigt eine Kollision eines Gasmoleküls mit der Wand eines Behälters, so dass es eine Kraft auf die Wand ausübt (nach Newtons drittem Gesetz). Diese Kollisionen sind die Druckquelle in einem Gas. Mit zunehmender Anzahl der Moleküle nimmt die Anzahl der Kollisionen und damit der Druck zu. In ähnlicher Weise ist der Gasdruck höher, wenn die durchschnittliche Geschwindigkeit der Moleküle höher ist.
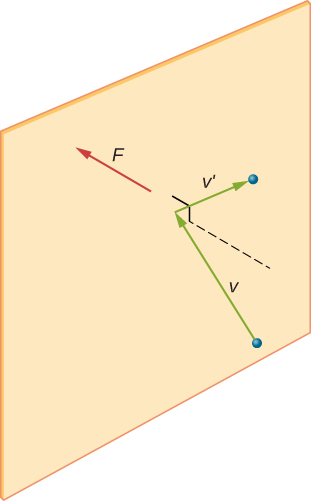
In einer Gasprobe in einem Behälter bewirkt die Zufälligkeit der Molekülbewegung, dass die Anzahl der Kollisionen von Molekülen mit einem beliebigen Teil der Wand in einer bestimmten Zeit schwankt. Da jedoch eine große Anzahl von Molekülen in kurzer Zeit mit der Wand kollidiert, schwankt die Anzahl der Kollisionen auf den von uns gemessenen Zeit- und Raumskalen nur um einen winzigen, normalerweise nicht beobachtbaren Bruchteil vom Durchschnitt. Wir können diese Situation mit der eines Casinos vergleichen, in dem die Ergebnisse der Wetten zufällig sind und die Einnahmen des Casinos von Minute zu Stunde schwanken. Über lange Zeiträume wie ein Jahr liegen die Einnahmen des Casinos jedoch sehr nahe an den Durchschnittswerten, die von den Gewinnchancen erwartet werden. Ein Tank von Gas hat enorm mehr Moleküle als ein Casino Wettern in einem Jahr hat, und die Moleküle machen enorm mehr Kollisionen in einer Sekunde als ein Casino Wetten hat.
Eine Berechnung der durchschnittlichen Kraft, die von Molekülen auf die Wände der Box ausgeübt wird, führt uns zum idealen Gasgesetz und zum Zusammenhang zwischen Temperatur und molekularer kinetischer Energie. (Tatsächlich nehmen wir zwei Mittelwerte: einen über die Zeit, um die durchschnittliche Kraft zu erhalten, die von einem Molekül mit einer gegebenen Geschwindigkeit ausgeübt wird, und dann einen anderen Durchschnitt über Moleküle mit unterschiedlichen Geschwindigkeiten.) Dieser Ansatz wurde von Daniel Bernoulli (1700-1782) entwickelt, der in der Physik vor allem für seine Arbeiten zur Flüssigkeitsströmung (Hydrodynamik) bekannt ist. Bemerkenswerterweise machte Bernoulli diese Arbeit, bevor Dalton die Ansicht von Materie als aus Atomen bestehend etablierte.
Abbildung \(\pageIndex{2}\) zeigt einen Behälter voller Gas und eine erweiterte Ansicht einer elastischen Kollision eines Gasmoleküls mit einer Wand des Behälters, die in Komponenten zerlegt ist. Wir haben angenommen, dass ein Molekül im Vergleich zur Trennung von Molekülen im Gas klein ist und dass seine Wechselwirkung mit anderen Molekülen ignoriert werden kann. Unter diesen Bedingungen ist das ideale Gasgesetz experimentell gültig. Da wir auch angenommen haben, dass die Wand starr ist und die Partikel Punkte sind, ist die Kollision elastisch (durch Energieeinsparung — die kinetische Energie eines Partikels kann nirgendwo hingehen). Daher bleibt die kinetische Energie des Moleküls konstant, und daher bleiben auch seine Geschwindigkeit und die Größe seines Impulses konstant. Diese Annahme ist nicht immer gültig, aber die Ergebnisse im Rest dieses Moduls werden auch in Modellen erhalten, die die Moleküle Energie und Impuls mit der Wand austauschen lassen.
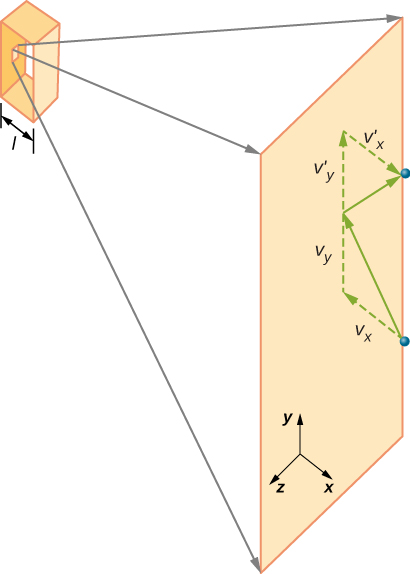
Wenn sich die Geschwindigkeit des Moleküls in x-Richtung ändert, ändert sich sein Impuls von \(-m_x\) zu \(+mv_x\). Somit ist seine Impulsänderung \(\Delta mv = +mv_x -(-mv_x) = 2mv_x\). Nach dem Impuls-Impuls-Theorem im Kapitel über linearen Impuls und Kollisionen ist die auf das i-te Molekül ausgeübte Kraft, wobei i die Moleküle von 1 bis N bezeichnet, gegeben durch \
(Allein in dieser Gleichung steht p für Impuls, nicht für Druck. Es gibt keine Kraft zwischen der Wand und dem Molekül, außer während das Molekül die Wand berührt. Während der kurzen Zeit der Kollision ist die Kraft zwischen Molekül und Wand relativ groß, aber das ist nicht die Kraft, die wir suchen. Wir suchen nach der durchschnittlichen Kraft, also nehmen wir \ (\Delta t\) als die durchschnittliche Zeit zwischen Kollisionen des gegebenen Moleküls mit dieser Wand, die die Zeit ist, in der wir erwarten, eine Kollision zu finden. Sei l die Länge der Box in x-Richtung. Dann ist \(\Delta t\) die Zeit, die das Molekül nehmen würde, um über die Box und zurück zu gehen, eine Entfernung 2l, mit einer Geschwindigkeit von \(v_x \). Also \(\delta t = 2l/v_x\), und der Ausdruck für die Kraft wird
\
Diese Kraft ist auf ein Molekül zurückzuführen. Um die Gesamtkraft an der Wand F zu finden, müssen wir die Beiträge aller N Moleküle addieren:
\
Wir verwenden nun die Definition des Durchschnitts, die wir mit einem Balken bezeichnen, um die Kraft zu finden:
\
Wir wollen die Kraft in Bezug auf die Geschwindigkeit v und nicht die x-Komponente der Geschwindigkeit. Beachten Sie, dass die Gesamtgeschwindigkeit im Quadrat die Summe der Quadrate ihrer Komponenten ist, so dass
\
Unter der Annahme der Isotropie die drei Mittelwerte auf der rechten Seite gleich sind, also
\
Wenn Sie dies in den Ausdruck für F ersetzen, erhalten Sie
\
Der Druck ist F/A, also erhalten wir
\, wo wir \(V = Al\) für das Volumen verwendet haben. Dies ergibt das wichtige Ergebnis
\
Die Kombination dieser Gleichung mit \(pV = Nk_BT\) ergibt
\
Wir können die durchschnittliche kinetische Energie eines Moleküls, \(\frac{1}{2} m\overline{v}^2\), von der linken Seite der Gleichung erhalten, indem wir N dividieren und mit 3/2 multiplizieren.
Durchschnittliche kinetische Energie pro Molekül
Die durchschnittliche kinetische Energie eines Moleküls ist direkt proportional zu seiner absoluten Temperatur:
\
Die Gleichung \(\overline{K} = \frac{3}{2} k_BT\) ist die durchschnittliche kinetische Energie pro Molekül. Beachten Sie insbesondere, dass nichts in dieser Gleichung von der Molekülmasse (oder einer anderen Eigenschaft) des Gases, dem Druck oder irgendetwas anderem als der Temperatur abhängt. Wenn Proben von Helium- und Xenongas mit sehr unterschiedlichen Molekülmassen die gleiche Temperatur haben, haben die Moleküle die gleiche durchschnittliche kinetische Energie.
Die innere Energie eines thermodynamischen Systems ist die Summe der mechanischen Energien aller Moleküle in ihm. Wir können nun eine Gleichung für die innere Energie eines einatomigen idealen Gases geben. In einem solchen Gas ist die einzige Energie der Moleküle ihre translatorische kinetische Energie. Wenn wir also die innere Energie mit \(E_{int}\) bezeichnen, haben wir einfach \(E_{int} = N\overline{K}\) oder
\
Oft möchten wir diese Gleichung in Mol verwenden:
\
Wir können \(\overline{K} = \frac{1}{2}m\overline{v}^2 = \frac{3}{2}k_BT \) für eine typische Geschwindigkeit eines Moleküls in einem idealen Gas in Bezug auf die Temperatur zu bestimmen, was als Root-Mean-square (rms) Geschwindigkeit eines Moleküls bekannt ist.
RMS-Geschwindigkeit eines Moleküls
Die Root-Mean-Square (rms) -Geschwindigkeit eines Moleküls oder die Quadratwurzel des Durchschnitts des Quadrats der Geschwindigkeit \(\overline{v}^2\) ist
\
Die Rms-Geschwindigkeit ist nicht die durchschnittliche oder wahrscheinlichste Geschwindigkeit von Molekülen, wie wir in Verteilung der Molekülgeschwindigkeiten sehen werden, aber sie liefert eine leicht berechenbare Schätzung der Geschwindigkeit der Moleküle, die mit der Verteilung der Molekülgeschwindigkeiten zusammenhängt ihre kinetische Energie. Auch hier können wir diese Gleichung in Bezug auf die Gaskonstante R und die Molmasse M in kg / mol schreiben:
\
Wir schweifen einen Moment ab, um eine Frage zu beantworten, die Ihnen möglicherweise in den Sinn gekommen ist: Wenn wir das Modell auf Atome anstelle theoretischer Punktteilchen anwenden, ändert die kinetische Rotationsenergie unsere Ergebnisse? Um diese Frage zu beantworten, müssen wir an die Quantenmechanik appellieren. In der Quantenmechanik kann die kinetische Rotationsenergie nicht irgendeinen Wert annehmen; es ist auf eine diskrete Menge von Werten beschränkt, und der kleinste Wert ist umgekehrt proportional zur Rotationsträgheit. Die Rotationsträgheit eines Atoms ist winzig, da sich fast seine gesamte Masse im Kern befindet, der typischerweise einen Radius von weniger als \ (10 ^ {-14} m \) hat. Somit ist die minimale Rotationsenergie eines Atoms viel mehr als \(\frac {1} {2} k_BT\) für jede erreichbare Temperatur, und die verfügbare Energie reicht nicht aus, um ein Atom rotieren zu lassen. Wir werden auf diesen Punkt zurückkommen, wenn wir im nächsten Abschnitt zweiatomige und mehratomige Gase diskutieren.
Beispiel \(\pageIndex{1}\): Berechnung der kinetischen Energie und Geschwindigkeit eines Gasmoleküls
- Was ist die durchschnittliche kinetische Energie eines Gasmoleküls bei \(20.0 ^oC\) (Raumtemperatur)?
- Ermitteln Sie die Effektivgeschwindigkeit eines Stickstoffmoleküls (\(N_2\)) bei dieser Temperatur.
Strategie
(a) Die in der Gleichung für die durchschnittliche kinetische Energie bekannte Temperatur ist die Temperatur:
\
Bevor wir Werte in diese Gleichung einsetzen, müssen wir die gegebene Temperatur in Kelvin umwandeln: \(T = (20,0 + 273) \, K = 293 \, K\). Wir können die Effektivgeschwindigkeit eines Stickstoffmoleküls mit der Gleichung
\
aber wir müssen zuerst die Masse eines Stickstoffmoleküls finden. Wenn wir die Molmasse von Stickstoff \(N_2\) aus dem Periodensystem erhalten, finden wir
\
Lösung
- Die Temperatur allein reicht aus, um die durchschnittliche translationskinetische Energie zu ermitteln. Setzt man die Temperatur in die translationale kinetische Energiegleichung ein, so erhält man \
- Setzt man diese Masse und den Wert für \(k_B\) in die Gleichung für \(v_{rms}\) ein, so erhält man \
Signifikanz
Man beachte, dass die mittlere kinetische Energie des Moleküls unabhängig von der Art des Moleküls ist. Die durchschnittliche kinetische Translationsenergie hängt nur von der absoluten Temperatur ab. Die kinetische Energie ist im Vergleich zu makroskopischen Energien sehr gering, so dass wir nicht fühlen, wenn ein Luftmolekül auf unsere Haut trifft. Auf der anderen Seite ist es viel größer als der typische Unterschied in der potentiellen Gravitationsenergie, wenn sich ein Molekül beispielsweise von oben nach unten in einem Raum bewegt, so dass unsere Vernachlässigung der Gravitation in typischen realen Situationen gerechtfertigt ist. Die Effektivgeschwindigkeit des Stickstoffmoleküls ist überraschend groß. Diese großen Molekülgeschwindigkeiten ergeben keine makroskopische Luftbewegung, da sich die Moleküle mit gleicher Wahrscheinlichkeit in alle Richtungen bewegen. Der mittlere freie Weg (der Abstand, den ein Molekül im Durchschnitt zwischen Kollisionen bewegt, etwas später in diesem Abschnitt besprochen) von Molekülen in Luft ist sehr klein, so dass sich die Moleküle schnell bewegen, aber in einer Sekunde nicht sehr weit kommen. Der hohe Wert für die Effektivgeschwindigkeit spiegelt sich in der Schallgeschwindigkeit wider, die bei Raumtemperatur etwa 340 m / s beträgt. Je höher die Effektivgeschwindigkeit von Luftmolekülen ist, desto schneller können Schallschwingungen durch die Luft übertragen werden. Die Schallgeschwindigkeit nimmt mit der Temperatur zu und ist in Gasen mit kleinen Molekülmassen wie Helium größer (siehe Abbildung \(\pageIndex{3}\)).
Beispiel \(\pageIndex{2}\): Berechnung der Temperatur: Fluchtgeschwindigkeit von Heliumatomen
Um der Schwerkraft der Erde zu entkommen, muss sich ein Objekt in der Nähe der Erdatmosphäre (in einer Höhe von 100 km) mit 11,1 km/ s von der Erde entfernen. Bei welcher Temperatur hätten Heliumatome eine Effektivgeschwindigkeit, die der Fluchtgeschwindigkeit entspricht?
Strategie
Identifizieren Sie die Bekannten und Unbekannten und bestimmen Sie, welche Gleichungen zur Lösung des Problems verwendet werden sollen.
Lösung
- Identifizieren Sie die Bekannten: v ist die Fluchtgeschwindigkeit, 11,1 km/s.
- Identifizieren Sie die Unbekannten: Wir müssen für die Temperatur T lösen.
- Bestimmen Sie, welche Gleichungen benötigt werden.
- Um die Masse m des Heliumatoms zu erhalten, können wir Informationen aus dem Periodensystem verwenden: \
- Um die Temperatur T zu lösen, können wir \ neu anordnen, um \
- Ersetzen Sie die bekannten Werte in die Gleichungen und lösen Sie die Unbekannten, \ und \
Bedeutung
Diese Temperatur ist viel höher als die atmosphärische Temperatur, die ungefähr 250 K (\(-25 ^oC\) oder \(-10 ^Of\)) in großer Höhe beträgt. Sehr wenige Heliumatome sind in der Atmosphäre übrig, aber viele waren vorhanden, als die Atmosphäre gebildet wurde, und mehr werden immer durch radioaktiven Zerfall erzeugt (siehe Kapitel über Kernphysik). Der Grund für den Verlust von Heliumatomen ist, dass eine kleine Anzahl von Heliumatomen selbst bei normalen Temperaturen höhere Geschwindigkeiten als die Fluchtgeschwindigkeit der Erde aufweist. Die Geschwindigkeit eines Heliumatoms ändert sich von einer Kollision zur nächsten, so dass zu jedem Zeitpunkt eine kleine, aber ungleiche Chance besteht, dass die Geschwindigkeit des Atoms größer ist als die Fluchtgeschwindigkeit. Die Wahrscheinlichkeit ist hoch genug, dass im Laufe der Lebensdauer der Erde fast alle Heliumatome, die sich in der Atmosphäre befanden, in großen Höhen eine Fluchtgeschwindigkeit erreicht haben und der Anziehungskraft der Erde entkommen sind. Schwerere Moleküle, wie Sauerstoff, Stickstoff und Wasser, haben kleinere Effektivgeschwindigkeiten, und so ist es viel weniger wahrscheinlich, dass irgendwelche von ihnen Geschwindigkeiten größer als die Fluchtgeschwindigkeit haben. Tatsächlich ist die Wahrscheinlichkeit so gering, dass Milliarden von Jahren erforderlich sind, um signifikante Mengen schwererer Moleküle aus der Atmosphäre zu verlieren. Abbildung \(\pageIndex{4}\) zeigt den Effekt einer fehlenden Atmosphäre auf dem Mond. Da die Anziehungskraft des Mondes viel schwächer ist, hat er fast seine gesamte Atmosphäre verloren. Die Atmosphären der Erde und anderer Körper werden in den Übungen dieses Kapitels verglichen.

Übung \(\pageIndex{2}\)
Wenn Sie ein sehr kleines Objekt wie ein Pollenkorn in einem Gas betrachten, wäre auch die Anzahl der Moleküle, die auf seine Oberfläche treffen, relativ gering. Würden Sie erwarten, dass das Pollenkorn aufgrund statistischer Schwankungen der Anzahl der Gasmoleküle, die in einer bestimmten Zeit auf das Pollenkorn treffen, Druckschwankungen erfährt?
Antwort
Ja. Solche Fluktuationen treten tatsächlich für einen Körper beliebiger Größe in einem Gas auf, aber da die Anzahl der Moleküle für makroskopische Körper immens ist, sind die Fluktuationen ein winziger Prozentsatz der Anzahl der Kollisionen, und die in diesem Abschnitt angesprochenen Durchschnittswerte variieren unmerklich. Grob gesagt sind die Schwankungen umgekehrt proportional zur Quadratwurzel der Anzahl der Kollisionen, so dass sie für kleine Körper signifikant werden können. Dies wurde tatsächlich im neunzehnten Jahrhundert für Pollenkörner in Wasser beobachtet und ist als Brownsche Bewegung bekannt.
Dampfdruck, Partialdruck und Daltonsches Gesetz
Der Druck, den ein Gas erzeugen würde, wenn es das verfügbare Gesamtvolumen einnimmt, wird als Partialdruck des Gases bezeichnet. Wenn zwei oder mehr Gase gemischt werden, kommen sie durch Kollisionen zwischen Molekülen zum thermischen Gleichgewicht; das Verfahren ist analog zur Wärmeleitung, wie im Kapitel Temperatur und Wärme beschrieben. Wie wir aus der kinetischen Theorie gesehen haben, wenn die Gase die gleiche Temperatur haben, haben ihre Moleküle die gleiche durchschnittliche kinetische Energie. Somit gehorcht jedes Gas separat dem idealen Gasgesetz und übt den gleichen Druck auf die Wände eines Behälters aus, den es hätte, wenn es allein wäre. Daher ist der Gesamtdruck in einem Gasgemisch die Summe der Partialdrücke der Komponentengase, wobei ein ideales Gasverhalten und keine chemischen Reaktionen zwischen den Komponenten angenommen werden. Dieses Gesetz ist bekannt als Daltons Partialdruckgesetz, nach dem englischen Wissenschaftler John Dalton (1766-1844), der es vorgeschlagen hat. Das Daltonsche Gesetz steht im Einklang mit der Tatsache, dass sich Drücke nach dem Pascalschen Prinzip addieren.
In einer Mischung idealer Gase im thermischen Gleichgewicht ist die Anzahl der Moleküle jedes Gases proportional zu seinem Partialdruck. Dieses Ergebnis ergibt sich aus der Anwendung des idealen Gasgesetzes auf jedes in der Form \(p / n = RT / V \). Da die rechte Seite für jedes Gas bei einer bestimmten Temperatur in einem Behälter mit einem bestimmten Volumen gleich ist, ist auch die linke Seite gleich.
- Partialdruck ist der Druck, den ein Gas erzeugen würde, wenn es alleine existieren würde.Das Daltonsche Gesetz besagt, dass der Gesamtdruck die Summe der Partialdrücke aller vorhandenen Gase ist.
- Für zwei beliebige Gase (mit der Bezeichnung 1 und 2) im Gleichgewicht in einem Behälter, \(\frac{p_1}{n_1} = \frac{p_2}{n_2}.\)
Eine wichtige Anwendung des Partialdrucks besteht darin, dass er in der Chemie als Konzentration eines Gases bei der Bestimmung der Reaktionsgeschwindigkeit fungiert. Hier erwähnen wir nur, dass der Sauerstoffpartialdruck in der Lunge eines Menschen entscheidend für Leben und Gesundheit ist. Atemluft mit einem Sauerstoffpartialdruck unter 0,16 atm kann die Koordination und das Urteilsvermögen beeinträchtigen, insbesondere bei Menschen, die sich nicht an eine hohe Höhe gewöhnt haben. Niedrigere Partialdrücke von \ (O_2 \) haben ernstere Auswirkungen; Partialdrücke unter 0,06 atm können schnell tödlich sein, und dauerhafte Schäden sind wahrscheinlich, selbst wenn die Person gerettet wird. Das Gefühl, atmen zu müssen, wie beim Anhalten des Atems, wird jedoch viel mehr durch hohe Kohlendioxidkonzentrationen im Blut als durch niedrige Sauerstoffkonzentrationen verursacht. Wenn also ein kleiner Raum oder Schrank mit Luft mit einer geringen Sauerstoffkonzentration gefüllt ist, vielleicht weil dort ein undichter Zylinder mit komprimiertem Gas gelagert wird, wird eine Person kein „Erstickungsgefühl“ verspüren und kann Krämpfe bekommen oder das Bewusstsein verlieren, ohne etwas Falsches zu bemerken. Sicherheitsingenieure schenken dieser Gefahr große Aufmerksamkeit.Eine weitere wichtige Anwendung des Partialdrucks ist der Dampfdruck, der der Partialdruck eines Dampfes ist, bei dem er sich im Gleichgewicht mit der flüssigen (oder festen, im Falle der Sublimation) Phase derselben Substanz befindet. Bei jeder Temperatur kann der Partialdruck des Wassers in der Luft den Dampfdruck des Wassers bei dieser Temperatur nicht überschreiten, da immer dann, wenn der Partialdruck den Dampfdruck erreicht, Wasser aus der Luft kondensiert. Tau ist ein Beispiel für diese Kondensation. Die Temperatur, bei der Kondensation für eine Luftprobe auftritt, wird als Taupunkt bezeichnet. Es wird leicht durch langsames Abkühlen einer Metallkugel gemessen; Der Taupunkt ist die Temperatur, bei der Kondensation zuerst auf der Kugel erscheint.
Die Dampfdrücke von Wasser bei einigen für die Meteorologie interessanten Temperaturen sind in Tabelle\(\pageIndex{1}\) angegeben.
| T(\(^oC\)) | Dampfdruck (Pa) |
|---|---|
| 0 | 610,5 |
| 3 | 757,9 |
| 5 | 872.3 |
| 8 | 1073 |
| 10 | 1228 |
| 13 | 1497 |
| 15 | 1705 |
| 18 | 2063 |
| 20 | 2338 |
| 23 | 2809 |
| 25 | 3167 |
| 30 | 4243 |
| 35 | 5623 |
| 40 | 7376 |
The relative humidity (R.H.) bei einer Temperatur T ist definiert durch
\
Eine relative Luftfeuchtigkeit von \(100\%\) bedeutet, dass der Partialdruck von Wasser gleich dem Dampfdruck ist; mit anderen Worten, die Luft ist mit Wasser gesättigt.
Beispiel \(\pageIndex{3}\): Berechnung der relativen Luftfeuchtigkeit
Wie hoch ist die relative Luftfeuchtigkeit, wenn die Lufttemperatur \(25^oC\) und der Taupunkt \(15^oC\) ist?
Strategie
Wir suchen einfach den Dampfdruck bei der gegebenen Temperatur und den am Taupunkt und finden das Verhältnis.
Lösung
\
Bedeutung
R.H. ist wichtig für unseren Komfort. Der Wert von \(53,8\%\) liegt im Bereich von \(40\%\) bis \(60\%\), der für den Komfort in Innenräumen empfohlen wird.
Wie im Kapitel über Temperatur und Wärme erwähnt, fällt die Temperatur selten unter den Taupunkt, da Wasser bei Erreichen des Taupunkts oder Frostpunkts kondensiert und eine relativ große Menge latenter Verdampfungswärme freisetzt.
Mittlerer freier Weg und mittlere freie Zeit
Wir betrachten nun Kollisionen explizit. Der übliche erste Schritt (der alles ist, was wir tun werden) besteht darin, den mittleren freien Weg \ (\ lambda \), die durchschnittliche Entfernung, die ein Molekül zwischen Kollisionen mit anderen Molekülen zurücklegt, und die mittlere freie Zeit \ (\ tau \), die durchschnittliche Zeit zwischen den Kollisionen eines Moleküls, zu berechnen. Wenn wir annehmen, dass alle Moleküle Kugeln mit einem Radius \ (r \) sind, kollidiert ein Molekül mit einem anderen, wenn ihre Zentren innerhalb eines Abstands 2r voneinander liegen. Für ein gegebenes Teilchen sagen wir, dass die Fläche eines Kreises mit diesem Radius \ (4 \ pi r ^ 2 \) der „Querschnitt“ für Kollisionen ist. Wenn sich das Teilchen bewegt, verfolgt es einen Zylinder mit dieser Querschnittsfläche. Der mittlere freie Weg ist die Länge \(\lambda\), so dass die erwartete Anzahl anderer Moleküle in einem Zylinder der Länge \ (\lambda\) und des Querschnitts \ (4 \ pi r ^ 2 \) 1 ist. Wenn wir die Bewegung der anderen Moleküle als die, die wir betrachten, vorübergehend ignorieren, ist die erwartete Zahl die Anzahldichte der Moleküle, N / V, mal das Volumen, und das Volumen ist \(4 \ pi r ^ 2 \lambda\), also haben wir \((N/ V) 4\pi r ^2 \lambda = 1\), oder
\
Die Berücksichtigung der Bewegung aller Moleküle macht die Berechnung viel schwieriger, aber die einzige Änderung ist ein Faktor von \(\sqrt{2}\). Das Ergebnis ist
\
In einem idealen Gas können wir \(V / N = k_BT/p\) ersetzen, um
\
zu erhalten Die mittlere freie Zeit \ (\tau\) ist einfach der mittlere freie Weg geteilt durch eine typische Geschwindigkeit, und die übliche Wahl ist die Effektivgeschwindigkeit. Dann
\
Berechnung der mittleren freien Zeit
Ermitteln Sie die mittlere freie Zeit für Argonatome (\(M = 39,9 \, g/ mol\)) bei einer Temperatur von \(0 ^ oC\) und einem Druck von 1,00 atm. Nehmen wir den Radius eines Argonatoms als \ (1,70 \ mal 10 ^ {-10} \ Raum m\).
Lösung
- Identifizieren Sie die bekannten und konvertieren Sie sie in SI-Einheiten. Wir wissen, dass die Molmasse 0 ist.0399 kg / mol, die Temperatur beträgt 273 K, der Druck beträgt \ (1,01 \ mal 10 ^ 5 \, Pa \) und der Radius beträgt \ (1,70 \ mal 10 ^ {-10} \, m\).
- Ermitteln Sie die Effektivgeschwindigkeit: \(v_{rms} = \sqrt{\frac{3RT}{M}} = 413 \, m/s\).
- Setzen Sie in die Gleichung für die mittlere freie Zeit ein: \
\
Wir können dieses Ergebnis kaum mit unserer Intuition über Gasmoleküle vergleichen, aber es gibt uns ein Bild von Molekülen, die mit extrem hoher Frequenz kollidieren.
Übung \(\pageIndex{4}\)
Was hat einen längeren mittleren freien Weg, flüssiges Wasser oder Wasserdampf in der Luft?
Antwort
In einer Flüssigkeit stehen die Moleküle sehr dicht beieinander und kollidieren ständig miteinander. Damit ein Gas nahezu ideal ist, wie Luft unter normalen Bedingungen, müssen die Moleküle sehr weit voneinander entfernt sein. Daher ist der mittlere freie Weg in der Luft viel länger.
Mitwirkende und Zuschreibungen
-
Samuel J. Ling (Truman State University), Jeff Sanny (Loyola Marymount University) und Bill Moebs mit vielen beitragenden Autoren. Dieses Werk ist lizenziert von OpenStax University Physics unter einer Creative Commons Attribution License (by 4.0).