Molekülorbitale eines allylischen Carbokations
Die Stabilität des Carbokations von Propen beruht auf einem konjugierten π-Elektronensystem. Eine „Doppelbindung“ existiert nicht wirklich. Stattdessen ist es eine Gruppe von 3 benachbarten, überlappenden, nicht hybridisierten p-Orbitalen, die wir ein konjugiertes π-Elektronensystem nennen. Sie können die Wechselwirkungen zwischen allen drei p-Orbitalen aus den drei Kohlenstoffen deutlich sehen, was zu einem wirklich stabilen Kation führt. Es kommt darauf an, wo sich der elektronenarme Kohlenstoff befindet.
Molekülorbitalbeschreibungen können die allylische Stabilität auf noch andere Weise mit 2-Propenyl erklären. Abb.6
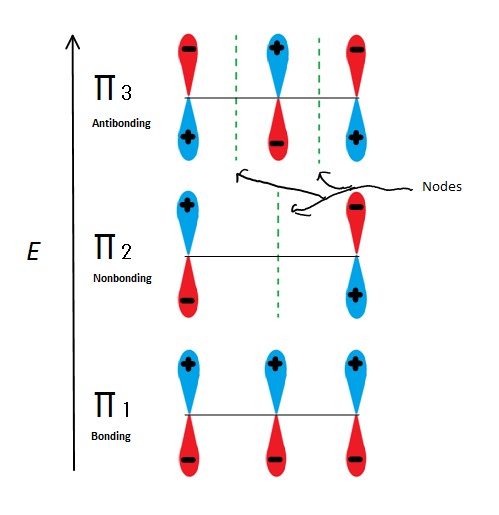
Abb.6 Zeigt die 3 möglichen Molekülorbitale von 2-Propenyl
Wenn wir nur das π-Molekülorbital und nicht eines der s nehmen, erhalten wir drei davon. π1 bindet ohne Knoten, π2 ist nicht bindend (mit anderen Worten, die gleiche Energie wie ein reguläres p-Orbital) mit einem Knoten und π3 ist nicht bindend mit 2 Knoten (keines der Orbitale interagiert). Die ersten beiden Elektronen gehen in das π1-Molekülorbital, unabhängig davon, ob es sich um ein Kation, ein Radikal oder ein Anion handelt. Wenn es sich um ein Radikal oder Anion handelt, geht das nächste Elektron in das π2-Molekülorbital. Das letzte Anionenelektron geht auch in das nichtbindende Orbital. Egal welche Art von Kohlenstoffzentrum existiert, kein Elektron wird jemals in das antibindende Orbital gelangen.
Die Bindungsorbitale sind die Orbitale mit der niedrigsten Energie und sind günstig, weshalb sie zuerst gefüllt werden. Obwohl die nichtbindenden Orbitale gefüllt werden können, ist die Gesamtenergie des Systems aufgrund der gefüllten Bindungsmolekülorbitale immer noch niedriger und stabiler.
Diese Abbildung zeigt auch, dass π2 das einzige Molekülorbital ist, in dem sich das Elektrion unterscheidet, und dass auch ein einzelner Knoten durch die Mitte verläuft. Aus diesem Grund befinden sich die Ladungen des Moleküls hauptsächlich an den beiden terminalen Kohlenstoffen und nicht am mittleren Kohlenstoff.
Diese Molekülorbitalbeschreibung kann auch die Stabilität allylischer Kohlenstoffzentren in Abbildung 7 veranschaulichen.
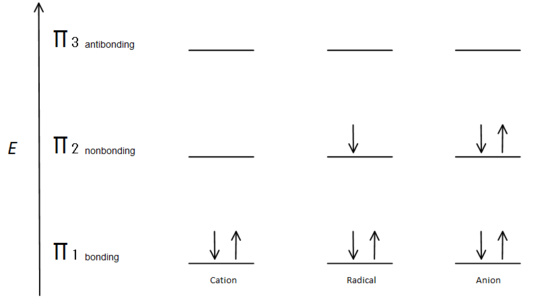
Abb.7 diagramm, das zeigt, wie sich die Elektronen nach dem Aufbauprinzip füllen.
Das π-Bindungsorbital hat eine geringere Energie als das nichtbindende p-Orbital. Da jedes Kohlenstoffzentrum zwei Elektronen in der niedrigeren Energie hat, die π-Orbitale binden, wird die Energie jedes Systems insgesamt gesenkt (und somit stabiler), unabhängig von Kation, Radikal oder Anion.