Nombre genérico: fluocinonida
Forma de dosificación:Pomada
Revisado médicamente por Drugs.com. Última actualización el 22 de diciembre de 2020.
- Descripción general
- Efectos secundarios
- Dosis
- Profesional
- Interacciones
- Más
Solo Rx
La marca Lidex se ha descontinuado en EE.UU. Si la FDA ha aprobado versiones genéricas de este producto, es posible que haya equivalentes genéricos disponibles.
Descripción de Lidex
El ungüento Lidex® (fluocinónida) al 0,05% está destinado a la administración tópica. El componente activo es el corticosteroide fluocinonide, que es el 21-acetato éster de fluocinolona acetónido y tiene el nombre químico pregna-1,4-dieno-3,20-diona,21-(acetyloxy)-6,9-difluoro-11-hidroxi-16,17–,(6α,11β,16α)-. Tiene la siguiente estructura química:
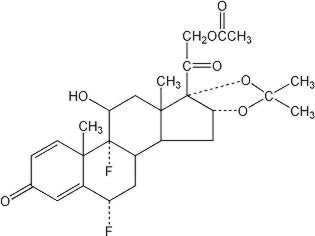
Lidex Ungüento contiene fluocinonide 0.5 mg / g en una base de ungüento especialmente formulada que consiste en monoestearato de glicerilo, vaselina blanca, carbonato de propileno, propilenglicol y cera blanca. Proporciona los efectos oclusivos y emolientes deseables en una pomada.
En esta formulación, el ingrediente activo está totalmente en solución.
Lidex-Farmacología clínica
Los corticosteroides tópicos comparten acciones antiinflamatorias, anti pruriginosas y vasoconstrictoras.
El mecanismo de la actividad antiinflamatoria de los corticosteroides tópicos no está claro. Se utilizan varios métodos de laboratorio, incluidos los ensayos vasoconstrictores, para comparar y predecir potencias y/o eficacia clínica de los corticosteroides tópicos. Hay alguna evidencia que sugiere que existe una correlación reconocible entre la potencia vasoconstrictora y la eficacia terapéutica en el hombre.
Farmacocinética
El grado de absorción percutánea de corticosteroides tópicos está determinado por muchos factores, incluidos el vehículo, la integridad de la barrera epidérmica y el uso de apósitos oclusivos.
Los corticosteroides tópicos se pueden absorber de la piel intacta normal. La inflamación y / u otros procesos de enfermedad en la piel aumentan la absorción percutánea. Los apósitos oclusivos aumentan sustancialmente la absorción percutánea de corticosteroides tópicos. Por lo tanto, los apósitos oclusivos pueden ser un complemento terapéutico valioso para el tratamiento de dermatosis resistentes (consulte DOSIFICACIÓN Y ADMINISTRACIÓN).
Una vez absorbidos a través de la piel, los corticosteroides tópicos se manejan a través de vías farmacocinéticas similares a los corticosteroides administrados sistémicamente. Los corticosteroides se unen a las proteínas plasmáticas en diversos grados. Los corticosteroides se metabolizan principalmente en el hígado y luego son excretados por los riñones. Algunos de los corticosteroides tópicos y sus metabolitos también se excretan en la bilis.
Indicaciones y uso de Lidex
El ungüento Lidex está indicado para el alivio de las manifestaciones inflamatorias y pruriginosas de dermatosis con respuesta a corticosteroides.
Contraindicaciones
Los corticosteroides tópicos están contraindicados en aquellos pacientes con antecedentes de hipersensibilidad a cualquiera de los componentes del preparado.
Precauciones
General
La absorción sistémica de corticosteroides tópicos ha producido supresión reversible del eje hipotalámico-hipofisario-suprarrenal (HPA), manifestaciones del síndrome de Cushing, hiperglucemia y glucosuria en algunos pacientes.
Las condiciones que aumentan la absorción sistémica incluyen la aplicación de esteroides más potentes, el uso en grandes superficies, el uso prolongado y la adición de apósitos oclusivos.
Por lo tanto, los pacientes que reciben una dosis grande de un esteroide tópico potente aplicado en una gran superficie o bajo un apósito oclusivo deben ser evaluados periódicamente para detectar evidencia de supresión del eje HPA mediante el uso de pruebas de estimulación de cortisol libre urinario y ACTH. Si se observa supresión del eje HPA, se debe intentar retirar el medicamento, reducir la frecuencia de aplicación o sustituir un esteroide menos potente.
La recuperación de la función del eje HPA generalmente es rápida y completa tras la interrupción del medicamento. Con poca frecuencia, pueden aparecer signos y síntomas de abstinencia de esteroides, que requieren corticosteroides sistémicos suplementarios.
Los niños pueden absorber cantidades proporcionalmente mayores de corticosteroides tópicos y, por lo tanto, ser más susceptibles a la toxicidad sistémica (consulte PRECAUCIONES – Uso pediátrico). Si se produce irritación, se debe interrumpir el tratamiento con corticosteroides tópicos e instituir el tratamiento adecuado.
Como con cualquier producto corticosteroide tópico, el uso prolongado puede producir atrofia de la piel y de los tejidos subcutáneos. Cuando se usa en áreas intertriginosas o flexoras, o en la cara, esto puede ocurrir incluso con un uso a corto plazo.
En presencia de infecciones dermatológicas, se debe instituir el uso de un agente antimicótico o antibacteriano adecuado. Si no se produce rápidamente una respuesta favorable, se debe interrumpir el tratamiento con corticosteroides hasta que la infección se haya controlado adecuadamente.
Información para el Paciente
Los pacientes que usan corticosteroides tópicos deben recibir la siguiente información e instrucciones:
- Este medicamento debe usarse según las indicaciones del médico. Es solo para uso externo. Evite el contacto con los ojos.
- Se debe aconsejar a los pacientes que no usen este medicamento para ningún trastorno que no sea para el que se recetó.
- El área de la piel tratada no debe vendarse ni cubrirse o envolverse de otro modo para que sea oclusiva a menos que lo indique el médico.
- Los pacientes deben notificar cualquier signo de reacciones adversas locales, especialmente bajo apósito oclusivo.
- Se debe aconsejar a los padres de pacientes pediátricos que no usen pañales ajustados o pantalones de plástico en un niño que esté siendo tratado en el área del pañal, ya que estas prendas pueden constituir vendajes oclusivos.
Pruebas de laboratorio
Las siguientes pruebas pueden ser útiles para evaluar la supresión del eje HPA:
Prueba de cortisol libre en orina
Prueba de estimulación de ACTH
Carcinogénesis, Mutagénesis y Deterioro de la fertilidad
No se han realizado estudios a largo plazo en animales para evaluar el potencial carcinogénico o el efecto sobre la fertilidad de los corticosteroides tópicos.
Los estudios para determinar la mutagenicidad con prednisolona e hidrocortisona han revelado resultados negativos.
Los corticosteroides de categoría C
Durante el embarazo son generalmente teratogénicos en animales de laboratorio cuando se administran sistémicamente a dosis relativamente bajas. Los corticosteroides más potentes han demostrado ser teratogénicos después de la aplicación cutánea en animales de laboratorio. No hay estudios adecuados y bien controlados en mujeres embarazadas sobre los efectos teratogénicos de los corticosteroides aplicados por vía tópica. Por lo tanto, los corticosteroides tópicos se deben usar durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto. Los medicamentos de esta clase no deben usarse ampliamente en pacientes embarazadas, en grandes cantidades o por períodos prolongados de tiempo.
Madres lactantes
Se desconoce si la administración tópica de corticosteroides podría producir una absorción sistémica suficiente para producir cantidades detectables en la leche materna. Los corticosteroides administrados sistémicamente se secretan en la leche materna en cantidades que no es probable que tengan un efecto perjudicial en el lactante. Sin embargo, se debe tener precaución cuando se administran corticosteroides tópicos a una mujer en periodo de lactancia.
Uso pediátrico
Los pacientes pediátricos pueden mostrar una mayor susceptibilidad a la supresión del eje hipotálamo-hipofisario-suprarrenal (HPA) inducida por corticosteroides tópicos y al síndrome de Cushing que los pacientes maduros debido a una mayor proporción del área de superficie de la piel con el peso corporal.
Se ha notificado supresión del eje HPA, síndrome de Cushing e hipertensión intracraneal en niños que reciben corticosteroides tópicos. Las manifestaciones de supresión suprarrenal en niños incluyen retraso del crecimiento lineal, aumento de peso retrasado, niveles bajos de cortisol en plasma y ausencia de respuesta a la estimulación de ACTH. Las manifestaciones de hipertensión intracraneal incluyen fontanelas abultadas, dolores de cabeza y papiledema bilateral.
La administración de corticosteroides tópicos a niños debe limitarse a la menor cantidad compatible con un régimen terapéutico eficaz. La terapia crónica con corticosteroides puede interferir con el crecimiento y el desarrollo de los niños.
Reacciones adversas
Las siguientes reacciones adversas locales se notifican con poca frecuencia con corticosteroides tópicos, pero pueden ocurrir con mayor frecuencia con el uso de apósitos oclusivos. Estas reacciones se enumeran en un orden decreciente aproximado de aparición:
| Burning | Perioral dermatitis |
| Itching | Allergic contact dermatitis |
| Irritation | Maceration of the skin |
| Dryness | Secondary infection |
| Folliculitis | Skin atrophy |
| Hypertrichosis | Striae |
| Acneiform eruptions | Miliaria |
| Hypopigmentation |
Overdosage
Topically applied corticosteroids can be absorbed in sufficient amounts to produce systemic effects (see PRECAUTIONS).
Dosis y administración de Lidex
El ungüento de Lidex se aplica generalmente en la zona afectada como una película delgada de dos a cuatro veces al día, dependiendo de la gravedad de la afección.
Los apósitos oclusivos se pueden utilizar para el tratamiento de la psoriasis o afecciones recalcitrantes.
Si se desarrolla una infección, se debe interrumpir el uso de los apósitos oclusivos e instituir el tratamiento antimicrobiano adecuado.
Cómo se suministra Lidex
Pomada Lidex® (fluocinónida) 0.05% se suministra en
15 g Tubo –NDC 99207-514-13
30 g de Tubo –NDC 99207-514-14
60 g Tubo –NDC 99207-514-17
120 g Tubo –NDC 99207-514-22
Guarde a temperatura ambiente. Evite temperaturas superiores a 30 ° C (86°F).
Patente estadounidense No. 4,017,615
Fabricado para:
MEDICIS, The Dermatology Company®
Scottsdale, AZ 85258
por: Patheon, Inc.
Mississauga, Ontario
Canada L5N 7K9
IN-5070/S
| Lidex fluocinonide ointment |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Labeler – MEDICIS
Frequently asked questions
- Is it used for hair loss?
- What is a substitute for fluocinonide cream?
- Is fluocinonide an antifungal cream?
- How long should you use fluocinonide for?
- What is fluocinonide cream good for?
- ¿Se puede usar fluocinonida para tratar una erupción por hiedra venenosa?
- Es un esteroide?
- ¿Es un antibiótico?
Más información sobre Lidex (fluocinonida tópica)
- Efectos secundarios
- Durante el embarazo o la lactancia
- Información de dosis
- Interacciones con medicamentos
- 8 Opiniones
- Disponibilidad genérica
- Clase de medicamentos: esteroides tópicos
Recursos para el consumidor
- Lectura avanzada
- Lidex Suave (Lectura Avanzada)
- Lidex Regular (Lectura Avanzada)
Recursos profesionales
- Información de prescripción
- Solución tópica Lidex (FDA)
- Gel Lidex (FDA)
Otras marcas, Lidex-E
Guías de tratamiento relacionadas
- Dermatitis atópica
- Eccema
- Dermatitis
- Psoriasis
Descargo de responsabilidad médico