Hitta källor:” Single bond ” – Nyheter · tidningar · böcker · scholar · JSTOR (augusti 2012) (lär dig hur och när du ska ta bort detta mallmeddelande)
i kemi är en enda bindning en kemisk bindning mellan två atomer som involverar två valenselektroner. Det vill säga atomerna delar ett par elektroner där bindningen bildas. Därför är en enda bindning en typ av kovalent bindning. När de delas är var och en av de två involverade elektronerna inte längre i den enda besittning av orbitalen där den härstammar. Snarare spenderar båda de två elektronerna tid i någon av orbitalerna som överlappar varandra i bindningsprocessen. Som en Lewis-struktur betecknas en enda bindning som en Cuba eller A-A, för vilken A representerar ett element (Moore, Stanitski och Jurs 329). I den första återgivningen representerar varje punkt en delad elektron, och i den andra återgivningen representerar stången båda elektronerna som delas i singelbindningen.

en kovalent bindning kan också vara en dubbelbindning eller en trippelbindning. En enda bindning är svagare än antingen en dubbelbindning eller en trippelbindning. Denna skillnad i styrka kan förklaras genom att undersöka komponentbindningarna som var och en av dessa typer av kovalenta bindningar består av (Moore, Stanitski och Jurs 393).
vanligtvis är en enda bindning en sigma-bindning. Ett undantag är bindningen i diboron, som är en pi-bindning. Däremot består dubbelbindningen av en sigma-bindning och en pi-bindning, och en trippelbindning består av en sigma-bindning och två pi-obligationer (Moore, Stanitski och Jurs 396). Antalet komponentbindningar är det som bestämmer styrkans skillnad. Det är självklart att singelbindningen är den svagaste av de tre eftersom den bara består av en sigma-bindning, och dubbelbindningen eller trippelbindningen består inte bara av denna typ av komponentbindning utan också minst en ytterligare bindning.
singelbindningen har kapacitet för rotation, en egenskap som inte ägs av dubbelbindningen eller trippelbindningen. Strukturen hos pi-obligationer tillåter inte rotation (åtminstone inte vid 298 K), så dubbelbindningen och trippelbindningen som innehåller pi-obligationer hålls på grund av denna egenskap. Sigma-bindningen är inte så restriktiv, och singelbindningen kan rotera med Sigma-bindningen som rotationsaxeln (Moore, Stanitski och Jurs 396-397).
en annan egenskap jämförelse kan göras i bond längd. Enkelbindningar är den längsta av de tre typerna av kovalenta bindningar eftersom interatomisk attraktion är större i de två andra typerna, dubbel och trippel. Ökningen av komponentbindningar är orsaken till denna attraktionsökning eftersom fler elektroner delas mellan de bundna atomerna (Moore, Stanitski och Jurs 343).
enstaka bindningar ses ofta i diatomiska molekyler. Exempel på denna användning av enskilda bindningar inkluderar H2, F2 och HCl.
enstaka bindningar ses också i molekyler som består av mer än två atomer. Exempel på denna användning av enkelbindningar inkluderar:
- båda bindningarna i H2O
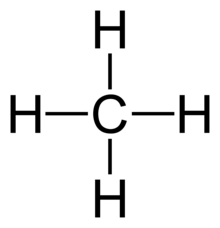
- Alla 4 bindningar i CH4
enkelbindning förekommer även i molekyler så komplexa som kolväten större än metan. Typen av kovalent bindning i kolväten är extremt viktig i nomenklaturen för dessa molekyler. Kolväten som endast innehåller enkelbindningar kallas alkaner (Moore, Stanitski och Jurs 334). Namnen på specifika molekyler som tillhör denna grupp slutar med suffixet-ane. Exempel inkluderar etan, 2-metylbutan och cyklopentan (Moore, Stanitski och Jurs 335).