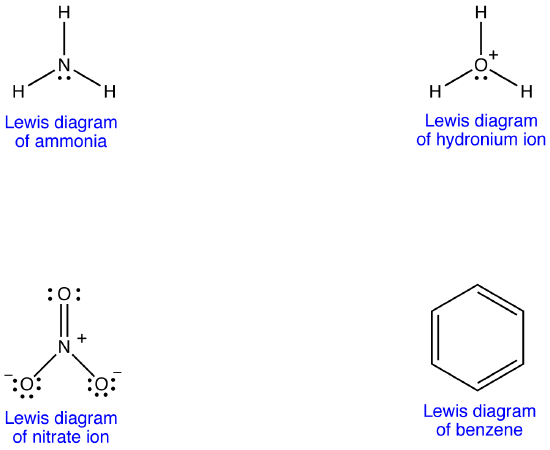
Lewis-diagrammet för många en molekyl överensstämmer emellertid inte med molekylens observerade egenskaper.
exempel 1: Nitratjon
nitratjonen har enligt sitt Lewis-diagram två typer av kväve-syrebindningar, en dubbelbindning och två enkelbindningar, vilket tyder på att en kväve-syrebindning i nitratjonen är kortare och starkare än var och en av de andra två. Lewis-strukturen innebär också, med avseende på formell laddning, att det finns två typer av syreatomer i nitratjonen, en formellt neutral och var och en av de andra två med en formell laddning av -1. Experimentellt har emellertid de tre kväve-syrebindningarna i nitratjonen samma bindningslängd och samma bindningsenergi, och de tre syreatomerna är oskiljbara. Lewis-diagrammet förklarar inte strukturen och bindningen av nitratjonen tillfredsställande.
två ytterligare Lewis-diagram kan ritas för nitratjonen.
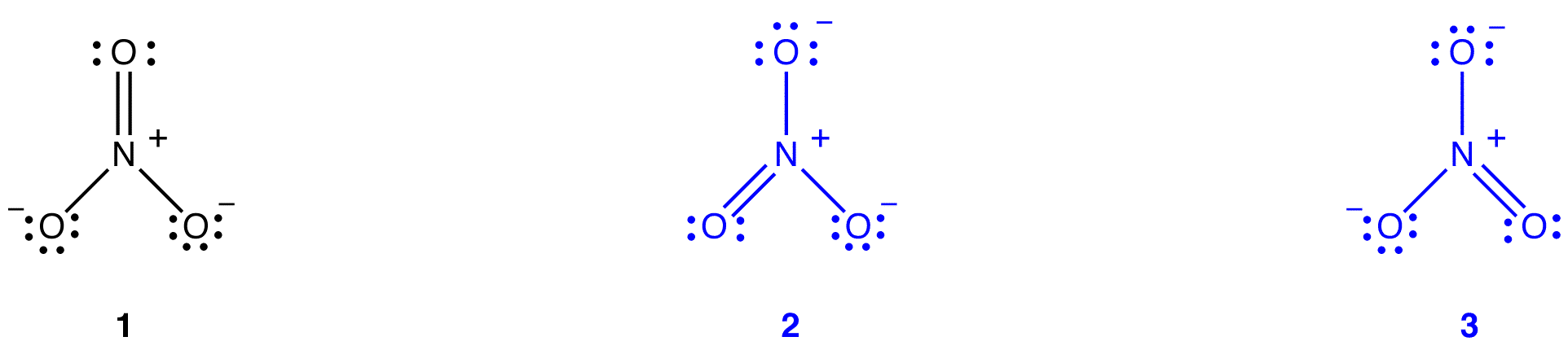
ingen av dem överensstämmer dock med nitratjonens observerade egenskaper och avbildar därför inte nitratjonen korrekt.
exempel 2: Bensen
Bensen har enligt Lewis-diagrammet två typer av kol-kolbindningar, tre dubbelbindningar och tre enkelbindningar, vilket tyder på att var och en av tre kol-kolbindningar i bensen är kortare och starkare än var och en av de andra tre. Experimentellt har emellertid de sex kol-kolbindningarna i bensen samma bindningslängd och samma bindningsenergi. Lewis-diagrammet förklarar inte strukturen och bindningen av bensen tillfredsställande.
ett attribut av molekyler som det klassiska Lewis-diagrammet inte överensstämmer med de observerade egenskaperna är att andra giltiga Lewis-diagram kan genereras för dem. Ett ytterligare Lewis-diagram kan ritas för bensen.

ingen av dem överensstämmer dock med bensens observerade egenskaper och visar därför inte korrekt bensen.
Resonansteori är ett försök att förklara strukturen hos en art, som nitratjonen eller bensen, inget Lewis-diagram som överensstämmer med artens observerade egenskaper. Den stora fördelen med resonansteori är att, även om den bygger på rigorös matematisk analys, resonansteori kan tillämpas framgångsrikt åberopar liten eller ingen matematik. Resonansteori förklaras nedan med nitratjonen som exempel.
enligt resonansteorin är strukturen hos nitratjonen inte 1 eller 2 eller 3 utan genomsnittet av alla tre, viktade av stabilitet. Lewis diagram 1, 2 och 3 kallas resonansformer, resonansstrukturer eller resonansbidragsgivare av nitratjonen. Strukturen hos nitratjonen sägs vara en resonanshybrid eller helt enkelt hybrid av resonansformer 1, 2 och 3. När det är nödvändigt att visa strukturen hos nitratjonen ritas resonansformer 1, 2 och 3, förbundna med dubbelhåriga pilar.
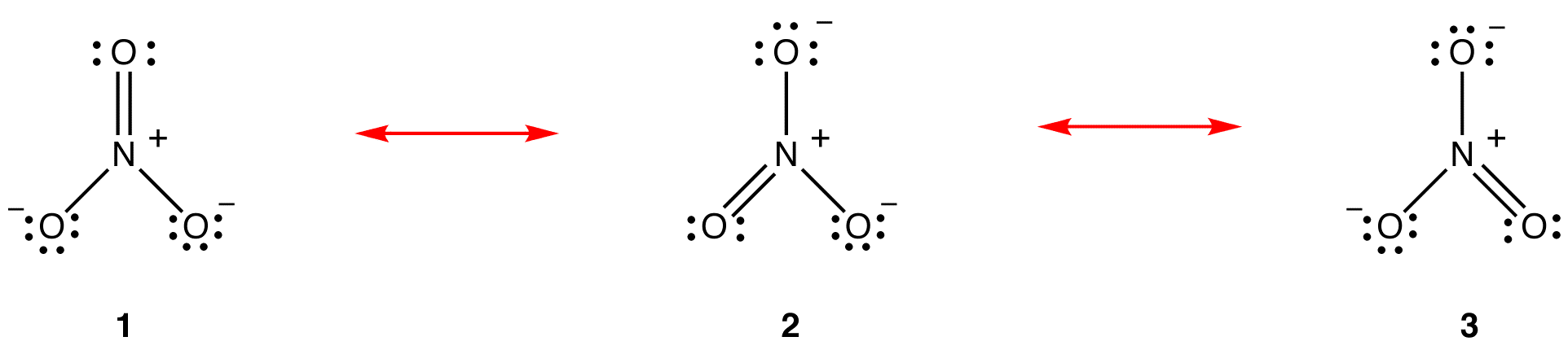
de tre resonansformerna av nitratjonen, 1, 2 och 3, är identiska, så de har samma stabilitet och bidrar därför lika till hybriden. Eftersom den exakta utsträckning i vilken varje resonansform av nitratjonen bidrar till hybriden är känd, bindningsordningen för varje kväve-syrebindning såväl som den formella laddningen på varje syreatom i hybriden kan lätt bestämmas:
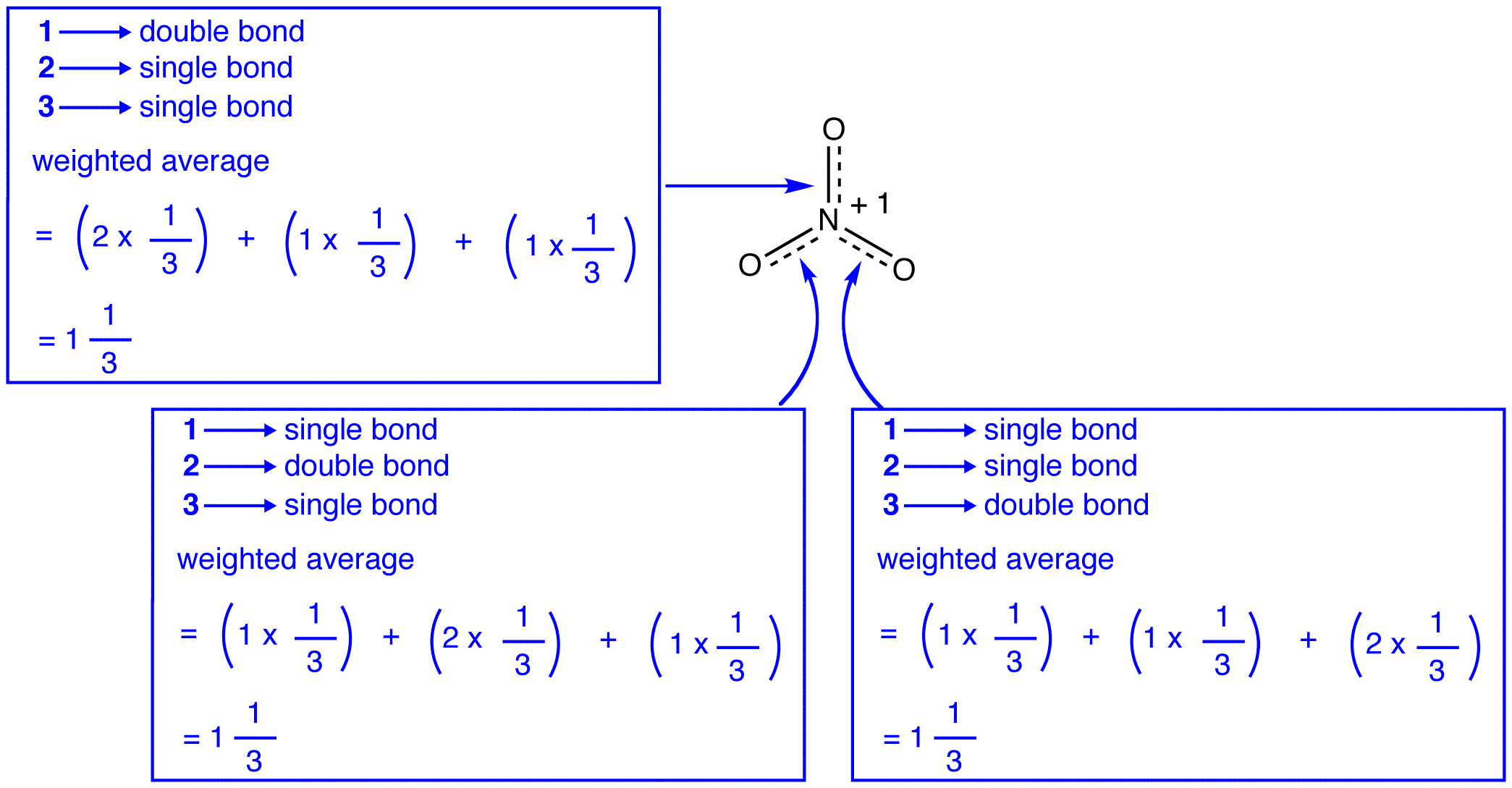
enligt resonansteori är varje bindning i nitratjonen en och en tredjedel av en bindning, vilket överensstämmer med observationen att de tre bindningarna i nitratjonen har samma bindningslängd och samma bindningsenergi.
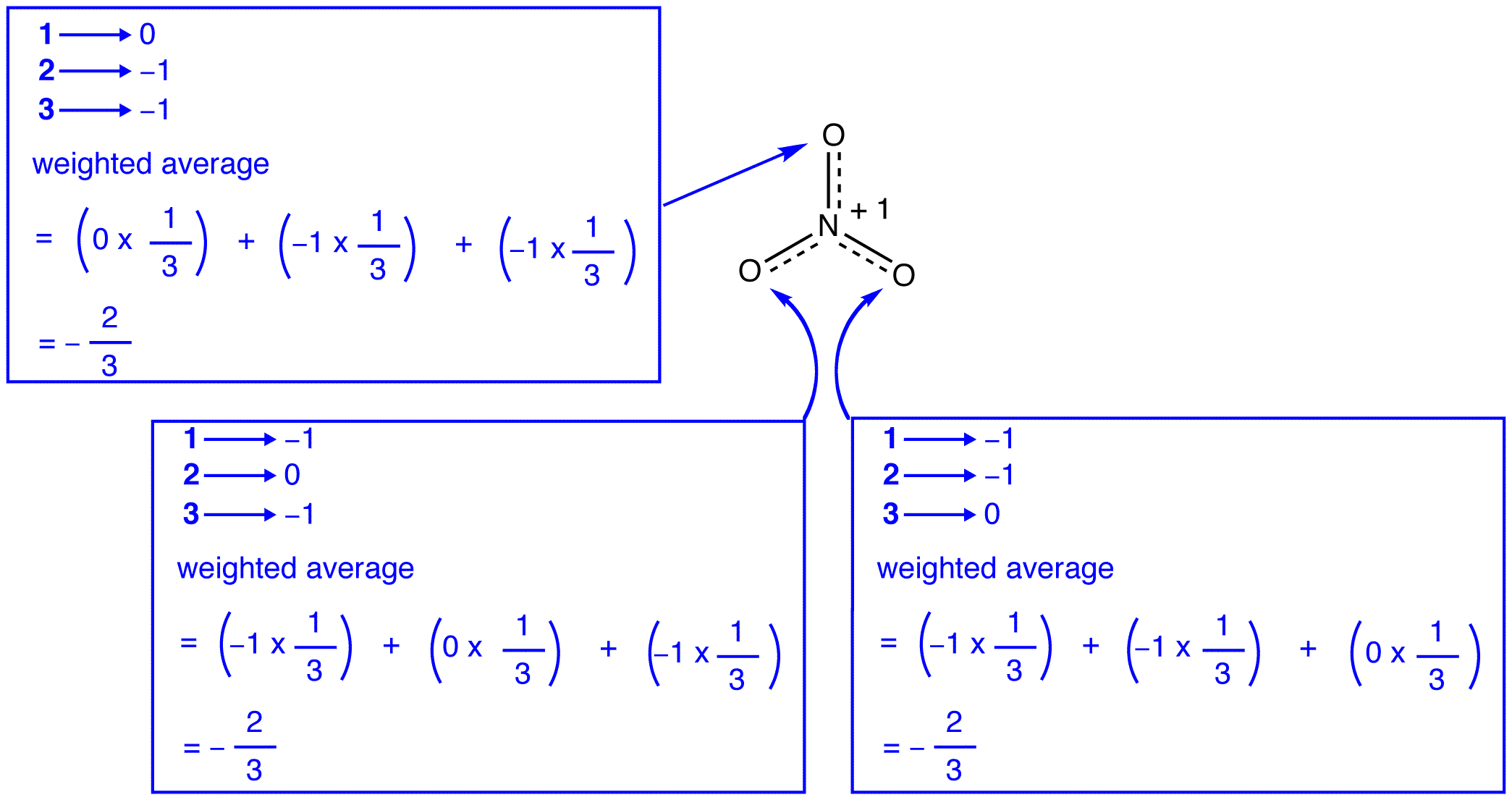
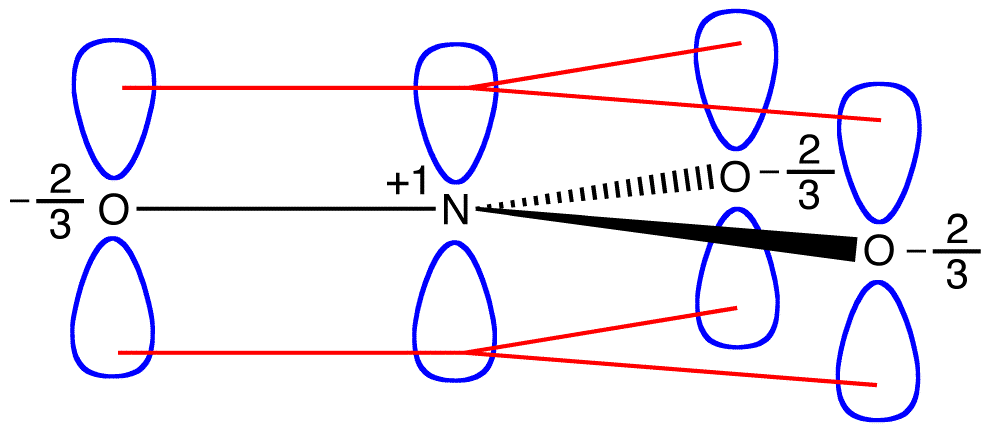
enligt resonansteori har varje syreatom i nitratjonen en formell laddning på -2/3, som i samband med det faktum att de tre kväve-syrebindningarna är identiska överensstämmer med observationen att de tre syreatomerna i nitratjonen är oskiljbara.
i varje resonansform av nitratjonen finns det två pi-elektroner, och de delas endast av två atomer. En elektron som endast delas av två atomer sägs vara lokaliserad. Således lokaliseras de två pi-elektronerna i varje resonansform av nitratjonen. Nitratjonen, som representeras av hybriden, har två pi-elektroner:
# elektroner i en pi-bindning = 2
# elektroner i en tredjedel av en pi-bindning = 2/3
# elektroner i tre av dem = 3 x (2/3) = 2
de två pi-elektronerna i nitratjonen delas av totalt fyra atomer, en kväveatom och tre syreatomer. En elektron som delas av mer än två atomer sägs vara delokaliserad. Således delokaliseras de två pi-elektronerna i nitratjonen. Delokalisering av PI-elektroner i nitratjonen kräver att de fyra atomerna är på samma plan, vilket möjliggör lateral överlappning av p-orbitalerna på dem.
om nitratjonens energi var det viktade genomsnittet av energierna i dess tre resonansformer, precis som nitratjonens struktur är det viktade genomsnittet av strukturerna i dess tre resonansformer, bör det vara lika med energin i en av de tre identiska resonansformerna:
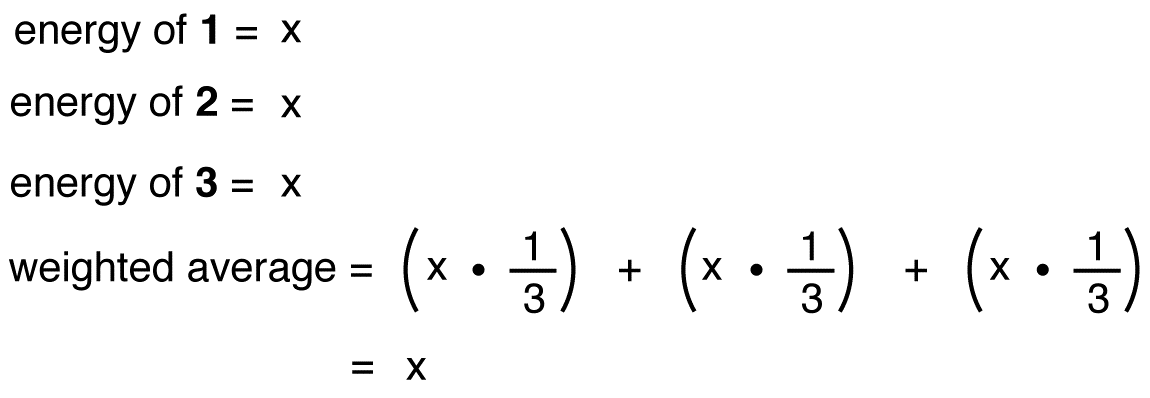
om hybridens energi var lika med den för en resonansform, med tanke på att alla kemiska enheter (elementära partiklar, atomer, molekyler etc.) naturligtvis tenderar att vara i lägsta möjliga energitillstånd, det skulle inte finnas någon fördel för nitratjonen att existera som hybrid; det kan helt enkelt existera som en resonansform. Eftersom nitratjonen existerar som hybrid, inte som en resonansform, kan man dra slutsatsen att hybridens energi är lägre än för någon av resonansformerna.
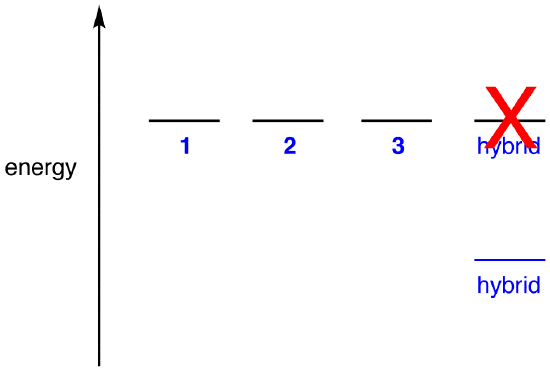
enligt resonansteori är energin hos en molekyl lägre än den för den lägsta energiresonansformen. Eftersom nitratjonen har lägre energi och därför är stabilare än någon av dess resonansformer, sägs nitratjonen vara resonansstabiliserad.
det finns två missuppfattningar om resonansteori bland nybörjare, troligen på grund av bokstavlig tolkning av ordet resonans. De beskrivs nedan med nitratjonen som exempel.
missuppfattning 1: Nitratjonen existerar som resonansform 1 för ett ögonblick och ändras sedan antingen till resonansform 2 eller till resonansform 3, som interkonverterar eller återgår till 1.
strukturen för nitratjonen är inte 1 eller 2 eller 3 utan hybriden och förändras inte med tiden om inte en reaktion genomgår.
missuppfattning 2: i ett prov av nitratjoner finns vid ett givet ögonblick en tredjedel av jonerna som resonansform 1, en annan tredjedel som resonansform 2 och den återstående en tredjedel som resonansform 3.
i ett prov av nitratjoner, vid ett givet ögonblick, har alla joner samma struktur, som är hybriden.
den klassiska analogin som används för att klargöra dessa två missuppfattningar är mule (Morrison, rt; Boyd, RN organisk kemi, femte upplagan; Allyn och Bacon: Boston, 1987, pg. 373). Biologiskt är en mule en hybrid av en häst och en åsna. Detta betyder inte att en mule liknar en häst för ett ögonblick och sedan ändras för att likna en åsna. Utseendet på en mule är en kombination av en häst och en åsna och förändras inte med tiden. Det betyder inte heller att vissa mulor i en besättning liknar en häst och de andra en åsna. I en besättning har alla mulor samma utseende, vilket är en kombination av en häst och en åsna. Svagheten i denna analogi är att hästar och åsnor existerar, medan resonansformer är strikt hypotetiska. En bättre analogi, citerad i Morrison och Boyd, är noshörningen. När man ser en noshörning kan man beskriva den som hybrid av en drake och en enhörning, två varelser som inte existerar.
regler för ritning av resonansformer
1. Resonansformer är Lewis-diagram, som är baserade på valensbindningsteori.De måste därför följa de grundläggande reglerna för Valens bond theory. Således kan väte inte ha mer än två valenselektroner; Period-två element kan inte ha mer än åtta valenselektroner; element i Period tre och under kan ha mer än åtta valenselektroner. T. ex.: i varje resonansform av nitratjonen finns det två element, kväve och syre, som är Period-två element. I ingen av nitratjonens resonansformer finns det mer än åtta valenselektroner på någon av atomerna.
2. Alla resonansformer måste ha samma Sigma-bindningsram, som endast skiljer sig åt i placeringen av pi-elektroner och icke-bundna valenselektroner. T. ex.: alla tre resonansformer av nitratjonen har samma Sigma-bindningsram:
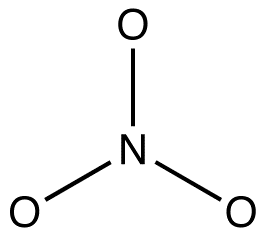
de skiljer sig från varandra endast på platserna för pi-elektroner och ensamma par.
organiska kemister bryter alltmer mot denna regel för att förklara strukturerna hos reaktiva mellanprodukter som resonansstabiliserade arter. eg: oxymercuration
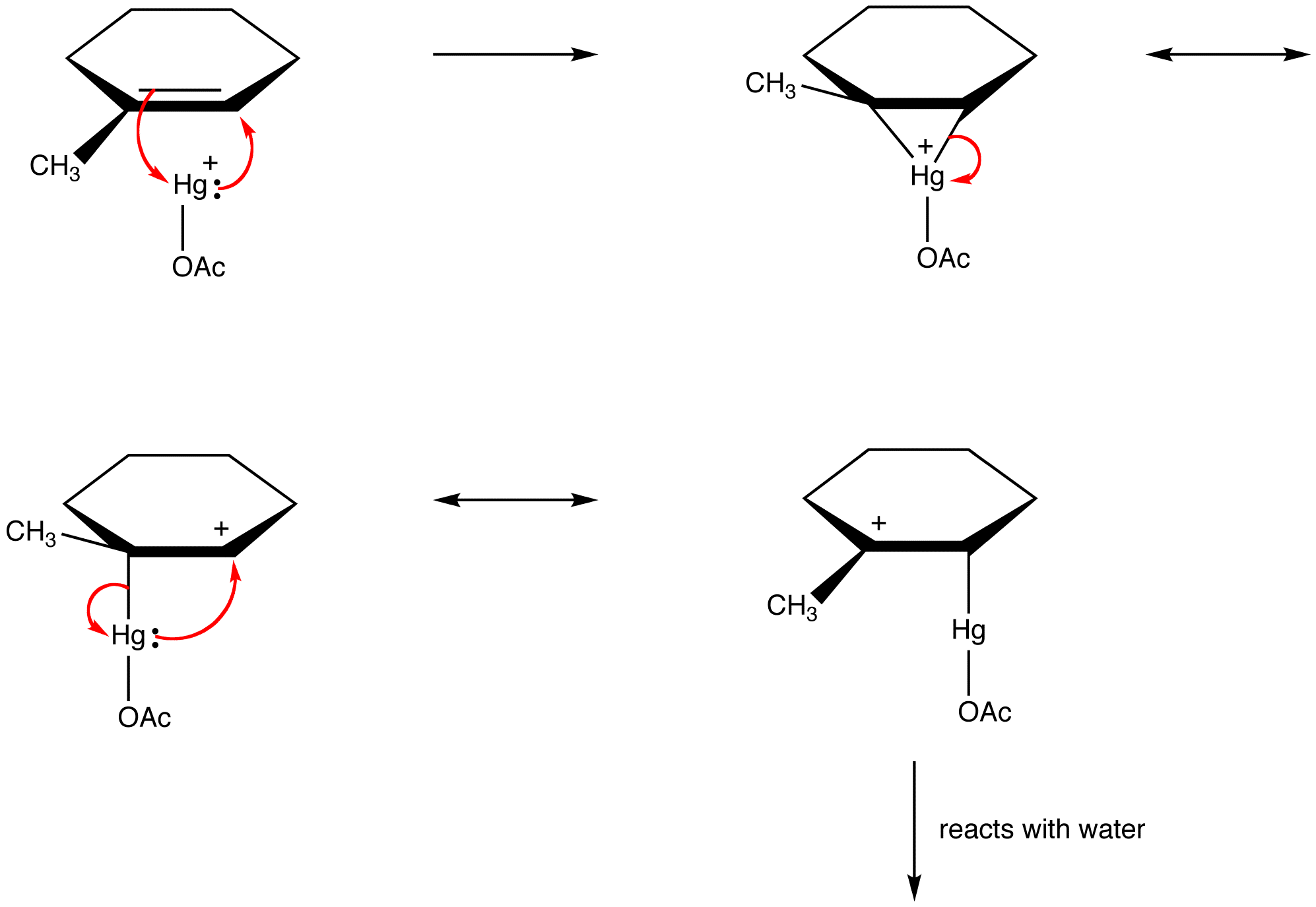
bestämning av relativt bidrag av resonansformer till Hybriden
de tre formerna av nitratjonen är identiska och har därför samma stabilitet. Följaktligen bidrar de lika till hybriden. Resonansformerna för de flesta resonansstabiliserade molekyler skiljer sig från varandra, så de bidrar inte lika till hybriden. Ju mer stabil resonansformen desto mer bidrar den till hybriden. Således kräver bestämningen av relativa bidrag eller resonansformer till hybriden bestämningen av deras relativa stabilitet. Använd följande regler för att bestämma den relativa stabiliteten hos resonansformer.
regel 1:
En resonansform där alla atomer har en oktett av valenselektroner är stabilare än en där minst en atom inte gör det. eg:
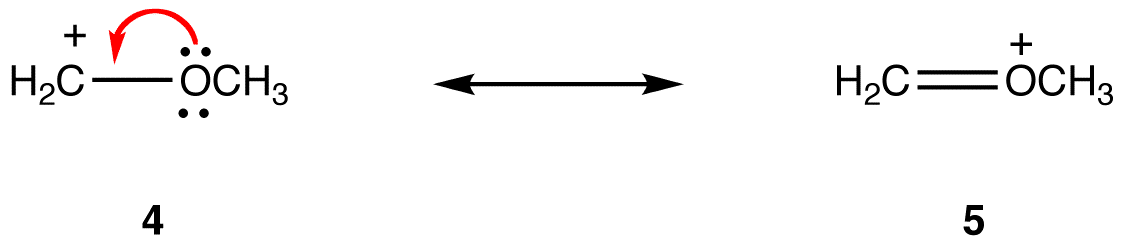
i resonansform 5 har alla atomer en oktett av valenselektroner; i 4, en atom, kolatomen som bär den formella laddningen av +1, Gör det inte. Således är resonansform 5 stabilare än resonansform 4.
regel 2:
allt annat är lika, en resonansform som har en formell negativ laddning på en mer elektronegativ atom är stabilare än en som har en formell negativ laddning på en mindre elektronegativ atom. eg:
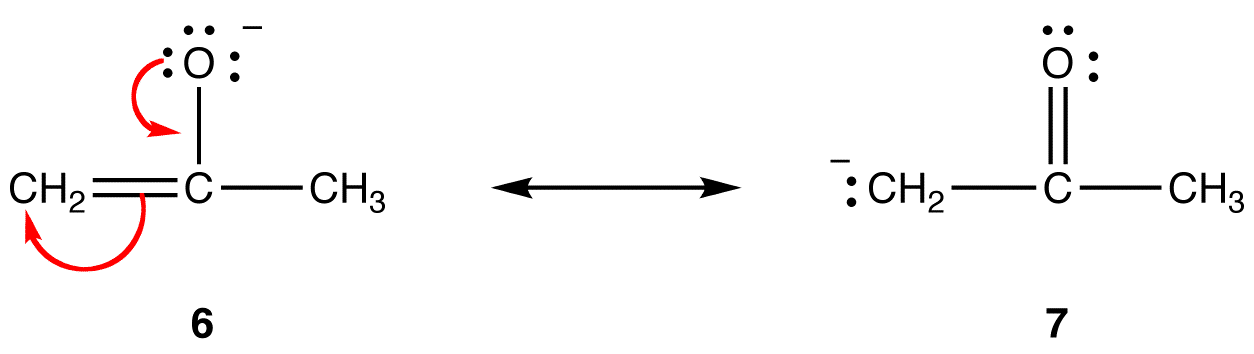
i resonansform 6 är den formella negativa laddningen på en syreatom; i 7 är den på en kolatom. Syre är mer elektronegativt än kol. Således är resonansform 6 stabilare än resonansform 7.
trenden är motsatt när det gäller formella positiva avgifter. Allt annat är lika, en resonansform som har en formell positiv laddning på en mindre elektronegativ atom är stabilare än en som har en formell positiv laddning på en mer elektronegativ atom. eg:
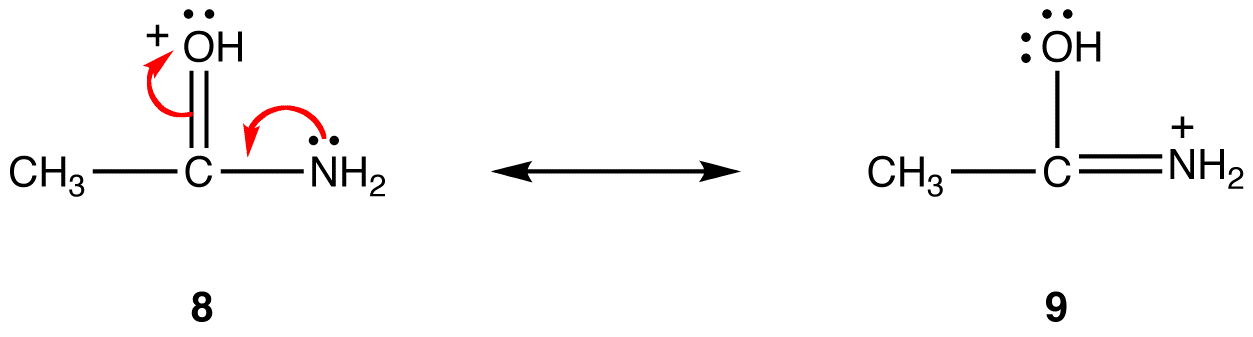
i resonansform 8 är den formella positiva laddningen på en syreatom; i 9 är den på en kväveatom. Kväve är mindre elektronegativ än syre, sålunda är resonansform 9 stabilare än resonansform 8.
regel 3:
allt annat är lika, en resonansform som inte har en laddningsseparation, kallad en dipolär resonansform, är stabilare än en som gör det. T. ex.:
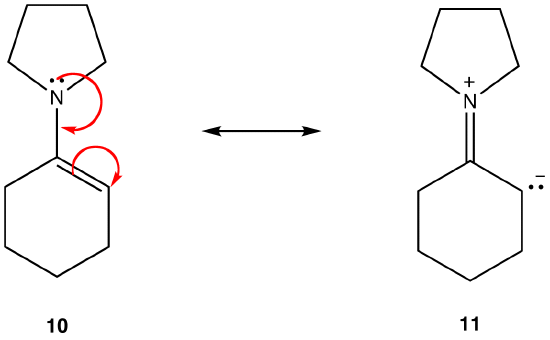
Resonansform 11 är en dipolär resonansform; 10 är inte. Således är 10 stabilare än 11. Denna regel är en följd av vektorformen av Coloumbs lag, enligt vilken motsatta avgifter lockar. Följden är att för att hålla motsatta laddningar separerade krävs energi, vilket innebär att 11 har högre energi än 10, Så 10 är stabilare än 11.
Regel 4:
i dipolära resonansformer, allt annat lika, ju större avståndet mellan separerade laddningar desto stabilare resonansformen. T. ex.:
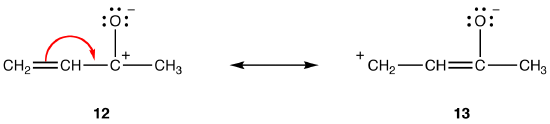
både resonansformer 12 och 13 är dipolära resonansformer. Avståndet mellan de separerade laddningarna är större i 13 (tre bindningar) än i 12 (en bindning), så 13 är stabilare än 12. Denna regel är en följd av den skalära formen av Coloumbs lag, som säger att den attraktiva kraften mellan motsatta laddningar är omvänt proportionell mot kvadraten på avståndet mellan dem. Således är den energi som krävs för att hålla motsatta laddningar separerade i 12 högre än i 13, vilket innebär att 12 har högre energi än 13, så 13 är stabilare än 12.
ovanstående regler gäller kanske inte resonans som involverar element i Period tre och under, på grund av deras förmåga att rymma mer än åtta elektroner i valensskalet. eg:
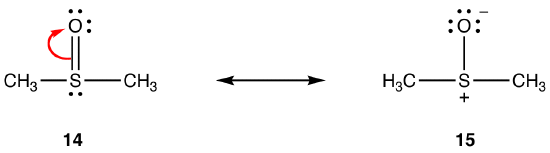
dubbelbindningen i 14 består av en sigmabindning och en bindning bildad av överlappningen av en 2P-orbital, med två elektroner, i syreatomen och en tom 3D-orbital i svavelatomen. Dessa två orbitaler har mycket olika energier, storlekar och former, så överlappningen mellan dem, känd som en pn–dn-interaktion, är svag. Följaktligen finns det liten dubbelbindningskaraktär i svavel-syrebindningen i hybriden, dvs 15 är den huvudsakliga resonansformen.
bidragsgivare och attribut
- Gamini Gunawardena från Okempal-webbplatsen (Utah Valley University)