egenskaper hos kovalenta föreningar
när vi pratade om fasta joniska föreningar i joniska föreningar fann vi att deras egenskaper ofta härrör från den starka attraktionen av motsatta elektriska laddningar. Det bör inte komma som en överraskning att finna att egenskaperna hos kovalenta föreningar är till stor del på grund av arten av kovalenta bindningar.
en av de viktigaste sakerna att komma ihåg om kovalenta föreningar är att de inte är joniska. Detta verkar uppenbart, men skillnaden är faktiskt subtilare än du kanske tror. För att illustrera detta koncept, ta en titt på följande figur:
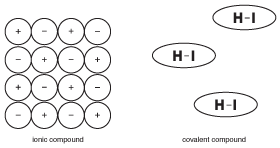
figur 9.5 egenskaperna hos fasta joniska föreningar är baserade på det faktum att många joner hålls fast på plats med elektriska krafter. Molekyler i kovalenta föreningar arbetar emellertid med relativt oberoende från angränsande molekyler.
till skillnad från joniska föreningar, där alla joner i en stor kristall hjälper till att hålla varandra ihop, hålls molekylerna i en kovalent förening samman av krafter som kallas ”intermolekylära krafter”, som är mycket svagare än kemiska bindningar (mer om intermolekylära krafter i fasta ämnen). Som ett resultat lockas molekylerna i en kovalent förening inte till varandra lika mycket som jonerna i joniska föreningar. Denna skillnad i struktur är viktig för att förstå egenskaperna hos kovalenta föreningar.
kovalenta föreningar har låga smält-och kokpunkter
som nämnts i joniska föreningar krävs en stor mängd energi för att smälta en jonisk förening på grund av de starka interaktionerna mellan katjonerna och anjonerna i en jonisk kristall. I kovalenta föreningar binds emellertid alla molekyler endast svagt till angränsande molekyler; därför tar det väldigt lite energi att separera kovalenta molekyler från varandra.
många nybörjare kemistudenter tror falskt att när en kovalent molekyl smälter bryts kovalenta bindningar. Detta är falskt. När joniska föreningar smälter misslyckas den joniska attraktionen. När kovalenta föreningar smälter drar molekylerna helt enkelt bort från varandra och lämnar bindningarna intakta.
kovalenta föreningar är dåliga ledare
joniska föreningar är stora ledare av elektricitet när de löses eller smälts. Som nämnts i joniska föreningar beror detta på att joniska föreningar har mobila joner som kan överföra elektrisk laddning från en plats till en annan. De leder också värme mycket bra eftersom jonerna är okej bredvid varandra, vilket gör det möjligt för energi att överföras effektivt från en plats till en annan.
kovalenta föreningar är å andra sidan nästan alltid bra isolatorer av både el och värme. Elektricitet kan inte leda effektivt genom kovalenta föreningar eftersom det inte finns några joner för att flytta den elektriska laddningen. Ett utmärkt exempel på detta är i ditt eget hus, där metallen i dina förlängningssladdar är täckt med plast för att undvika elektrokutering av din katt. Värme färdas inte heller bra genom kovalenta föreningar eftersom molekylerna inte hålls lika tätt mot varandra som jonerna i en jonisk förening, vilket gör värmeöverföringen mindre effektiv. Det är därför du använder ugnsvantar för att ta dina kakor ur ugnen istället för att belägga händerna med salt.
kovalenta föreningar brinner ibland
organiska föreningar är kovalenta föreningar som innehåller kol. De innehåller vanligtvis också väte. och kan innehålla mindre mängder andra element som kväve, svavel, fosfor, syre eller någon av halogenerna.
många kovalenta föreningar är brandfarliga och brinner lätt med tillsats av värme. Huvudgruppen av kovalenta föreningar som är brandfarliga kallas organiska föreningar. Organiska föreningar brinner eftersom de innehåller kol och väte, som båda kombinerar fint med syre vid höga temperaturer.
det är viktigt att komma ihåg att inte alla kovalenta föreningar brinner?till exempel är vatten en kovalent förening och du har mycket svårt att starta en eld med den. Men många fler kovalenta än joniska föreningar är brandfarliga.
brandfarlighet är en allmän egenskap hos kovalenta föreningar eftersom en stor majoritet av de kända kovalenta föreningarna är organiska. Eftersom de flesta organiska föreningar brinner, kan vi säkert lista detta som en egenskap hos kovalenta föreningar även om det finns många kovalenta föreningar som inte brinner.
utdrag ur den kompletta idiotens Guide till kemi 2003 av Ian Guch. Alla rättigheter förbehållna inklusive rätten till reproduktion helt eller delvis i någon form. Används enligt överenskommelse med Alpha Books, en medlem av Penguin Group (USA) Inc.
för att beställa denna bok direkt från förlaget, besök Penguin USA webbplats eller ring 1-800-253-6476. Du kan också köpa den här boken på Amazon.com och Barnes & Noble.