tillsats av väte till en kol-kol dubbelbindning kallas hydrogenering. Den totala effekten av ett sådant tillägg är det reduktiva avlägsnandet av dubbelbindningsfunktionella gruppen. Regioselektivitet är inte ett problem, eftersom samma grupp (en väteatom) är bunden till var och en av dubbelbindningskolvarna. Den enklaste källan till två väteatomer är molekylärt väte (H2), men blandning av alkener med väte resulterar inte i någon märkbar reaktion. Även om den totala hydrogeneringsreaktionen är exoterm, förhindrar en hög aktiveringsenergi att den äger rum under normala förhållanden. Denna begränsning kan kringgås genom användning av en katalysator, såsom visas i följande diagram.
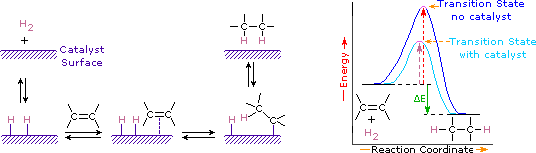
katalysatorer är ämnen som ändrar hastigheten (hastigheten) för en kemisk reaktion utan att konsumeras eller visas som en del av produkten. Katalysatorer verkar genom att sänka aktiveringsenergin för reaktioner, men de förändrar inte den relativa potentiella energin hos reaktanterna och produkterna. Finfördelade metaller, såsom platina, palladium och nickel, är bland de mest använda hydrogeneringskatalysatorerna. Katalytisk hydrogenering sker i minst två steg, som avbildas i diagrammet. Först måste Alken adsorberas på katalysatorns yta tillsammans med en del av väte. Därefter skiftar två väten från metallytan till kolet i dubbelbindningen, och det resulterande mättade kolvätet, som är svagare adsorberat, lämnar katalysatorytan. Den exakta naturen och tidpunkten för de senaste händelserna är inte väl förstådd.
som visas i energidiagrammet är hydrogeneringen av alkener exoterm, och värme frigörs motsvarande CI (färgad grön) i diagrammet. Denna reaktionsvärme kan användas för att utvärdera den termodynamiska stabiliteten hos alkener med olika antal alkylsubstituenter på dubbelbindningen. Följande tabell visar till exempel upphettningarna av hydrogenering för tre C5H10-alkener som ger samma alkanprodukt (2-metylbutan). Eftersom en stor reaktionsvärme indikerar en hög energireaktant är dessa värmer omvänt proportionella mot stabiliteten hos alkenisomererna. Till en grov approximation ser vi att varje alkylsubstituent på en dubbelbindning stabiliserar denna funktionella grupp med lite mer än 1 kcal/mol.
| Alkenisomer | (CH3)2CHCH=CH2 3-metyl-1-buten |
CH2=C(CH3)ch2ch3 2-metyl-1-buten |
(CH3)2C=chch3 2-metyl-2-buten |
|---|---|---|---|
| reaktionsvärme ( ubih-th )th-30,3 kcal/mol |
-28,5 kcal/mol | -26,9 kcal/mol |
från mekanismen som visas här förväntar vi oss att tillsatsen av väte ska ske med syn-STEREOSELEKTIVITET. Detta är ofta sant, men hydrogeneringskatalysatorerna kan också orsaka isomerisering av dubbelbindningen före vätetillsats, i vilket fall stereoselektivitet kan vara osäker.
bildandet av övergångsmetallkomplex med alkener har övertygande visats genom isolering av stabila platinakomplex såsom Zeises salt, K. H2O och etylenebis(trifenylfosfin)platina, 2PT(H2C=CH2). I det senare är platina trekoordinat och nollvalent, medan Zeises salt är ett derivat av platina(II). En modell av Zeises salt och en diskussion om den ovanliga bindningen i sådana komplex kan ses genom att klicka här. Liknande komplex har rapporterats för nickel och palladium, metaller som också fungerar som katalysatorer för alkenhydrogenering.
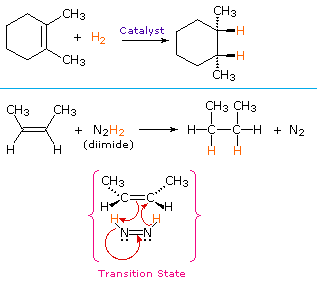
ett icke-katalytiskt förfarande för syn-tillsats av väte använder den instabila föreningen diimid, N2H2. Detta reagens måste genereras nyligen i reaktionssystemet, vanligtvis genom oxidation av hydrazin, och den starkt exoterma reaktionen gynnas av eliminering av kvävgas (en mycket stabil förening). Diimid kan existera som cis-transisomerer; endast cis-isomeren fungerar som ett reduktionsmedel. Exempel på alkenreduktioner genom båda procedurerna visas nedan.
bidragsgivare
- William Reusch, Professor Emeritus (Michigan State U.), virtuell lärobok för organisk kemi