inlärningsmål
i slutet av detta avsnitt kommer du att kunna:
- undersöka värmeöverföring.
- beräkna slutlig temperatur från värmeöverföring.
hittills har vi diskuterat temperaturförändring på grund av värmeöverföring. Ingen temperaturförändring sker från värmeöverföring om isen smälter och blir flytande vatten (dvs. under en fasförändring). Tänk till exempel på att vatten droppar från istappar som smälter på ett tak som värms av solen. Omvänt fryser vatten i en isbricka som kyls av omgivningar med lägre temperatur.

Figur 1. Värme från luften överförs till isen och får den att smälta. (kredit: Mike Brand)
energi krävs för att smälta ett fast ämne eftersom de sammanhängande bindningarna mellan molekylerna i det fasta ämnet måste brytas isär så att molekylerna i vätskan kan röra sig vid jämförbara kinetiska energier; således finns det ingen temperaturökning. På samma sätt behövs energi för att förånga en vätska, eftersom molekyler i en vätska interagerar med varandra via attraktiva krafter. Det finns ingen temperaturförändring förrän en fasförändring är klar. Temperaturen på en kopp läsk i början vid 0 UCCC stannar vid 0 UCCC tills all is har smält. Omvänt frigörs energi under frysning och kondensation, vanligtvis i form av termisk energi. Arbetet utförs av sammanhängande krafter när molekyler samlas. Motsvarande energi måste avges (spridas) för att de ska kunna hålla ihop Figur 2.
den energi som är involverad i en fasförändring beror på två huvudfaktorer: Antalet och styrkan hos bindningar eller kraftpar. Antalet bindningar är proportionellt mot antalet molekyler och därmed till provets massa. Styrkan av krafter beror på typen av molekyler. Värmen Q som krävs för att ändra fasen av ett prov av massa m ges av
Q = mLf (smältning/frysning,
Q = mLv (förångning/kondensation),
där den latenta värmen av fusion, Lf och latent förångningsvärme, Lv, är materialkonstanter som bestäms av experimentellt. Se (Tabell 1).

Figur 2. (a) energi krävs för att delvis övervinna de attraktiva krafterna mellan molekyler i ett fast ämne för att bilda en vätska. Samma energi måste tas bort för att frysning ska äga rum. (b) molekyler separeras av stora avstånd när de går från vätska till ånga, vilket kräver betydande energi för att övervinna molekylär attraktion. Samma energi måste tas bort för att kondens ska äga rum. Det finns ingen temperaturförändring förrän en fasförändring är klar.
Latent värme mäts i enheter av J / kg. Både Lf och Lv beror på ämnet, särskilt på styrkan hos dess molekylära krafter som noterats tidigare. Lf och Lv kallas kollektivt latenta värmekoefficienter. De är latenta eller dolda, för i fasförändringar kommer energi in i eller lämnar ett system utan att orsaka en temperaturförändring i systemet; så i själva verket är energin dold. Tabell 1 visar representativa värden för Lf och Lv, tillsammans med smält-och kokpunkter.
tabellen visar att betydande mängder energi är involverade i fasförändringar. Låt oss till exempel titta på hur mycket energi som behövs för att smälta ett kilo is vid 0 CCC för att producera ett kilo vatten vid 0 C. Med hjälp av ekvationen för en temperaturförändring och värdet för vatten från Tabell 1 finner vi att Q = mLf = (1.0 kg) (334 kJ/kg) = 334 kJ är energin att smälta ett kilo is. Det här är mycket energi eftersom det representerar samma mängd energi som behövs för att höja temperaturen på 1 kg flytande vatten från 0 OZCC till 79,8 OZCC. Ännu mer energi krävs för att förånga vatten; det skulle ta 2256 kJ för att byta 1 kg flytande vatten vid normal kokpunkt (100 CCC vid atmosfärstryck) till ånga (vattenånga). Detta exempel visar att energin för en fasförändring är enorm jämfört med energi i samband med temperaturförändringar utan fasförändring.
| Table 1. Heats of Fusion and Vaporization | ||||||
|---|---|---|---|---|---|---|
| Lf | Lv | |||||
| Substance | Melting point (ºC) | kJ/kg | kcal/kg | Boiling point (°C) | kJ/kg | kcal/kg |
| Helium | −269.7 | 5.23 | 1.25 | −268.9 | 20.9 | 4.99 |
| Hydrogen | −259.3 | 58.6 | 14.0 | −252.9 | 452 | 108 |
| Nitrogen | −210.0 | 25.5 | 6.09 | −195.8 | 201 | 48.0 |
| Oxygen | −218.8 | 13.8 | 3.30 | −183.0 | 213 | 50.9 |
| Ethanol | −114 | 104 | 24.9 | 78.3 | 854 | 204 |
| Ammonia | −75 | 108 | −33.4 | 1370 | 327 | |
| Mercury | −38.9 | 11.8 | 2.82 | 357 | 272 | 65.0 |
| Water | 0.00 | 334 | 79.8 | 100.0 | 2256 | 539 |
| Sulfur | 119 | 38.1 | 9.10 | 444.6 | 326 | 77.9 |
| Lead | 327 | 24.5 | 5.85 | 1750 | 871 | 208 |
| Antimony | 631 | 165 | 39.4 | 1440 | 561 | 134 |
| Aluminum | 660 | 380 | 90 | 2450 | 11400 | 2720 |
| Silver | 961 | 88.3 | 21.1 | 2193 | 2336 | 558 |
| Gold | 1063 | 64.5 | 15.4 | 2660 | 1578 | 377 |
| Copper | 1083 | 134 | 32.0 | 2595 | 5069 | 1211 |
| Uranium | 1133 | 84 | 20 | 3900 | 1900 | 454 |
| Tungsten | 3410 | 184 | 44 | 5900 | 4810 | 1150 |
Phase changes can have a tremendous stabilizing effect even on temperatures that are not near the melting and boiling points, because evaporation and condensation (conversion of a gas into a liquid state) occur even at temperatures below the boiling point. Ta till exempel det faktum att lufttemperaturerna i fuktiga klimat sällan går över 35,0 CCC, vilket beror på att de flesta värmeöverföringar går in i förångande vatten i luften. På samma sätt faller temperaturen i fuktigt väder sällan under daggpunkten eftersom enorm värme frigörs när vattenånga kondenserar.
Vi undersöker effekterna av fasförändring mer exakt genom att överväga att lägga till värme i ett prov av IS vid −20 OZCC (Figur 3). Isens temperatur stiger linjärt och absorberar värme med en konstant hastighet av 0,50 cal / g C. C. tills den når 0 C. C. C. En gång vid denna temperatur börjar isen smälta tills all is har smält och absorberar 79,8 Kal / g värme. Temperaturen förblir konstant vid 0 UCC under denna fasförändring. När all is har smält, stiger temperaturen på det flytande vattnet och absorberar värme med en ny konstant hastighet av 1,00 cal/g UCC. Vid 100 CCC börjar vattnet koka och temperaturen förblir konstant medan vattnet absorberar 539 cal/g värme under denna fasförändring. När all vätska har blivit ångånga, stiger temperaturen igen och absorberar värme med en hastighet av 0,482 cal/g UCC.
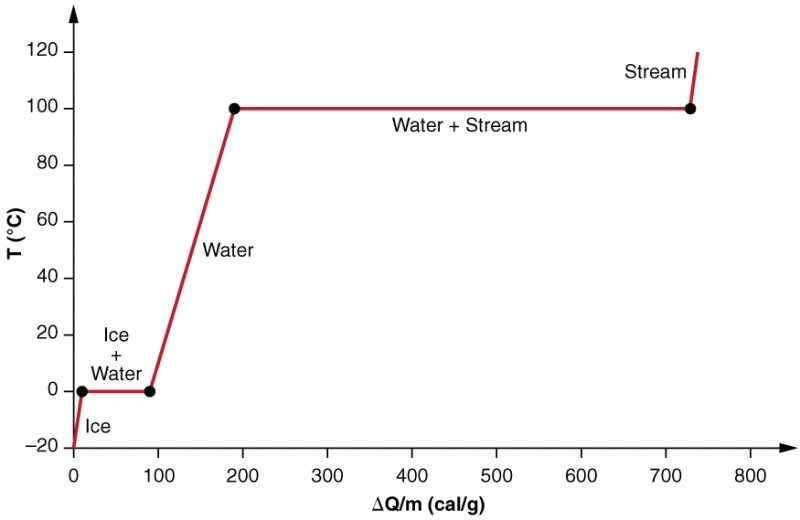
Figur 3. En graf över temperatur kontra energi tillsatt. Systemet är konstruerat så att ingen ånga avdunstar medan isen värms för att bli flytande vatten, och så att ångan förblir kvar i systemet när förångning sker. De långa sträckorna av konstanta temperaturvärden vid 0 OZCC och 100 SQCC återspeglar den stora latenta värmen av smältning respektive förångning.
vatten kan avdunsta vid temperaturer under kokpunkten. Mer energi krävs än vid kokpunkten, eftersom den kinetiska energin hos vattenmolekyler vid temperaturer under 100 CGC är mindre än den vid 100 CGC, därför är mindre energi tillgänglig från slumpmässiga termiska rörelser. Ta till exempel det faktum att svett från huden vid kroppstemperatur kräver en värmetillförsel på 2428 kJ/kg, vilket är cirka 10 procent högre än den latenta förångningsvärmen vid 100 CGC. Denna värme kommer från huden och ger därmed en effektiv kylmekanism vid varmt väder. Hög luftfuktighet hämmar avdunstning, så att kroppstemperaturen kan stiga och lämnar ojämn svett på pannan.
exempel 1. Beräkna slutlig temperatur från fasförändring: kyl Soda med isbitar
tre isbitar används för att kyla en läsk vid 20 CCC med massa msoda = 0,25 kg. Isen är vid 0 CCC och varje isbit har en massa på 6,0 g. Antag att läsken hålls i en skumbehållare så att värmeförlusten kan ignoreras. Antag att läsken har samma värmekapacitet som vatten. Hitta den slutliga temperaturen när all is har smält.
strategi
isbitarna är vid smälttemperaturen på 0 UCC. Värme överförs från soda till isen för smältning. Smältning av is sker i två steg: först sker fasförändringen och fast (is) omvandlas till flytande vatten vid smälttemperaturen, då stiger temperaturen på detta vatten. Smältning ger vatten vid 0 CCC, så mer värme överförs från soda till detta vatten tills vatten plus soda systemet når termisk jämvikt, Qice = − Qsoda.
värmen som överförs till isen är
Qice = möss Lf + micecW(TF−0 CI CCC).
värmen som avges av sodavatten är Qsoda = msodacW (TF-20 UCCC). Eftersom ingen värme går förlorad, Qice = −Qsoda, så att
möss Lf + micecW(TF−0 UCCC) = –msodacW(TF−20 UCCC).
ta med alla termer som involverar Tf på vänster sida och alla andra termer på höger sida. Lös för den okända kvantiteten Tf:
\displaystyle{T}_{\text{f}}=\frac{m_{\text{soda}}c_{\text{W}}\left(20^{\circ}\text{C}\right)-m_{\text{ice}}L_{\text{f}}}{\left(m_{\text{soda}}+m_{\text{ice}}\right)c_{\text{W}}}\\
lösning
- identifiera kända kvantiteter. Ismassan är möss = 3 6,0 g 6,018 kg och läskmassan är msoda = 0,25 kg.
- beräkna termerna i täljaren: m sodacW( 20 CCC)=(0,25 kg) (4186 J/kg CCC) (20 CCC) = 20 930 J och micelf = (0,018 kg) (334 000 J/kg) = 6012 J.
- beräkna nämnaren: (msoda + möss)CW = (0,25 kg + 0.018 kg)(4186 K/(kg ci CC) = 1122 J/CI CC.beräkna den slutliga temperaturen: \ displaystyle{t} _ {\text{f}}= \ frac{20,930\text{ J}-6012\text{ J}}{1122\text{ J/}^{\circ} \ text{C}}=13^{\circ} \ text{C}\ \
diskussion
detta exempel illustrerar de enorma energierna som är involverade under en fasförändring. Ismassan är cirka 7 procent vattenmassan men leder till en märkbar förändring av sodavattentemperaturen. Även om vi antog att isen var vid frysningstemperaturen, är detta felaktigt: den typiska temperaturen är −6 UCC. Denna korrigering ger emellertid en slutlig temperatur som i huvudsak är identisk med resultatet vi hittade. Kan du förklara varför?

Figur 4. Kondens på ett glas iste. (kredit: Jenny Downing)
Vi har sett att förångning kräver värmeöverföring till en vätska från omgivningen, så att energi frigörs av omgivningen. Kondensation är omvänd process, vilket ökar omgivningens temperatur. Denna ökning kan tyckas överraskande, eftersom vi associerar kondens med kalla föremål—till exempel glaset i figuren. Emellertid måste energi avlägsnas från kondenseringsmolekylerna för att göra en ångkondensering. Energin är exakt densamma som den som krävs för att göra fasförändringen i andra riktningen, från vätska till ånga, och så kan den beräknas från Q = mLv.
kondensation bildas i Figur 4 eftersom temperaturen i den närliggande luften reduceras till under daggpunkten. Luften kan inte hålla så mycket vatten som det gjorde vid rumstemperatur, och så kondenserar vatten. Energi frigörs när vattnet kondenserar, vilket påskyndar smältningen av isen i glaset.
verklig applikation
energi frigörs också när en vätska fryser. Detta fenomen används av fruktodlare i Florida för att skydda apelsiner när temperaturen ligger nära fryspunkten (0 MIKROSEK). Odlare sprutar vatten på växterna i fruktträdgårdar så att vattnet fryser och värme släpps ut till de växande apelsinerna på träden. Detta förhindrar att temperaturen inuti apelsinen sjunker under frysning, vilket skulle skada frukten.

figur 14.11. Isen på dessa träd frigjorde stora mängder energi när den frös, vilket hjälpte till att förhindra att trädens temperatur sjunker under 0 UCC. Vatten sprutas avsiktligt på fruktträdgårdar för att förhindra hårda frost. (kredit: Hermann Hammer)
sublimering är övergången från fast till ångfas. Du kanske har märkt att snö kan försvinna i tunn luft utan spår av flytande vatten eller försvinnandet av isbitar i en frys. Det omvända är också sant: Frost kan bildas på mycket kalla fönster utan att gå igenom vätskesteget. En populär effekt är tillverkningen av” rök ” från torris, vilket är fast koldioxid. Sublimering sker eftersom jämviktsångtrycket för fasta ämnen inte är noll. Vissa Luftfräschare använder sublimering av ett fast ämne för att injicera en parfym i rummet. Malbollar är ett något giftigt exempel på en fenol (en organisk förening) som sublimerar, medan vissa fasta ämnen, såsom osmiumtetroxid, är så giftiga att de måste förvaras i förseglade behållare för att förhindra mänsklig exponering för deras sublimeringsproducerade ångor.

Figur 5. Direkta övergångar mellan fast och ånga är vanliga, ibland användbara och till och med vackra. (a) torris sublimerar direkt till koldioxidgas. Den synliga ångan är gjord av vattendroppar. (kredit: Windell Oskay) (b) Frost bildar mönster på ett mycket kallt fönster, ett exempel på ett fast ämne som bildas direkt från en ånga. (kredit: Liz West)
alla fasövergångar involverar värme. I fallet med direkta fasta ångövergångar ges den energi som krävs av ekvationen Q = mLs, där Ls är sublimeringsvärmen, vilket är den energi som krävs för att ändra 1.00 kg av ett ämne från den fasta fasen till ångfasen. Ls är analog med Lf och Lv, och dess värde beror på ämnet. Sublimering kräver energiinmatning, så att torris är ett effektivt kylmedel, medan omvänd process (dvs frostning) frigör energi. Mängden energi som krävs för sublimering är av samma storleksordning som för andra fasövergångar.
materialet som presenteras i detta avsnitt och föregående avsnitt tillåter oss att beräkna valfritt antal effekter relaterade till temperatur och fasförändring. I varje fall är det nödvändigt att identifiera vilka temperatur-och fasförändringar som äger rum och sedan tillämpa lämplig ekvation. Tänk på att värmeöverföring och arbete kan orsaka både temperatur-och fasförändringar.
problemlösningsstrategier för effekterna av värmeöverföring
- Undersök situationen för att bestämma att det finns en förändring i temperaturen eller fasen. Finns det värmeöverföring till eller ut ur systemet? När närvaron eller frånvaron av en fasförändring inte är uppenbar kanske du först vill lösa problemet som om det inte fanns några fasförändringar och undersöka den erhållna temperaturförändringen. Om det är tillräckligt att ta dig förbi en koknings—eller smältpunkt, bör du sedan gå tillbaka och göra problemet i steg-temperaturförändring, fasförändring, efterföljande temperaturförändring och så vidare.
- identifiera och lista alla objekt som ändrar temperatur och fas.
- identifiera exakt vad som behöver bestämmas i problemet (identifiera de okända). En skriftlig lista är användbar.
- gör en lista över vad som ges eller vad som kan härledas från problemet som anges (identifiera knowns).
- Lös lämplig ekvation för den kvantitet som ska bestämmas (det okända). Om temperaturen ändras beror den överförda värmen på den specifika värmen (se Tabell 1 i temperaturförändring och värmekapacitet) medan den överförda värmen för en fasförändring beror på den latenta värmen. Se Tabell 1.
- ersätt knowns tillsammans med deras enheter i lämplig ekvation och få numeriska lösningar kompletta med enheter. Du måste göra detta i steg om det finns mer än ett steg i processen (till exempel en temperaturförändring följt av en fasförändring).
- kontrollera svaret för att se om det är rimligt: är det meningsfullt? Var till exempel säker på att temperaturförändringen inte också orsakar en fasförändring som du inte har beaktat.
kontrollera din förståelse
varför finns snö kvar på bergssluttningar även när dagtemperaturerna är högre än frysningstemperaturen?
lösning
snö bildas av iskristaller och är således den fasta fasen av vatten. Eftersom enorm värme är nödvändig för fasförändringar tar det en viss tid för denna värme att ackumuleras från luften, även om luften är över 0 OZCC. Ju varmare luften är desto snabbare sker denna värmeväxling och ju snabbare snön smälter.
avsnitt sammanfattning
- de flesta ämnen kan existera antingen i fasta, flytande och gasformer, som kallas ”faser.”
- fasförändringar inträffar vid fasta temperaturer för ett givet ämne vid ett givet tryck, och dessa temperaturer kallas kokande och frysande (eller smältande) punkter.
- under fasförändringar ges värme absorberad eller frigjord av: Q = mL där L är den latenta värmekoefficienten.
konceptuella frågor
- värmeöverföring kan orsaka temperatur-och fasförändringar. Vad mer kan orsaka dessa förändringar?
- Hur hjälper den latenta fusionsvärmen av vatten att sakta ner minskningen av lufttemperaturerna, kanske förhindra att temperaturen faller betydligt under UCC, i närheten av stora vattenkroppar?
- vad är isens temperatur direkt efter att den bildats genom att frysa vatten?
- Om du placerar UCC IS i UCC vatten i en isolerad behållare, vad händer? Kommer någon Is att smälta, kommer mer vatten att frysa eller kommer inte att äga rum?
- vilken effekt har kondens på ett glas isvatten på den hastighet med vilken isen smälter? Kommer kondensationen att påskynda smältprocessen eller sakta ner den?
- i mycket fuktiga klimat där det finns många vattenkroppar, till exempel i Florida, är det ovanligt att temperaturen stiger över cirka 35 UCCC (95 UCCF). I öknar kan temperaturen dock stiga långt över detta. Förklara hur avdunstning av vatten hjälper till att begränsa höga temperaturer i fuktiga klimat.
- på vintrar är det ofta varmare i San Francisco än i närliggande Sacramento, 150 km inåt landet. På somrarna är det nästan alltid varmare i Sacramento. Förklara hur vattenkropparna som omger San Francisco dämpar sina extrema temperaturer.
- att sätta ett lock på en kokande kruka minskar kraftigt den värmeöverföring som krävs för att hålla den kokande. Förklara varför.
- frystorkade livsmedel har dehydratiserats i vakuum. Under processen fryser maten och måste värmas upp för att underlätta uttorkning. Förklara både hur vakuumet påskyndar uttorkning och varför maten fryser som ett resultat.
- när luften fortfarande svalnar genom att stråla på natten är det ovanligt att temperaturen faller under daggpunkten. Förklara varför.
- i en fysikklassdemonstration blåser en instruktör upp en ballong genom munnen och kyler sedan den i flytande kväve. När den är kall har den krympta ballongen en liten mängd ljusblå vätska i den, liksom några snöliknande kristaller. När det värms upp kokar vätskan och en del av kristallerna sublimerar, med några kristaller som dröjer ett tag och sedan producerar en vätska. Identifiera den blå vätskan och de två fasta ämnena i den kalla ballongen. Motivera dina identifieringar med hjälp av data från Tabell 1.
problem& övningar
- hur mycket värmeöverföring (i kilokalorier) krävs för att tina ett 0,450 kg paket med frysta grönsaker ursprungligen vid 0 OCCC om deras fusionsvärme är densamma som för vatten?
- en påse som innehåller 0 C. C. is är mycket effektivare när det gäller att absorbera energi än en som innehåller samma mängd 0 C. C. Vatten. (a) hur mycket värmeöverföring är nödvändig för att höja temperaturen på 0,800 kg vatten från 0 kg till 30,0 kg? (B) hur mycket värmeöverföring krävs för att först smälta 0.800 kg 0 C. C. is och sedan höja dess temperatur? (C) förklara hur ditt svar stöder påståendet att isen är effektivare.
- (a) hur mycket värmeöverföring krävs för att höja temperaturen på en 0,750 kg aluminiumkruka som innehåller 2,50 kg vatten från 30,0 CCC till kokpunkten och koka sedan bort 0,750 kg vatten? (B) hur lång tid tar detta om värmeöverföringshastigheten är 500 W 1 watt = 1 joule/sekund (1 W = 1 J/s)?bildandet av kondens på ett glas isvatten gör att isen smälter snabbare än annars. Om 8.00 g kondensation bildas på ett glas som innehåller både vatten och 200 g is, hur många gram av isen smälter som ett resultat? Antag att ingen annan värmeöverföring sker.
- på en resa märker du att en 3,50 kg påse med is varar i genomsnitt en dag i din kylare. Vad är den genomsnittliga effekten i watt som kommer in i isen om den börjar vid 0 UCCC och smälter helt till 0 UCCC vatten på exakt en dag 1 watt = 1 joule/sekund (1 W = 1 J/s)?
- på en viss torr solig dag skulle en poolens temperatur stiga med 1,50 UCCC om inte för avdunstning. Vilken fraktion av vattnet måste avdunsta för att föra bort exakt tillräckligt med energi för att hålla temperaturen konstant?
- (a) hur mycket värmeöverföring är nödvändig för att höja temperaturen på en isbit på 0,200 kg från -20,0 xnumx till 130 xnumx xnumx, inklusive den energi som behövs för fasförändringar? (b) hur mycket tid krävs för varje steg, förutsatt en konstant 20.0 kJ/s värmeöverföringshastighet? (C) gör en graf över temperatur kontra tid för denna process.
- 1986 bröt ett gigantiskt isberg bort från Ross ishylla i Antarktis. Det var ungefär en rektangel 160 km lång, 40.0 km bred och 250 m tjock. (A) Vad är massan av detta isberg, med tanke på att isens densitet är 917 kg/m3? (B) hur mycket värmeöverföring (i joule) behövs för att smälta den? (C) hur många år skulle det ta solljus ensam för att smälta isen så tjock, om isen absorberar i genomsnitt 100 W/m2, 12.00 h per dag?
- hur många gram kaffe måste avdunsta från 350 g kaffe i en 100-g glaskopp för att kyla kaffet från 95,0 UCCC till 45,0 UCCC? Du kan anta att kaffet har samma termiska egenskaper som vatten och att den genomsnittliga förångningsvärmen är 2340 kJ/kg (560 Kal/g). (Du kan försumma förändringen i kaffets massa när det svalnar, vilket ger dig ett svar som är något större än korrekt.)
- (a) det är svårt att släcka en eld på en råoljetankfartyg, eftersom varje liter råolja släpper ut 2,80 107 j 107 j energi när den bränns. För att illustrera denna svårighet, beräkna antalet liter vatten som måste förbrukas för att absorbera den energi som frigörs genom att bränna 1,00 L råolja, om vattnet har sin temperatur höjt från 20,0 C / C till 100 C / C, det kokar och den resulterande ångan höjs till 300 C / C. B) diskutera ytterligare komplikationer orsakade av att råolja har en mindre densitet än vatten.
- den energi som frigörs från kondens i åskväder kan vara mycket stor. Beräkna den energi som släpps ut i atmosfären för en liten storm med radie 1 km, förutsatt att 1,0 cm regn utfälls jämnt över detta område.
- för att förhindra frostskador sprutas 4,00 kg 0 OZCC-vatten på ett fruktträd. (a) hur mycket värmeöverföring sker när vattnet fryser? b) hur mycket skulle temperaturen på trädet på 200 kg minska om denna mängd värme överförs från trädet? Ta den specifika värmen för att vara 3,35 kJ / kg * UCC, och anta att ingen fasförändring inträffar.
- en 0,250 kg aluminiumskål som rymmer 0,800 kg soppa vid 25,0 XNUMX CC placeras i en frys. Vad är den slutliga temperaturen Om 377 kJ energi överförs från skålen och soppan, förutsatt att soppans termiska egenskaper är desamma som för vatten?
- en isbit på 0,0500 kg vid -30,0 C. C. placeras i 0,400 kg 35,0 C. C. vatten i en mycket välisolerad Behållare. Vad är den slutliga temperaturen?
- Om du häller 0,0100 kg 20,0 CGC vatten på ett 1,20 kg isblock (som ursprungligen är vid -15,0 CGC), vad är den slutliga temperaturen? Du kan anta att vattnet svalnar så snabbt att effekterna av omgivningen är försumbara.ursprungsbefolkningen lagar ibland i vattentäta korgar genom att placera heta stenar i vatten för att koka upp det. Vilken massa av 500 OZCC-sten måste placeras i 4,00 kg 15,0 OZCC-vatten för att få temperaturen till 100 OZCC, om 0,0250 kg vatten släpper ut som ånga från den ursprungliga sizzle? Du kan försumma effekterna av omgivningen och ta den genomsnittliga specifika värmen på klipporna för att vara granit.
- vad skulle vara den slutliga temperaturen på pannan och vattnet vid beräkning av den slutliga temperaturen när värme överförs mellan två kroppar: hälla kallt vatten i en het panna om 0,260 kg vatten placerades i pannan och 0,0100 kg av vattnet avdunstades omedelbart, vilket gör att resten kommer till en gemensam temperatur med pannan?
- i vissa länder används flytande kväve på mjölkbilar istället för mekaniska kylskåp. A 3.00-timmars leveransresa kräver 200 L flytande kväve, som har en densitet på 808 kg/m3. (A) beräkna den värmeöverföring som krävs för att avdunsta denna mängd flytande kväve och höja dess temperatur till 3,00 CGC. (Använd cp och anta att det är konstant över temperaturområdet.) Detta värde är mängden kylning av flytande kvävetillförsel. (B) Vad är denna värmeöverföringshastighet i kilowattimmar? C) jämför den mängd kylning som erhålls genom smältning av en identisk massa av 0 CCSIS med den från avdunstning av det flytande kvävet.
- vissa pistolfanciers gör sina egna kulor, vilket innebär smältning och gjutning av blysniglarna. Hur mycket värmeöverföring behövs för att höja temperaturen och smälta 0,500 kg bly, från och med 25,0 OCCC?
ordlista
värme av sublimering: den energi som krävs för att ändra ett ämne från den fasta fasen till ångfasen
latent värmekoefficient: en fysisk konstant lika med mängden värme som överförs för varje 1 kg av ett ämne under förändringen i fas av ämnet
sublimering: övergången från den fasta fasen till ångfasen
valda lösningar på problem& övningar
1. 35,9 kcal
3. a) 591 kcal; b) 4,94 103 c
5. 13,5 W
7. a) 148 kcal; b) 0,418 s, 3,34 s, 4,19 s, 22,6 s, 0,456 s
9. 33,0 g
10. (a) 9,67 L; (b) råolja är mindre tät än vatten, så det flyter på toppen av vattnet och därmed utsätta den för syre i luften, som den använder för att bränna. Om vattnet är under oljan är det också mindre effektivt att absorbera värmen som genereras av oljan.
12. a) 319 kcal; b)2,00 CI C
14. 20,6 UBICC
16. 4, 38 kg
18. a) 1,57 104 kcal, b) 18,3 kW 104 kcal, c) 1,29 104 kcal
- värden som anges vid normal smältning och kokning vid standard atmosfärstryck (1 atm). 37.0 C. C. (kroppstemperatur), förångningsvärmen Lv för vatten är 2430 kJ/kg eller 580 kcal / kg C. C.
- vid 37.0 C. C. (kroppstemperatur), förångningsvärmen Lv för vatten är 2430 kJ / kg eller 580 kcal/kg C. C. / li >