A Microbial Biorealm page on the genus Enterococcus faecalis
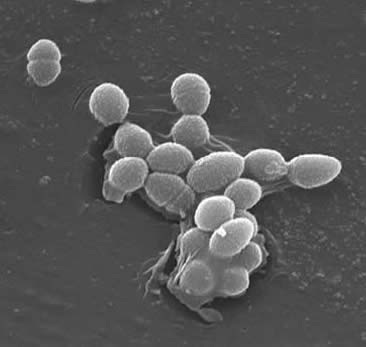
Classification
Higher order taxa
Bacteria; Firmicutes; Bacilli; Lactobacillales; Enterococcaceae; Enterococcus
arter
Enterococcus faecalis
beskrivning och betydelse
enterokocker är Gram-positiva kocker som kan överleva hårda förhållanden i naturen. De finns i jord, vatten och växter. Vissa stammar används vid tillverkning av livsmedel medan andra är orsaken till allvarliga infektioner hos människor och djur (t.ex. de är kända för att kolonisera mag-tarmkanalen och könsorganen hos människor). De är förknippade med både samhälls-och sjukhusförvärvade infektioner. Enterokocker kan växa vid ett temperaturområde på 10 till 42 C C och i miljöer med breda pH-värden. Vissa är kända för att vara rörliga. Medan det finns över 15 arter av Enterococcus-släktet är 80-90% av kliniska isolat E. faecalis (8). Enterokocker bildar vanligtvis korta kedjor eller är ordnade i par. Men under vissa tillväxtförhållanden förlänger de och verkar cocobacillary. I allmänhet är enterokocker alfa-hemolytiska. Vissa har Grupp D Lancefield antigen och kan detekteras med användning av monoklonala antikroppsbaserade agglutinationstester.Enterokocker är vanligtvis katalas negativa och är anaeroba. De kan växa i 6,5% NaCl, kan hydrolysera esculin i närvaro av 40% gallsalter och är pyrrolidonylarylamidas och leucinarylamidas positiva (8). Enterokocker har visat sig presentera en terapeutisk utmaning på grund av deras resistens mot många antimikrobiella läkemedel, ”inklusive cellväggsaktiva medel; aminoglykosider, penicillin och ampicillin och vankomycin” (1). Enterokocker har kapacitet att förvärva en mängd olika antimikrobiella resistensfaktorer, som uppvisar allvarliga problem vid hanteringen av patienter med enterokockinfektioner (8). I allmänhet kan enterokockisolat med sänkt mottaglighet för vankomycin kategoriseras som vanA, vanB och vanC. vanA och vanB utgör det största hotet eftersom de är de mest resistenta och resistensgenerna bärs på en plasmid. Eftersom resistensgenerna bärs på en plasmid är de lätt överförbara, E. faecalis kan överföra dessa plasmider genom konjugering (2). E. faecalis är också resistenta mot teikoplanin. Enterokockstammar som är vankomycinberoende har hittats, men är sällsynta och mindre vanliga än vankomycinresistenta stammar (kallad ”vankomycinresistenta enterokocker” eller ”VRE”) (1).
Genomstruktur

På grund av många folkhälsofaror var genomsekvensdata från en stam av enterokocker nödvändig. Den stam som valts för genom-DNA-sekvensering var E. faecalis V583, det första vankomycinresistenta isolatet i USA. Genomet av stam V583 sekvenserades av Institutet för genomforskning (TIGR). Enterokockgenomet visar att E. faecalis är metaboliskt varierat och innehåller ett brett spektrum av regleringssystem. Stam V583 innehåller fyra DNA-molekyler: den huvudsakliga 3 218 030 basparet bakteriell kromosom och tre cirkulära plasmider. Kromosomen innehåller cirka 3500 öppna läsramar( ORFs), cirka 1/3 av dessa ORFs har ingen tilldelningsbar funktion (8). De tre plasmiderna är cirkulära DNA-molekyler identifierade som Plasmid-1, Plasmid-2 och Plasmid-3. Plasmid – 1 innehåller 66 320 bp, Plasmid-2 innehåller 17 963 bp och Plasmid-3 innehåller 57 660 bp. Plasmiderna kodar för ett antal gener, inklusive transposaser, multiläkemedelsresistensproteiner och en ppgpp-reglerad tillväxthämmare (8). Den genomsnittliga G + C-kompositionen för E. faecalis-kromosomen är 37,38%. Eftersom DNA-molekylen är så stor uppstår regionala avvikelser från genomsnittet. En av dessa platser är det stora segmentet associerat med” vankomycinresistensgenklustret placerat nära 2,22 Mb”, vilket visar en stor ökning av procent G+C-innehåll (8). Dessa skillnader förknippade med antibiotikaresistens eller virulens föreslog förvärv av genetiskt material från en främmande art genom horisontell överföring. Det är fortfarande okänt om överföringarna är ansvariga för variationerna i DNA-smink. Informationen i genomet av E. faecalis V583 hjälper till att förstå hur organismen har anpassat sig till att vara en mångsidig mänsklig patogen. Med hjälp av jämförande genomik kommer de olika regleringselementens roll att förstås bättre i hur de svarar på olika miljöbelastningar och i uttrycket av potentiella virulensfaktorer (8). Fler studier som dessa kommer att föreslå nya läkemedel mot bakterieinfektioner orsakade av enterokocker.Genomet innehåller också 3 EBP (kodning för endokardit biofilm-associerade pili) operoner som är viktiga för biofilm produktion av E. faecalis stam OG1RF. Denna stam använder dessa operoner för att producera yta pili. . Ytan pili används för” fastsättning på värdytorna och är antigena hos människor under endokardit ” (9).
TIGR innehåller en komplett lista över gener för E. faecalis-kromosomerna.
cellstruktur och metabolism
cellmetabolism
Enterokockerna bor i hårda miljöer, som tarmkanalerna hos människor och djur. Tillväxt under dessa fientliga förhållanden kräver att E. faecalis har en metabolism som är flexibel. E. faecalis kan inte bara jäsning för att producera mjölksyra utan kan också ”katabolisera ett spektrum av energikällor från kolhydrater, glycerol, laktat, malat, citrat, diaminosyror och Manya-keto-syror” (3).Det har visat sig att under utvalda tillväxtförhållanden kan E. faecalis förbättra tillväxten genom oxidativ fosforylering med hjälp av en protonmotivkraft som fastställts genom elektrontransport. En konsekvens av ”begynnande andning är produktion av potenta oxidanter” (t.ex. superoxid och väteperoxid), oxidativ stress E. faecalis kan tolerera (3). Toleransen för denna stress, i kombination med andra svåra tillväxtförhållanden, gör att E. faecalis kan växa vid 10 till 45 CCG, i gallsalter och vid extremt låga och höga pHs. Dessutom kan E. faecalis motstå azid, tvättmedel, tungmetaller och etanol. Eftersom E. faecalis kan använda olika sockerkällor kan den leva i olika miljöer, särskilt i tarmen där näringsämnen är begränsade (2). I tarmen härleder E. faecalis det mesta av sin energi från jäsning av icke-absorberade sockerarter. E. faecalis kan också få energi genom att försämra muciner, ett kolhydrat som är starkt glykosylerat och producerat av tarmbägare celler (2).E. faecalis använder ett ”fosfoenolypyruvatfosfotransferasystem (PTS) för att känna av sockerarter utanför cellen och parupptag av sockerarter med fosforylering” (2). På så sätt slösas mindre energi (ATP) bort jämfört med hur socker ackumuleras av icke-PTS-system. Socker som metaboliseras av E. faecalis inkluderar: D-glukos, d-fruktos, laktos, maltos (alla PTS-substrat). I enterokocker reglerar PTS också glycerolmetabolism, inducerutvisning och katabolitförtryck (8). E. faecalis är en av några Gram-positiva bakterier med lågt G+C-innehåll som utvisar socker under tillväxt på glukos, ett fenomen som kallas inducerutvisning (8). E. faecalis kan till och med jäsa glycerol under aeroba och mikroaerophillic förhållanden. E. faecalis kan också växa på glycerol under anaeroba förhållanden eftersom det” uttrycker en gen för nad+-kopplad anaerob glyceroldehydrogenasaktivitet ” (8). Glycerol kan korsa cellmembranet med hjälp av ett protein som kallas glycerol diffusion facilitator (GlpF). GlpF gör koncentrationen av glycerol inuti och utanför cellen lika, proteinet hämmas av glykolys. E. faecalis kan leva i extremt alkaliskt pH och hög saltkoncentration. Dessa egenskaper kräver katjontransport för att upprätthålla den konstanta cytosoliska jonkompositionen som är nödvändig för homeostas. Alla celler måste utvisa överskott av natrium för att upprätthålla cytosoliska koncentrationer inom intervallet som gynnar homeostas. E. faecalis uttrycker både en Na+ / H + antiporter och en vakuolär Typ ATPas (2). Kalium är en stor intracellulär katjon. Kaliumkoncentrationen inom E. faecalis på 0,4 till 0,6 M är väsentlig för normal cellulär metabolism, den ”neutraliserar intracellulära anjoner, aktiverar olika enzymer och reglerar cytosoliskt pH” (8). E. faecalis uttrycker minst två kaliumtransportörer för att utföra förordningen, KtrI och KtrII tillsammans med Kep-systemet för K+ extrudering (8). Även om det är känt att KtrI och KtrII är K+ upptagningssystem (de är K+/H+ symporterare), är lite mer känt proteinerna.
cellstruktur
enterokocker är Gram-positiva kocker som typiskt bildar korta kedjor eller är ordnade i par (3). Under vissa tillväxtförhållanden kan de förlängas och förekomma coccobacillary. Cellväggen i E. faecalis är 20 till 38% av torrcellens vikt (i exponentiella och stationära fasceller). Med tanke på att E. faecalis är en Gram-positiv bakterie finns det tre huvudkomponenter som utgör dess cellvägg: peptidoglykan, teikosyra och polysackarid. 40% av cellväggen består av peptidoglykan, medan resten av cellväggen består av en ”rhamnosinnehållande polysackarid och en ribitolinnehållande teikosyra” (3). Peptidioglykan fungerar (som i de flesta Gram-positiva celler) för att motstå sprängning inducerad av högt cytoplasmiskt osmotiskt tryck. E. faecalis anses generellt vara en icke-inkapslad organism, vilket framgår av ”bristen på en detekterbar mukoidfenotyp” (3). Emellertid har delmängder av E. faecalisisolat en kapselpolysackarid. E. faecalis kan utbyta genetiskt material (plasmider) genom konjugeringsprocesser inducerade av små peptidferomoner (2). Ytprotein” aggregeringsämnen som känner igen en specifik ligand på mottagarceller ” säkerställer framgångsrika anslutningar för konjugering (2).E. faecalis har också förmågan att göra yta pili vilket kan leda till bildandet av en biofilm. E. faecalis-stammarna som orsakar endokardit innehåller stora mängder av dessa pili. Pili möjliggör fastsättning på värdytor (t.ex. hjärtvävnaden). Stammarna av E. faecalis som orsakar endokardit producerar ”biofilmen betydligt oftare och även i högre grad än isolat av icke-endokardit” (9).
ekologi
E. faecalis är en mycket varierande art av enterokocker. Det interagerar med många andra organismer och har effekter på miljön. Enterokocker är medlemmar i bakteriegemenskapen som bor i tjocktarmen hos människor. De är också en naturlig del av tarmfloran hos de flesta andra däggdjur och fåglar (8). Enterokocker finns också i jord, växter och vatten. När de finns i vatten beror det vanligtvis på att vattnet hade förorenats med fekal materia. Även om E. faecalis inte förekommer för ofta i växter, har andra stammar av enterokocker hittats bland växter och är sannolikt att göra en förorenad vattenkälla (8).Ekologin för antibiotikaresistens och virulensgenöverföring i miljön är fortfarande inte väl förstådd. Insekter, såsom husflugor (HF), som utvecklas i förfallande organiskt material kan överföra antibiotikaresistenta bakterier från gödsel från djur och andra förfallna organiska substrat till bostadsinställningar (7). HF är perfekta sändare på grund av de levande mikrobiella samhällena som finns i livsmiljöerna där de utvecklas (t.ex. avföring). Att lägga till de goda överföringskvaliteterna är hur HF matar sina unga (regurgitation) och deras attraktion för mänsklig mat. Eftersom HF kan flyga långa sträckor är denna insekt mycket bra för att sprida fekala bakterier, inklusive mänskliga och djurpatogener, och eventuellt antibiotikaresistenta stammar av enterokocker (7). En ny studie screenad för antibiotikaresistens och virulensgener i enterokocker från HF i snabbmatsrestauranger i kanasas. Denna studie visade att ”husflugor i livsmedelshanterings-och serveringsanläggningar kan bära antibiotikaresistenta och potentiellt virulenta enterokocker som har kapacitet för horisontell överföring av antibiotikaresistensgener till andra bakterier” (7).Effekterna som E. faecalis har på miljön tenderar att vara mer negativ. De förorenar vanligtvis vattenförsörjning som kan leda till infekterade växter samt infektioner hos människor (8). De antibiotiska faktorerna kan också transporteras av olika insekter (t.ex. husflugor) och djur, vilket leder till ökande antal virulenta E. faecalis.
patologi
enterokocker har uppstått som en viktig orsak till nosokomiala infektioner, och inom denna grupp orsakar Enterococcus faecalis majoriteten av humana enterokockinfektioner. Dessa infektioner kan vara lokala eller systematiska och inkluderar urinvägs-och bukinfektioner, sårinfektioner, bakteriemi och endokardit (2). Eftersom E. faecalis kan överleva många miljöutmaningar (såsom extrema temperaturer och närvaron av gallsalter) och eftersom de kan få resistens mot flera antibiotika har dessa bakterier blivit ett stort hälsoproblem. Det nationella nosokomiala Infektionsövervakningssystemet (NNIS) har rapporterat ökningar i förekomsten av infektioner på grund av vankomycinresistenta enterokocker (VRE) sedan 1989 (1). Detta kan innebära allvarliga hälsoproblem, som inkluderar bristen på tillgänglig antibiotikabehandling för VRE-infektioner, eftersom de flesta VRE-stammar har resistens mot flera antibiotika förutom vankomycin (t.ex. aminoglyskoider och ampicillin). Överföringen av vanocmycinresistenta gener från VRE till andra Gram-positiva patogener är ett allvarligt folkhälsoproblem. Det vanligaste sättet att E. faecalis orsakar infektion uppstår på ett sjukhus / långtidsvård anläggning är överföring av E. faecalis mellan patienter (8). Enterokocker kan bäras i vårdpersonalens händer och transporteras (överföras) från en patient till en annan. Det har visats att VRE på händerna kan bestå i upp till 60 minuter (8). Överföringen från en vårdarbetares händer till patienten kan ske vid kontakt med patientens intravenösa eller urinkatetrar. Rektala termometrar, som inte rengörs ordentligt efter användning, kan också överföra VRE från patient till patient. Ibland kan överföringen resultera i kolonisering av patientens GI-kanal med den förvärvade stammen. Den nya stammen blir sedan en del av patientens endogena flora (8). Den förvärvade stammen, som bär antibiotikaresistensgener, kan leva i GI-kanalen. Infektioner uppstår sedan från dessa nyförvärvade E. faecalis-stammar.E. faecalis kan orsaka många infektioner i människokroppen. Den vanligaste infektionen orsakad av enterokocker är infektion i urinvägarna. E. faecalis kan orsaka lägre urinvägsinfektioner (UTI), såsom cystisis, prostatit och epididymit (8). E. faecalis finns också i infektioner i buken, bäcken och mjukvävnad. E. faecalis kan orsaka nosokomial bakteriemi. Källan till bakteriemi är oftast urinvägarna, som härrör från en infekterad intravenös kateter. Endokardit är den allvarligaste enterokockinfektionen, eftersom det orsakar inflammation i hjärtklaffarna. I många fall av endokardit misslyckas antibiotikabehandling och kirurgi för att ta bort den infekterade ventilen är nödvändig (8). Mindre vanliga infektioner orsakade av E. faecalis inkluderar meningit, hematogen, osteomyelit, septisk artrit och (mycket sällan) lunginflammation. På grund av Enterokockernas resistens mot många antibiotika är behandling av dessa infektioner svår.
ansökan till bioteknik
enterokocker har studerats för eventuell användning som probiotikum (ett kosttillskott som innehåller levande icke-virulenta mikrobiella celler som vid intag tros ha en positiv effekt på sammansättningen av tarmmikrofloran). Administrering av E. faecalis-stammen har visat sig minska diarre. E. faecalis probiotika används i kyckling/gris / nötkreatur foder för att sänka diarre hos djuren (8).
På grund av de höga sjukdomsframkallande egenskaperna hos E. faecalis har mycket mer forskning genomförts om hur man stoppar virulens av E. faecalis än den fördelaktiga användningen av E. faecalis.
aktuell forskning
1.) Hopp för infektioner orsakade av Enterococcus faecalis (4)
det är känt att vankomycinresistenta bakterier (t.ex. E. faecalis) utgör många problem för samhället och orsakar bakteriella infektioner hos människor som är svåra att behandla. Enterokockinfektionerna är utmanande eftersom organismerna har förmågan att snabbt förvärva och sprida resistensgener. Ceftobiprol (BPR) användes som ett undersökande cefalosporin mot Gram-positiva kocker. BPR är ett bredspektrum parenteralt cefalosporin med höga affiniteter från Gram-positiva och Gram-negativa penicillinbindande proteiner. Det visar också stabilitet mot hydrolys med hjälp av laktamaser.Denna studie undersökte BRP: s aktivitet mot en stor samling av E. faecalis och tittade på BPR-bakteriedödande aktivitet mot vankomycinresistenta isolat. Studien fann att mottagligt för BPR i E. faecalis inte påverkas av närvaron av vankomycinresistens eller av produktion av ozi-laktamas. I stammarna av E. faecalis som visade antingen vankomycinresistens (VanA-och VanB-fenotyper) eller ampiciliinresistens var BPR bakteriedödande. Forskarna visade att BPR uppvisade bakteriedödande aktivitet mot E. faecalis i en dos av 750 mg, vilket hämmar 100% av E. faecalis-aktiviteten. Även om närvaron av enzymet Javi-laktamas är sällsynt i E. faecalis, komprometterar dess närvaro användningen av de mest effektiva anti-enterococcal-laktamerna (t.ex. ampicillin). BPR är ett dåligt substrat för ett enzym som producerar E. faecalis, vilket förklarar dess utmärkta aktivitet mot att producera E. faecalis.Denna forskning visade att BPR har potent aktivitet mot en mycket stor samling av E. faecalis. BPR: s aktivitet påverkades inte av vankomycinresistens eller produktion av kub-laktamas. Därför är BPR ett hoppfullt medel för användning för att behandla jacobilaktamasproducerande och vankomycinresistenta E. faecalis-infektioner hos människor.
2.) Undersöka hur Enterococcus faecalis blir resistenta mot läkemedlet linezolid (5)
när antibiotika används vid behandling av en bakteriell infektion kan de påverka tarmfloran. Resistenta bakterier kan väljas under behandling, såsom enterokocker, och är potentiellt patogena. Uppkomsten av resistens är en fråga för nya antibiotika eftersom det kan riskera användbarheten av antibiotika.Denna studie undersökte uppkomsten av resistens mot antibiotika av E. faecalis. Mer specifikt tittade forskarna på resistens mot linezolid (den första av en ny klass av antibiotika som kallas ”oxazolidinoner”). Linezolid kan användas mot flera läkemedelsresistenta Gram-positiva kocker, inklusive VRE. Det hämmar bakteriell proteinsyntes genom att binda specifikt till en domän i 50s ribosomal subenhet och påverkas inte av resistensmekanismerna som påverkar andra antibiotika. Denna studie tittade på uppkomsten av linezolidresistenta E. faecalis mutanter i matsmältningskanalen hos gnotobiotiska möss. Does av linezolid matades i vatten med doser som varierade från 0, 5, 0, 005 till 0, 005 g/L. mutanterna var alla beroende av den givna linezoliden, resistensnivåerna ökade med exponeringstiden. Inga mutanter isolerades i frånvaro av linezolid, vilket tyder på att de novo resistens mot linezolid var ovanligt i enterokocker.Forskningen fann att en mutation i en enda 23S rRNA-gen var det kritiska steget i uppkomsten av linezolidresistens. Primär kolonisering med mutanter med en mutation observerades så tidigt som 5 dagar efter behandlingsstart hos möss.Dessa experiment som involverar möss hjälper till att förklara mönstret för uppkomsten av resistens mot linezolid observerad i kliniska isolat. Forskargruppen visade att dosen är avgörande för resistensdynamiken. Dessa resultat bör hjälpa till att definiera de bästa terapeutiska strategierna för att minimera uppkomsten av resistens i klinisk miljö, eventuellt rädda många liv.
3.) Ett Ser / Thr-Kinas i Enterococcus faecalis har visat sig förmedla antimikrobiell resistens (6)
Enterococcus faecalis orsakar många av de antibiotikaresistenta infektionerna på sjukhus, en följd av dess inneboende resistens mot vissa antibiotika och dess förmåga att överleva och proliferera i tarmkanalen.Den genetiska grunden för motståndet som ses i E. faecalis är inte välkänt, denna forskning försöker identifiera en orsak till motståndet. Forskarna visade att PrkC, ett enkomponentsignalprotein innehållande en eukaryot-Typ Ser/Thr-kinasdomän, möjliggjorde inneboende antimikrobiell resistens och intestinal persistens av E. faecalis. De fann att en E. faecalis-mutant som saknade PrkC växte med en vildtypshastighet i frånvaro av antimikrobiell stress men visade ökad känslighet för cellhöljeaktiva föreningar, inklusive antibiotika som riktade cellväggbiogenes och gallmedel.PrkC reglerar fysiologiska processer i E. faecalis som är nyckeln till dess framgång som en nosokomial patogen. Forskarnas förutspådda struktur av PrkC var en cytoplasmatisk kinasdomän separerad av ett transmembransegment som tros binda okorsbunden peptidoglykan. Detta föreslog att PrkC var en transmembranreceptor som övervakar integriteten hos E. faecalis cellvägg och förmedlar adaptiva svar för att upprätthålla den intergriteten. PrKC är viktigt för E. faecalis att orsaka nosokomiala infektioner, vilket tyder på att signalproteinet är ett mål för utveckling av terapier för att förhindra infektioner av antibiotikaresistenta enterokocker.
1.) I. T. Paulsen, L. Banerjei, G. S. A. Myers, K. E. Nelson, R. Seshadri, T. D. Läs, D. E. Fouts, J. A. Eisen, S. R. Gill, J. F. Heidelberg, H. Tettelin, R. J. Dodson, L. Umayam, L. Brinkac, M. Beanan, S. Daugherty, R. T. DeBoy, S. Durkin, J. Kolonay, R. Madupu, W. Nelson, J. Vamathevan, B. Tran, J. Upton, T. Hansen, J. Shetty, H. Khouri, T. Utterback, D. Radune, K. A. Ketchum, B. A. Dougherty, C. M. Fraser. ”Roll av Mobilt DNA i utvecklingen av Vankomycinresistent Enterococcus faecalis.” Vetenskap. Mars 2003. Vol. 299, nr 5615. s. 2071-2074
2.) Murrary vara . Maj 1998. ”Mångfald bland multidrugsresistenta enterokocker.”Nya Infektionssjukdomar. Vol. 4, nr 1. s. 46-65.
3.) De la Maza, Luis M., Marie T. Pezzlo och Janet T. Shigei. Färgatlas av medicinsk bakteriologi. Washington, DC: American Society for Microbiology Press, 2004.
4.) Arias C., Singh K., Panesso D., Murray vara. ”Time-Kill och Synergism studier av ceftobiprol mot Enterococcus faecalis, inklusive Javi-laktamas-producerande och Vankomycinresistenta isolat.”Antimikrobiella medel och kemoterapi. Juni 2007. Vol. 51, nr 6. s. 2043-2047.
5.) Bourgeois-Nicolaos N., Massias L., Couson B., Butel MJ, Andremont A., Doucet-Populaire F. ” dosberoende av uppkomsten av resistens mot Linezolid i Enterococcus faecalis in vivo.”Journal of Infectious Diseases. 2007. Vol. 195. s. 1480-1488.
6.) Kristich C., Wells C., Dunny G. ”Ett eukaryot-Typ Ser / Thr-Kinas i Enterococcus faecalis förmedlar antimikrobiell resistens och intestinal persistens.”Proceedings of National Academy of Sciences i Förenta Staterna. Februari 2007. Vol. 104, nr 9. s. 3508-3513.
7.) Macovei, L., Zurek, L. ” ekologi av antibiotikaresistensgener: karaktärisering av enterokocker från husflugor samlade i Matinställningar.”Tillämpad och miljömässig mikrobiologi. Juni 2006. Vol. 72, nr 6. s. 4028-4035.
8.) Gilmore, Michael. Enterokocker: patogenes, molekylärbiologi och antibiotikaresistens. Washington, DC: American Society for Microbiology Press, 2002.
9.) Nallapareddy Sr, Singh KV, Sillanp J, Garsin da, h Ubik m, Erlandsen sl, Murray vara.. ”Endokardit och biofilm-associerad pili av Enterococcus faecalis.”Journal of Clinical Investigation. Oktober 2006. Nr 116. s. 2799-2807.
redigerad av Richard A. Martinez från UC San Diego, student av Rachel Larsen.