Chemguide: kärnkemi 14-16
dubbel-och trippelkovalenta bindningar
denna sida introducerar möjligheten till flera (dubbla eller tredubbla) kovalenta bindningar mellan atomer med syre, kväve, koldioxid och eten som exempel. Dessa väljs eftersom de alla vanligtvis anges på brittiska kursplaner för 14-16-åringar.
Jag antar att du har läst sidan introducerar kovalent bindning och har tillgång till ett periodiskt bord som det du kan ladda ner från den här webbplatsen.
dubbelbindning i syre
Om du tittar upp syre på det periodiska systemet kommer du att upptäcka att det har ett atomnummer på 8 – och så har den neutrala atomen 8 protoner och 8 elektroner. Dessa kommer att ordnas 2,6.
så du har två atomer så här:
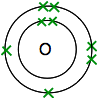
var och en har två oparade elektroner. För att få maximal energisk stabilitet måste alla dessa paras ihop.
så oxygenerna delar två par elektroner:
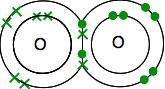
detta är mycket lättare att se med hjälp av linjer för att representera par av delade elektroner:
![]()
trippelbindning i kväve
Om du hittar kväve i det periodiska systemet kommer du att kunna räkna ut att dess elektroniska struktur är 2,5. Att jämföra det med syre har därför ett par elektroner och tre oparade elektroner i sin yttre nivå.
För att göra det så energiskt stabilt som möjligt måste det Para ihop alla dessa i kovalenta bindningar. Två kväveatomer kommer därför att kombineras på detta sätt:
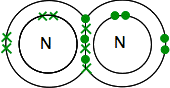
återigen är det mycket lättare att se med hjälp av linjer för att representera par av delade elektroner:
![]()
dubbelbindning i koldioxid
kolens elektroniska struktur är 2,4 med 4 oparade elektroner i den yttre nivån.
syre är 2,6 med 2 par elektroner och 2 oparade elektroner i den yttre nivån.
Du måste sluta med alla elektroner Parade-och det finns bara ett sätt att göra det.
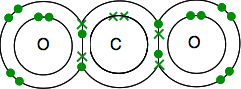
som tidigare är bindningen lättare att se med hjälp av linjer för bindning av elektronpar.
![]()
om det finns två bindningspar av elektroner mellan två atomer kallas det inte överraskande en dubbelbindning. Så varje syre förenas med kolatomen i mitten med en dubbelbindning.
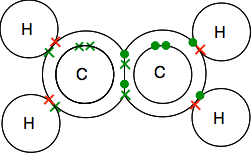
dubbelbindning i eten, C2H4
eten och andra liknande föreningar med dubbelbindningar mellan kolatomer är viktiga ämnen i kemi. Du kommer att träffa dem mer detaljerat senare under kursen.
titta noga på dots-and-cross-diagrammet och se till att du förstår hur allt passar ihop. Det måste vara så här så att alla enskilda elektroner i både kol och väten paras ihop i bindningspar.
om du stöter på diagram som visar bindningsparen som linjer kan du hitta en av två versioner.
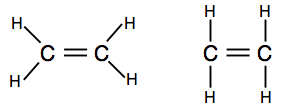
den första visar molekylens faktiska form bättre, men den andra är också helt acceptabel på denna nivå.
vart vill du gå nu?
till nästa sida i detta avsnitt om kovalent bindning . . .
till menyn atomstruktur och bindning . . .
till kemi 14-16-menyn . . .
till Chemguide Huvudmeny . . .