Vad är jonbindning?
kemiska bindningar bildas när den totala energin hos de bundna atomerna är lägre än den totala energin hos de separata atomerna.Formen bindningen tar bestäms av elektronarrangemanget som minimerar energin.
i vissa fall delas elektroner mellan atomer – detta kallas kovalent bindning.
i andra fall finns det en fullständig överföring av en eller flera elektroner från en atom till en annan.Atomen som förlorar elektroner blir en positivt laddad jon.Atomen som tar emot elektroner blir en negativt laddad jon.
detta leder till jonbindning – den ömsesidiga elektrostatiska attraktionen av positiva och negativa charges.In dess renaste form, jonbindning är inte riktad. Det kan betraktas som enkel Coulombic attraktion mellan punkt avgifter.Detta skiljer sig från kovalent bindning, där delningen av elektroner resulterar i riktningsbindningar.
elektronöverföring
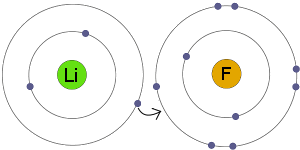
Li överför en elektron till F. resultatet är att båda de resulterande jonerna bli elektriskt laddad och har kompletta, stabila elektronskal.
elektrostatisk attraktion
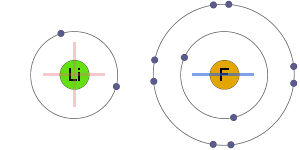
positiva och negativa joner lockas elektrostatiskt till varandra, vilket resulterar i en jonbindning.
den coulombiska kraften har ingen föredragen riktning, med resultatet att joniska föreningar tenderar att existera som jätte kristallgitterstrukturer av joner packade ihop.
ett prov av Litiumfluoridens kristallgitter

elektronegativitet och jonbindning
två element tenderar att binda joniskt när de skiljer sig mycket i elektronegativitet.
periodisk tabell över elektronegativitet
ju ljusare skuggan av grönt, desto högre elektronegativitet. Grå betyder att inget värde är känt. (Klicka på bilden för större bild.)

kovalent Bindningstecken
absolut rena joniskt bundna föreningar existerar inte riktigt, eftersom den positivt laddade Jonen polariserar den negativa jonens elektronmoln.Detta är särskilt märkbart när man hanterar små, högladdade metalljoner som Al3+, även om den polariserande effekten är närvarande i viss utsträckning i alla joniska föreningar.Polarisering är effektivt en riktningselektrondelningseffekt, varför den introducerar en liten mängd kovalens i joniska föreningar.
andelen jonisk / kovalent beteende i en bindning kan mycket grovt bedömas med hjälp av Pauling-skalan av elektronegativitet.Linus Pauling uppskattade att en elektronegativitetsskillnad på 1,7 mellan element leder till bindning som är 50 procent jonisk.
värden under 1 motsvarar kovalent bindning dominerande och värden över 2 till jonbindning dominerande.
Electronegativity of Selected Elements (Pauling Scale)
| Element | Electronegativity |
|---|---|
| hydrogen | 2.20 |
| lithium | 0.98 |
| sodium | 0.93 |
| aluminum | 1.61 |
| carbon | 2.55 |
| oxygen | 3.44 |
| chlorine | 3.16 |
| iodine | 2.66 |
C-H-bindningen med en skillnad på 0,35 kommer att vara kovalent, medan NaCl-bindning vid 2,23 kommer att vara jonisk.HCl-bindning vid 0,96 kommer att vara polär kovalent och LiI-bindning vid 1,68 kommer att vara 50/50 jonisk/kovalent.
den största elektronegativitetsskillnaden är 3,19, mellan cesium (0,79) och fluor (3,98). Den resulterande bindningen är cirka 95 procent jonisk i karaktär.
