Antiaromatiska föreningar är ovanligt instabila
vilka är de viktigaste faktorerna som avgör om en molekyl är antiaromatisk?
i våra tidigare inlägg i vår serie om aromaticitet, såg vi att aromatiska molekyler är ovanligt stabila. De har särskilt stora resonansenergier, tenderar att genomgå substitution snarare än tillsatsreaktioner och har delokaliserat pi-elektroner (alla C-C-bindningslängder i bensen är till exempel lika).
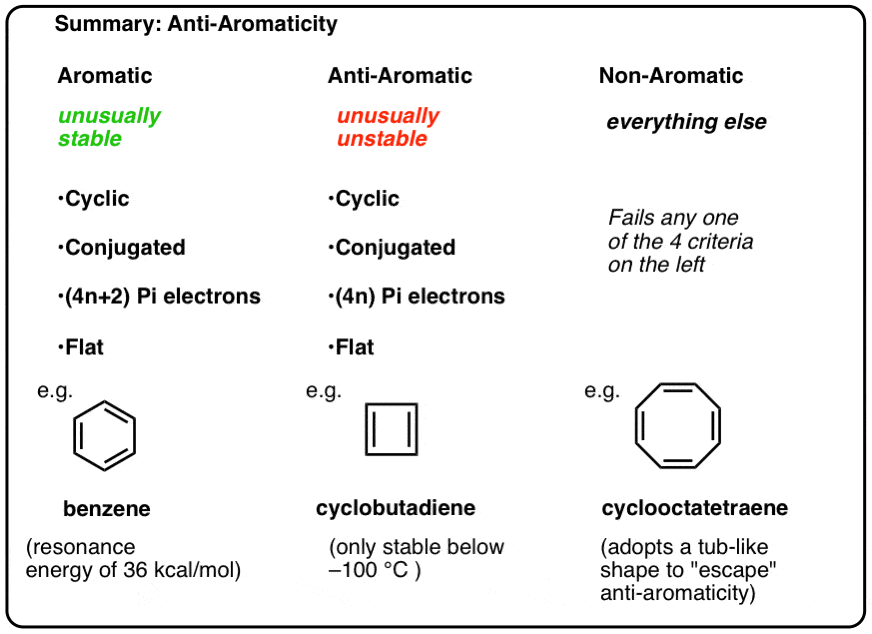
för att vara aromatisk måste en molekyl ha följande fyra strukturella egenskaper:
- cyklisk
- konjugerad runt ringen
- har pi-elektroner
- Platt (Plan)
om dessa fyra villkor är uppfyllda är molekylen aromatisk.
om det flunkar till och med en fråga på testet är det icke-aromatiskt.
det verkar vara ganska tydligt. Eller är det?
Du kan gissa från hur jag ramar in den här frågan att svaret är ”inte riktigt”. :- )
Innehållsförteckning
- vissa molekyler är så spektakulärt och ovanligt instabila och svåra att isolera att de förtjänar sin egen kategori: Antiaromatisk
- Cyklopentadienylkatjon: den ”Resonansstabiliserade” Karbokationen som inte är stabil
- Antiaromatiska Treledade ringar: Oxiren, 1h-Aziren, Tiiren
- Cyklobutadien är Antiaromatisk
- ett 8 pi-elektronexempel på en Antiaromatisk förening: Pentalen
- Vad gör en molekyl Anti-aromatisk?
- Cyclooctatetraene ”flyr” Anti-aromaticitet genom vridning av planhet
- slutsats: Antiaromatiska föreningar
- anteckningar
- Avancerat: referenser och vidare läsning
1. Spektakulärt instabila molekyler som bildar en kategori för sig själva:”Anti-aromatisk”
här är saken. Det finns ett litet antal molekyler som flunkar aromaticitetstestet som inte bara är icke-aromatiskt: de har egenskapen att vara så spektakulärt och ovanligt instabila och svåra att isolera att de förtjänar ett annat namn.
vi kallar dessa molekyler”Anti-aromatiska”.
vad som är intressant är att molekylerna i många fall inte ser ut att vara särskilt instabila från första principerna, i motsats till, säg, cubane. Roligt nog, du kan köpa cubane (mer eller mindre) från Aldrich, men de flesta av de anti-aromatiska molekylerna vi diskuterar nedan är bara stabila vid extremt låga temperaturer – om de alls kan isoleras!
2. Cyklopentadienylkatjon: Den ”Resonansstabiliserade” Karbokokationen som inte är stabil
Låt oss börja vår resa ner i kaninhålet med ett enkelt exempel som borde verka bekant från första terminens organiska Kemi.
Kom ihåg SN1-reaktionen? Katten som lämnar den bekväma stolen först?
snabb granskning: börja med en alkylhalogenid. Lämnar gruppblad, bildar en karbokalisering. Nukleofila attacker. Det kallas SN1 eftersom det hastighetsbestämmande steget (karbokokationsbildning) är unimolekylärt. Bottom line: ju stabilare karbokokationen desto snabbare fortsätter reaktionen. Därför är reaktionshastigheten för alkylhalogenider tertiär > sekundär > primär, och karbokationen får speciella bonuspoäng om den stabiliseras av resonans.
titta på dessa två SN1-reaktioner. Vilken tror du skulle hända snabbare – SN1-reaktionen som går igenom en sekundär karbokalisering (a) eller SN1-reaktionen som går igenom en sekundär karbokalisering och kan bilda flera resonansformer (B)?
från allt du har lärt dig hittills kan du förvänta dig att svaret är B).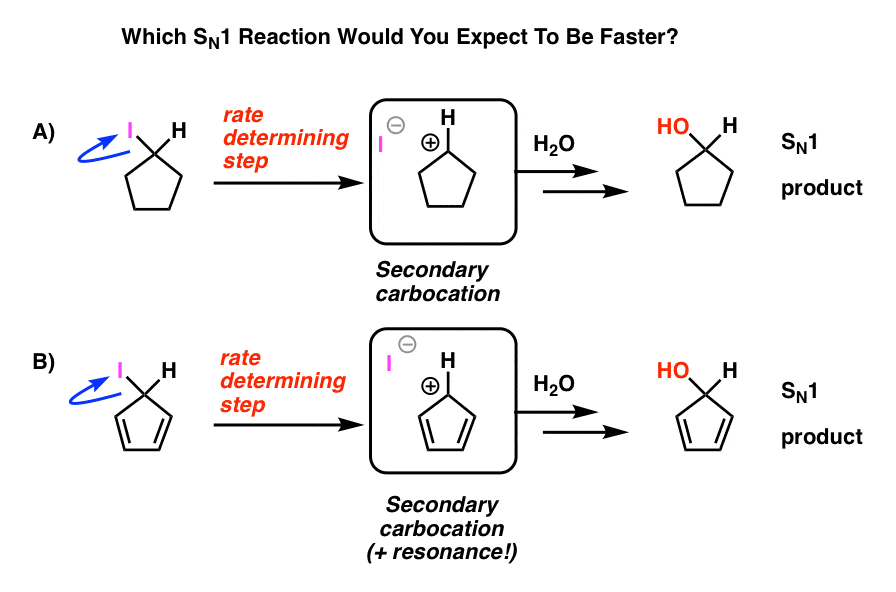
det är det inte.
svaret är att reaktion a) händer snabbare. Reaktion B händer inte alls.
detta borde slå dig så djupt konstigt.
det är!
hur är det att denna förmodligen resonansstabiliserade karbokalisering är mindre stabil än en sekundär karbokalisering?
När allt kommer omkring, hur många gånger borras det i ditt huvud som resonans stabiliserar molekyler, särskilt karbokationer?
men här verkar det vara destabiliserande. Det är … det är …

men instabil det är! Cyklopentadienylkatjonen är oerhört instabil och svår att göra – och det är inte brist på försök. Det är något väldigt konstigt med strukturen hos cyklopentadienylkatjonen som ger den ovanlig instabilitet.

cyklisk, konjugerad, platt…. och har 4 pi-elektroner. Intressant!
3. Antiaromatiska Treledade ringar: Oxiren, 1h-Aziren, Tiiren
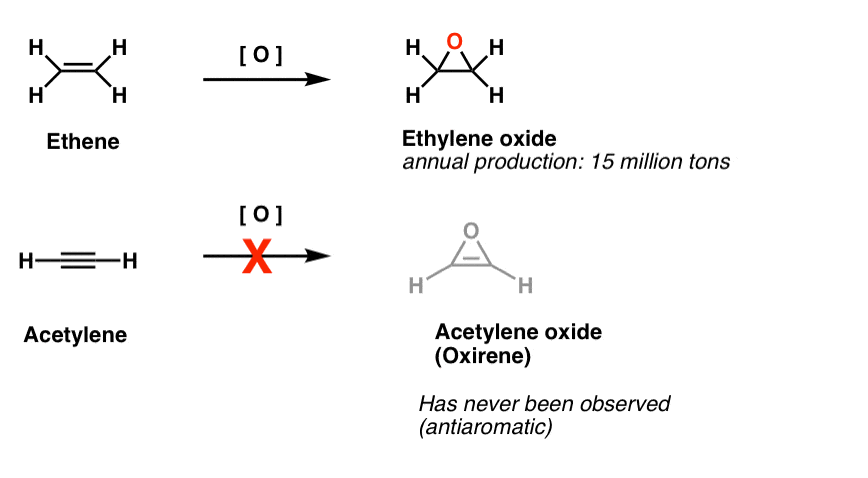
en annan klass av ”Elusiva” molekyler är en familj av treledade ringar. Du kanske kommer ihåg från Org 1 att det är lätt att göra epoxider från alkener med en oxidant som m-CPBA.
har du någonsin undrat varför vi aldrig täckte samma reaktion för alkyner?
Tja, det är inte för brist på försök. Kemister har försökt alla typer av metoder för epoxidering av alkyner, och vet du vad? Reaktionen fungerar bara inte.
till exempel skulle epoxidation av acetylen ge molekylen nedan (oxiren).
Oxirene själv har aldrig observerats, även om det finns tantaliserande spår av dess flyktiga existens. Och förresten har varken kväveanalogen, 1H-aziren eller tiirenen.
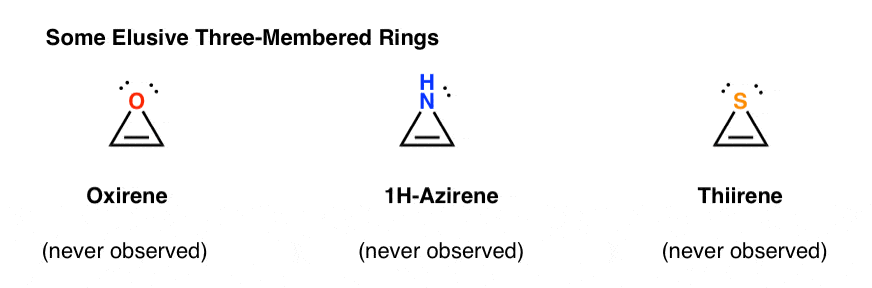
varför inte? Vad är speciellt med vart och ett av dessa fall?
Du kanske märker att dessa molekyler, liksom cyklopentadienylkatjonen, är cykliska, konjugerade, platta och har 4 pi-elektroner (två i pi-bindningen och två från ett ensamt par).
OK. Vad mer kan vara cykliskt, konjugerat, platt och ha 4 pi-elektroner?
4. Cyklobutadien är Antiaromatisk
Cyklobutadien ser ut som en enkel nog molekyl, men det syntetiserades faktiskt inte förrän 1965. Och även då visade det sig att det inte är stabilt vid temperaturer över 35 Kelvin.
frågan är, varför?

Visst, det är en fyrledad ring, och ja, den har mycket ringstam, men mer ansträngda molekyler har gjorts som faktiskt är stabila vid rumstemperatur.
Du kan också notera att liksom ovanstående exempel är cyklobutadien ett annat exempel på en molekyl som är cyklisk, konjugerad, har 4 pi-elektroner och är platt.
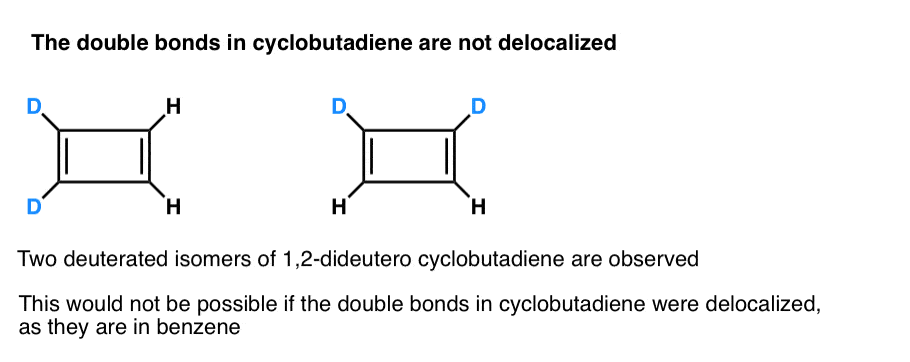
vad som är ännu mer intressant är vad man lärde sig om cyklobutadiens geometri. I stället för att vara en molekyl med identiska bindningslängder (som bensen) befanns cyklobutadien ha en rektangulär form, vilket indikerar att elektronerna inte delokaliserades.
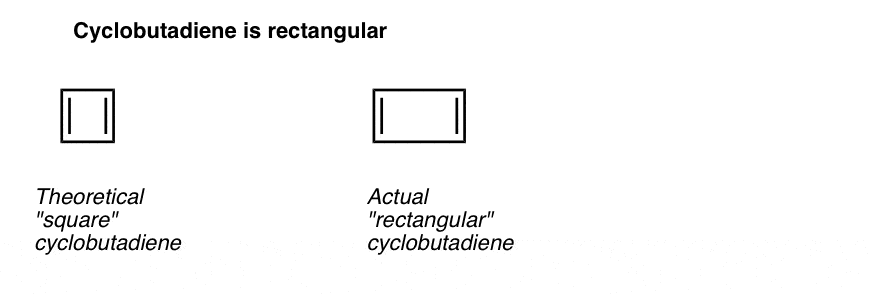
vad detta säger oss är att även när en molekyl uppfyller alla villkor (cykliska, konjugerade, platta, 4 pi-elektroner) är den symmetriska geometrin särskilt instabil. . Mycket intressant!
ett 8 Pi-Elektronexempel på en Antiaromatisk förening: Pentalen
hittills hade alla exempel vi hittills sett 4 pi-elektroner. Du kanske undrar: finns det några exempel på anti-aromatiska molekyler som har mer än 4 pi-elektroner? Varför, ja.
molekylen nedan kallas”Pentalen”. Den har syntetiserats, men är endast stabil under -100 C. över denna temperatur kombineras den med en annan molekyl av sig själv (referens). Ett annat exempel på spektakulär instabilitet.

Pentalen har 8 pi-elektroner. Detta kan utlösa några larmklockor av erkännande. Kom ihåg hur antalet Pi-elektroner i aromatiska molekyler följde sekvensen (2, 6, 10, 14….) ?
detta exempel antyder att antalet Pi-elektroner i anti-aromatiska molekyler följer sekvensen (4, 8, 12…)
Vad gör en molekyl Antiaromatisk?
Så vad har alla dessa molekyler i detta rogues galleri gemensamt?
var och en av dem är cyklisk, konjugerad och platt – och när du räknar antalet Pi-elektroner är det multiplar av 4. Så medan aromatiska molekyler har (4n+2) pi-elektroner är ”regeln” för anti-aromatiska molekyler (4n). (ett annat sätt att titta på det: antalet Pi-elektroner kommer att vara två gånger ett jämnt antal).
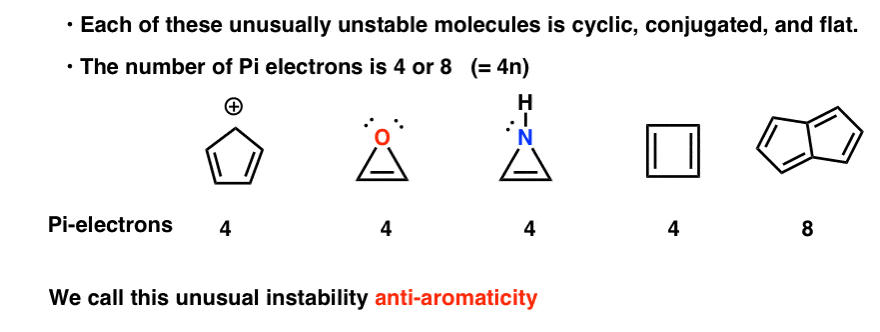
denna ovanliga instabilitet kallas”anti-aromaticitet”.
detta innebär att vi nu kan utarbeta tre kategorier för molekyler enligt följande kriterier:
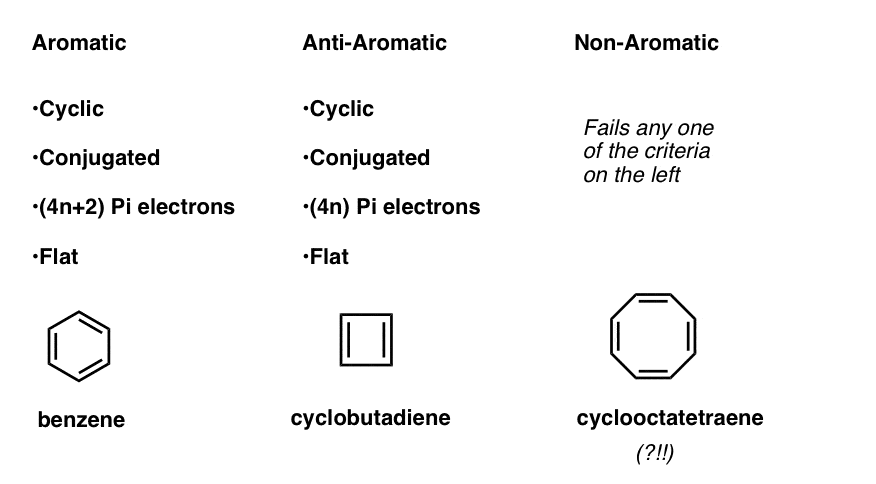
- aromatiska molekyler är cykliska, konjugerade, har (4n+2) pi-elektroner och är plana.
- Anti-aromatiska molekyler är cykliska, konjugerade, har (4n) pi-elektroner och är plana.
- icke-aromatiska molekyler är alla andra molekyler som misslyckas med ett av dessa tillstånd.
vänta en sekund – du kanske undrar varför cyklooktatetraen klassificeras som”icke-aromatisk”. Med 8 pi-elektroner (två gånger ett jämnt antal) borde det inte vara ”anti-aromatiskt”?
Cyclooctatetraene ”flyr” Anti-aromaticitet genom att vrida ut ur planhet
Tänk på att uppfylla villkoren för ”anti-aromaticitet” som lite som att kvalificera sig för en extremt straffande inkomstskatt. Med tanke på möjligheten att hitta ett smutthål för att komma ur skatten, skulle du göra det? Förmodligen.
Cyklooktatetraen är antiaromatisk endast om den är platt. Den relativt ”floppy” strukturen hos cyklooctatetraene möjliggör emellertid viss flexibilitet. Bindningarna kan rotera bort från planhet så att molekylen antar en ”tubliknande” form och därigenom undviker ”antiaromaticitetsskatten” på 18 12 kcal/mol som skulle betalas om alla p-orbitaler på molekylen konjugerades med varandra.
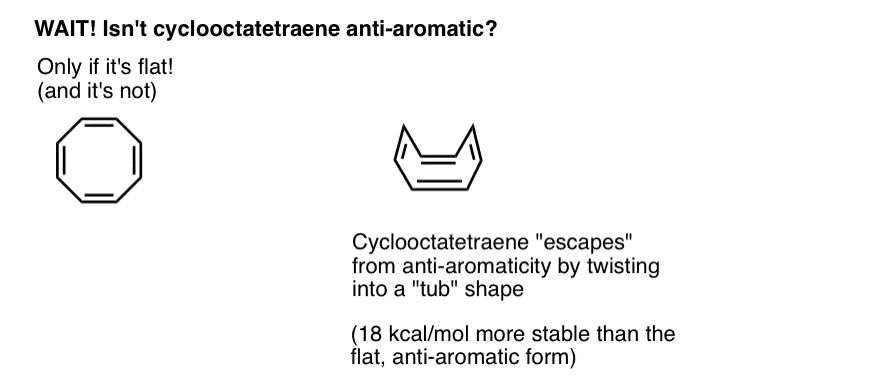
det visar sig att cyklooktatetraen har syntetiserats, är stabil (du kan köpa den här, till exempel) och beter sig som en” normal ” Alken, genomgår tillsatsreaktioner, hydrogenering och så vidare.
Pentalen (ovan) som också har 8 pi-elektroner, har en mycket styv bicyklisk struktur som förhindrar bindningsrotation bort från planhet. Därför sitter den fast i sin anti-aromatiska konformation.
Anti-aromaticitet för molekyler med mer än 8 pi-elektroner är känd, men mycket ovanlig. (Här är ett roligt exempel på en annan ”flykt” från aromaticitet för en molekyl med 18 pi-elektroner.)
slutsats: Antiaromatiska föreningar
hittills har vår behandling av aromaticitet och antiaromaticitet varit rent beskrivande och empirisk. Vi har visat massor av exempel, och gett massor av regler, men saknas i diskussionen har varit någon djup förklaring av ”varför”.
vad är så speciellt med bensenringen som gör den så stabil? Varför är det stabilt?
vad är så speciellt med cyklobutadiensystemet som gör det så instabilt. Varför är det instabilt?
För att kunna svara på dessa djupare frågor måste vi gå tillbaka och undersöka molekylära orbitaler av dessa två molekyler och sedan komma till en djupare förståelse av aromaticitet och anti-aromaticitet.
det är vad vi ska göra i vårt nästa inlägg.
Tack till Matthew Knowe för hjälp med att förbereda detta inlägg.
anmärkningar
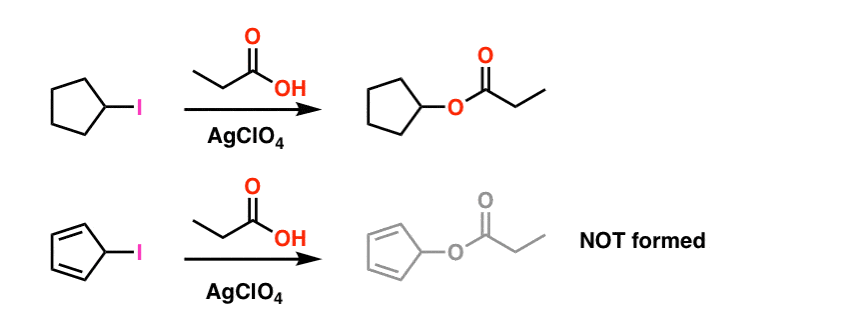
fotnot 1. För enkelhetens skull fudges bilden som visas i huvudartikeln på de faktiska reaktionsförhållandena. De faktiska experimentella förhållandena visas nedan. Lösningsmedlet är propionsyra, och Lewis syra silverperklorat tillsätts för att hjälpa till med att dra av jod. .
även under dessa förhållanden bildas inte cyklopentadienylkarbokationen, vilket är ett bevis på dess extrema instabilitet.
fotnot 2. Epoxidation på eten (aka etylen) görs till ett belopp av 15 miljoner ton, årligen. Epoxidering av acetylen för att bilda oxiren är okänd.
flyktiga bevis på förekomsten av oxirener har hittats. Det finns goda bevis från isotopmärkningsstudier att oxirener är flyktiga mellanprodukter i vissa Wolff-omarrangemang. Det finns också två exempel på oxirener som har fångats vid extremt låg temperatur, men sönderdelats över 35 Kelvin.
den flyktiga existensen av en 1H-azirin har postulerats vid tillsats av en nitren till en acetylen, som snabbt omarrangeras till en (stabil) 2h-aziren (nedan).
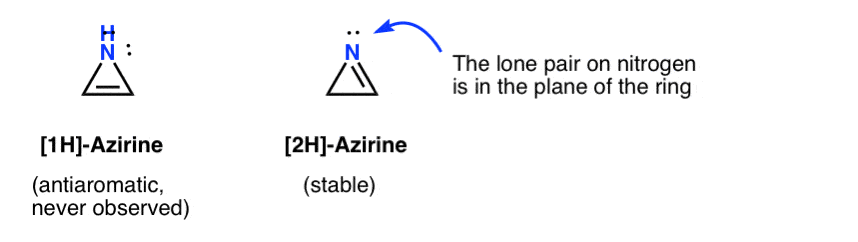
Observera att i 2h-aziren är det ensamma paret på kvävet i rät vinkel mot pi-systemet, så detta system är icke-aromatiskt i motsats till antiaromatiskt.
För mer diskussion, se Mars avancerade organiska Kemi. Jag har arbetat utanför den 5: e upplagan, sidorna 62-63.
. Fotnot 3. Ett mycket smart experiment bestämde att 1,2-dideutero cyklobutadien har två isomerer, inte en (se nedan). Detta indikerar att dubbelbindningarna i cyklobutadien inte delokaliseras som de är i bensen, men är mer som dubbelbindningar i en konventionell Dien.
Cyklobutadien reagerar med sig själv vid 35 K för att bilda en ”dimer”, i ett exempel på en Diels-Al-reaktion.
fotnot 4. Ja, det är sant att det ensamma paret i azirene kan sättas in i en sp3-hybridbana (nedan). Detta minskar sannolikt det anti-aromatiska” straffet ” något, men molekylen är fortfarande otroligt instabil. Anti-aromaticitet är det enklaste sättet att redogöra för detta.

fotnot 5. Den rektangulära geometrin beror på en effekt som kallas Jahn-Teller-effekten. Kom ihåg Pauli-uteslutningsprincipen, där elektroner inte kan ha samma kvantnummer? Tja, som vi ser när vi tittar på molekylär orbitaldiagrammet för cyklobutadien, har ”kvadratisk” cyklobutadien två ”degenererade” elektroner, dvs de har samma energier och kvantantal. Detta leder till ett fenomen som kallas ”Pauli repulsion”, där förlängning av bindningarna inträffar tills energinivåerna för de två elektronerna är differentierade. Definitivt ett avancerat ämne.
(avancerade) referenser och vidare läsning
- övergång-Tillståndsspektroskopi av Cyklooktatetraen
Paul G. Wenthold, David A. Hrovat, Weston T. Borden, W. C. Lineberger.
vetenskap, 1996, 272, 1456-1459.
DOI: 10.1126 / vetenskap.272.5267.1456
Denna studie är grunden för uttalandet att det icke-aromatiska marktillståndet för cyklooktatetraen är 12 kcal/mol under den ”antiaromatiska” konformationen. - tämja Cyklobutadien
Donald J. Cram, Martin E. Tanner, Robert Thomas
Chem. Int. Ed. 1991, 30 (8), 1024-1027
DOI: 10.1002/anie.199110241
Detta dokument av nobelpristagaren Prof. Donald J. Cram (UCLA) beskriver den första spektroskopiska karaktäriseringen av cyklobutadien. Detta uppnås genom att omsluta föregångaren i en hemicarcerand (burkomplex) och sedan bestråla den med UV-ljus, vilket skapar cyklobutadien, som inte kan göra någonting eftersom det är fångat. - Cyklobutadien
Thomas Bally, Satoru Masamune
Tetrahedron 1980, 36 (3), 343-370
DOI: 1016/0040-4020(80)87003-7
detta dokument från 1980 granskar arbete på cyklobutadien fram till den tiden. Detta är indelat i 2 delar – experimentella syntetiska ansträngningar och teoretiska beräkningar. - tetraeder och Cyklobutadien
g Oxignther Maier
Chem. Int. Ed. 1988, 27 (3), 309-332
DOI: 10.1002/anie.198803093
Denna uppsats granskar syntetiska ansträngningar mot tetraeder och cyklobutadien – båda molekylerna har en formel av C4H4. Endast substituerade (tetra t-butyl och tetra trimetylsilyl) tetraeder har framgångsrikt syntetiserats och isolerats hittills. - Cyklobutadien-och Bensocyklobutadien-Järntrikarbonylkomplex
F. Emerson, L. Watts och R. Pettit
Journal of the American Chemical Society 1965, 87 (1), 131-133
DOI: 10.1021/ja01079a032 - Cyklobutadieneiron Trikarbonyl. Ett nytt aromatiskt System
D. Fitzpatrick, L. Watts, G. F. Emerson och R. Pettit Journal of the American Chemical Society 1965, 87 (14), 3254-3255
DOI: 10.1021/ja01092a050
ett bonusämne: cyklobutadien kan stabiliseras med metaller – det organometalliska komplexet cyklobutadienjärntrikarbonyl är ett stabilt, kristallint fast ämne. Som författarna nämner är det osannolikt att fri cyklobutadien genereras i syntesen. - https://www.asu.edu/courses/chm233/notes/aromatic/aromaticRL1/antiaromatic.html
det antipsykotiska olanzapinet antar en ”fjäril” – form för att undvika antiaromatiska effekter, liknande cyklooktatetraen. Detta är uppenbarligen avgörande för dess funktion. - Antiaromaticitet
Ronald Breslow
redogörelser för kemisk forskning 1973, 6 (12), 393-398
DOI: 1021/ar50072a001
intressant nog säger Prof.Breslow (Columbia) i detta konto att han var personen som först föreslog termen ”antiaromatisk” för särskilt destabiliserade cykliska föreningar med 4N p-elektroner. Han citerar också annat arbete av Prof. M. J. S. Dewar och andra där den antiaromatiska destabiliseringen av cyklobutadien beräknas vara mellan 18-33 kcal/mol relativt linjär butadien. - experimentell bestämning av Cyklobutadiens Antiaromaticitet
Ashok A. Deniz, Kevin S. Peters, Gary J. Snyder
vetenskap 1999, 286 (5442), 1119-1122
DOI: 1126/vetenskap.286.5442.1119
Detta är ett mycket rigoröst papper som använder nya spektroskopiska tekniker för att bestämma antiaromatisk destabilisering av cyklobutadien. I förhållande till en hypotetisk stamlös, konjugerad dienreferens destabiliseras cyklobutadien med totalt 87 kcal/mol, varav 32 kcal/mol kan hänföras till ringstam och 55 kcal/mol till antiaromaticitet (jämfört med 21 kcal/mol för aromatisk stabilisering av bensen). - Osubstituerad cyklopentadienylkation, en marktriplett
Saunders, R. Berger, A. Jaffe, J. M. McBride, J. O ’ Neill, R. Breslow, J. M. Hoffmann, C. Perchonock, E. Wasserman, R. S. Hutton, V. J. Kuck
Journal of the American Chemical Society 1973, 95 (9), 3017-3018
doi: 10.1021 / ja00790a049
cyklopentadienylkatjonen kan endast förberedas med svårigheter, som detta dokument beskriver. När den väl har bildats har den ett triplett elektroniskt marktillstånd (med 2 oparade elektroner) och kan karakteriseras av EPR (elektron paramagnetisk resonans) spektroskopi. - Oxirenes
Errol G. Lewars
kemiska recensioner 1983, 83( 5), 519-534
DOI: 10.1021 / cr00057a002