periodiska trender och lösningsmedelseffekter i nukleofilicitet
det finns förutsägbara periodiska trender i nukleofilicitet. När man rör sig horisontellt över tabellens andra rad parallellerar trenden i nukleofilicitet trenden i basicitet:
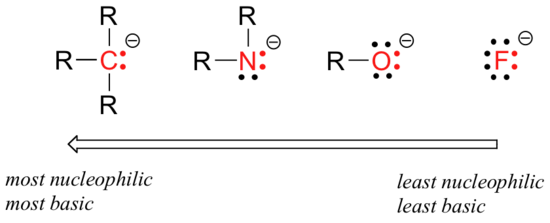
resonemanget bakom den horisontella nukleofilicitetstrenden är detsamma som resonemanget bakom basicitetstrenden: fler elektronegativa element håller sina elektroner tätare och kan mindre donera dem för att bilda en ny bindning.
dessa horisontella trender berättar också att aminer är mer nukleofila än alkoholer, även om båda grupperna vanligtvis fungerar som nukleofiler i både laboratorie-och biokemiska reaktioner.
minns att atomernas basicitet minskar när vi rör oss vertikalt ner en kolumn i det periodiska bordet: tiolatjoner är till exempel mindre basiska än alkoxidjoner, och bromidjon är mindre basisk än kloridjon, vilket i sin tur är mindre basisk än fluoridjon. Minns också att denna trend kan förklaras genom att överväga den ökande storleken på ’elektronmoln’ runt de större jonerna: elektrondensiteten som är inneboende i den negativa laddningen sprids runt ett större område, vilket tenderar att öka stabiliteten (och därmed minska basiciteten).
den vertikala periodiska trenden för nukleofilicitet är något mer komplicerad än för basicitet: beroende på lösningsmedlet som reaktionen äger rum i kan nukleofilicitetstrenden gå i båda riktningarna. Låt oss ta det enkla exemplet på SN2-reaktionen nedan:
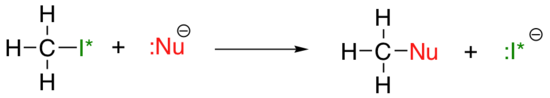
. . .där Nu – är en av halidjonerna: fluor, klorid, bromid eller jodid, och den lämnande gruppen i* är en radioaktiv isotop av jod (vilket gör att vi kan skilja den lämnande gruppen från nukleofilen i det fallet där båda är jodid). Om denna reaktion förekommer i ett protiskt lösningsmedel (det vill säga ett lösningsmedel som har ett väte bundet till ett syre eller kväve – vatten, metanol och etanol är de viktigaste exemplen), kommer reaktionen att gå snabbast när jodid är nukleofilen och långsammaste när fluor är nukleofilen, vilket återspeglar nukleofilens relativa styrka.

relativ nukleofilicitet i ett protiskt lösningsmedel
detta är naturligtvis motsatt den vertikala periodiska trenden för basicitet, där jodid är minst grundläggande. Vad händer här? Borde inte den starkare basen, med sina mer reaktiva obundna valenselektroner, också vara den starkare nukleofilen?
Som nämnts ovan har allt att göra med lösningsmedlet. Kom ihåg att vi pratar nu om reaktionen som körs i ett protiskt lösningsmedel som etanol. Protiska lösningsmedelsmolekyler bildar mycket starka Jon-dipolinteraktioner med den negativt laddade nukleofilen, vilket i huvudsak skapar en”lösningsmedelsbur”runt nukleofilen:

för att nukleofilen ska attackera elektrofilen måste den bryta sig loss, åtminstone delvis, från dess lösningsmedelsbur. De ensamma parelektronerna på den större, mindre basiska jodidjonen interagerar mindre tätt med protonerna på de protiska lösningsmedelsmolekylerna – sålunda kan jodidnukleofilen bättre bryta sig loss från sin lösningsmedelsbur jämfört med den mindre, mer basiska fluoridjonen, vars ensamma parelektroner är bundna tätare till protonerna i buret.
bilden ändras om vi byter till ett polärt aprotiskt lösningsmedel, såsom aceton, där det finns en molekylär dipol men inga väten bundna till syre eller kväve. Nu är fluor den bästa nukleofilen och jodid den svagaste.
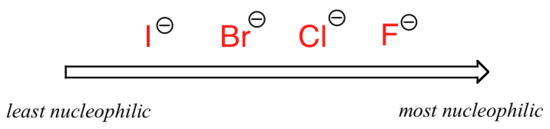
relativ nukleofilicitet i ett polärt aprotiskt lösningsmedel
orsaken till reverseringen är att Jon-dipol-interaktionerna mellan lösningsmedel och lösningsmedel med ett aprotiskt lösningsmedel nukleofilen är mycket svagare: den positiva änden av lösningsmedlets dipol är dold i molekylens inre och sålunda skyddas den från nukleofilens negativa laddning.
en svagare lösningsmedel-nukleofil interaktion innebär en svagare lösningsmedelsbur för nukleofilen att bryta igenom, så lösningsmedelseffekten är mycket mindre viktig, och den mer grundläggande fluoridjonen är också den bättre nukleofilen.
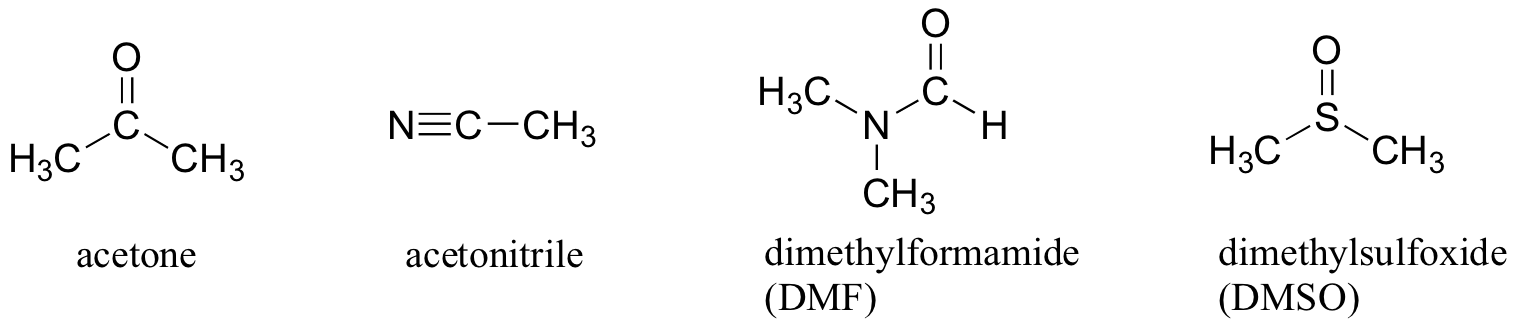
varför inte använda ett helt icke-polärt lösningsmedel, såsom hexan, för denna reaktion, så att lösningsmedelsburet elimineras helt? Svaret på detta är enkelt – nukleofilen måste vara i lösning för att reagera med en märkbar hastighet med elektrofilen, och ett lösningsmedel som hexan kommer inte att lösa en a-laddad (eller mycket polär) nukleofil alls. Därför använder kemister polära aprotiska lösningsmedel för nukleofila substitutionsreaktioner i laboratoriet: de är polära nog att lösa nukleofilen, men inte så polära att de låser den i en ogenomtränglig lösningsmedelsbur. Förutom aceton är tre andra vanliga polära aprotiska lösningsmedel acetonitril, dimetylformamid (DMF) och dimetylsulfoxid (DMSO).
I biologisk kemi, där lösningsmedlet är protiskt (vatten), är den viktigaste implikationen av de periodiska trenderna i nukleofilicitet att tioler är kraftfullare nukleofiler än alkoholer. Tiolgruppen i en cysteinaminosyra är till exempel en kraftfull nukleofil och fungerar ofta som en nukleofil i enzymatiska reaktioner, och naturligtvis är negativt laddade tiolater (RS -) ännu mer nukleofila. Detta är inte att säga att hydroxylgrupperna på serin, treonin och tyrosin inte också fungerar som nukleofiler – de gör det.