Video \(\PageIndex{1}\): en kort introduktion till Mendeleevs geni.
när tidiga kemister arbetade för att rena malmer och upptäckte fler element insåg de att olika element kunde grupperas tillsammans med deras liknande kemiska beteenden. En sådan gruppering innefattar litium (Li), natrium( Na) och kalium (K): Dessa element är alla glänsande, leder värme och El väl och har liknande kemiska egenskaper. En andra gruppering inkluderar kalcium (Ca), strontium (Sr) och barium (Ba), som också är glänsande, bra ledare av värme och el och har kemiska egenskaper gemensamt. De specifika egenskaperna hos dessa två grupperingar skiljer sig emellertid särskilt från varandra. Till exempel: Li, Na och K är mycket mer reaktiva än Ca, Sr och Ba; Li, Na och K bildar föreningar med syre i ett förhållande av två av deras atomer till en syreatom, medan Ca, Sr och Ba bildar föreningar med en av deras atomer till en syreatom. Fluor (F), klor (Cl), brom (Br) och jod (i) uppvisar också liknande egenskaper till varandra, men dessa egenskaper skiljer sig drastiskt från de hos något av elementen ovan.
Dimitri Mendeleev i Ryssland (1869) och Lothar Meyer i Tyskland (1870) erkände självständigt att det fanns ett periodiskt förhållande mellan egenskaperna hos de element som var kända vid den tiden. Båda publicerade tabeller med elementen ordnade enligt ökande atommassa. Men Mendeleev gick ett steg längre än Meyer: han använde sitt bord för att förutsäga förekomsten av element som skulle ha egenskaper som liknar aluminium och kisel, men var ännu okända. Upptäckterna av gallium (1875) och germanium (1886) gav stort stöd för Mendeleevs arbete. Även om Mendeleev och Meyer hade en lång tvist om prioritet, Mendeleevs bidrag till utvecklingen av det periodiska systemet är nu mer allmänt erkända (figur \(\PageIndex{1}\)).
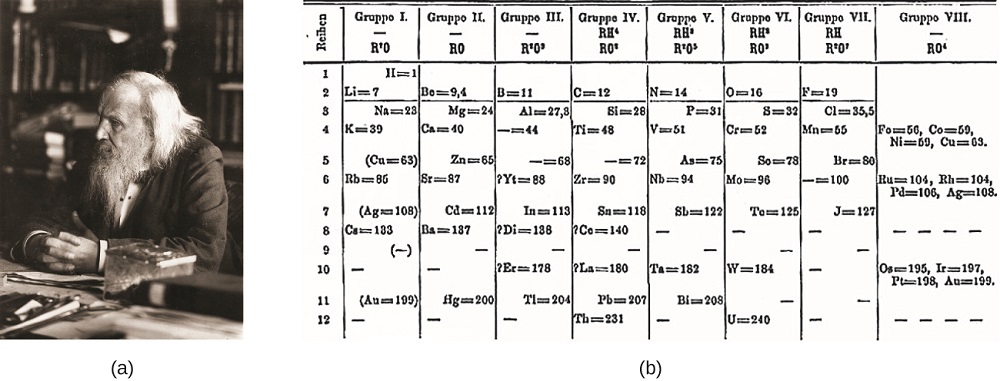
figur \(\PageIndex{1}\): (a) Dimitri Mendeleev är allmänt krediteras med att skapa (b) den första periodiska systemet av elementen. (kredit a: modifiering av arbete av Serge Lachinov; kredit b: modifiering av arbete av ”den fj sirattrade ankan”/Wikimedia Commons)
Video \(\PageIndex{2}\): En introduktion till organisationen av det periodiska systemet i perioder och grupper. Denna organisation kommer att vara viktig när vi fortsätter att bygga på principerna om kemi.
vid det tjugonde århundradet blev det uppenbart att det periodiska förhållandet involverade atomnummer snarare än atommassor. Det moderna uttalandet om detta förhållande, den periodiska lagen, är följande: elementens egenskaper är periodiska funktioner hos deras atomnummer. Ett modernt periodiskt bord ordnar elementen i ökande ordning av deras atomnummer och grupper atomer med liknande egenskaper i samma vertikala kolumn (figur \(\PageIndex{2}\)). Varje ruta representerar ett element och innehåller dess atomnummer, symbol, Genomsnittlig atommassa och (ibland) namn. Elementen är ordnade i sju horisontella rader, kallade perioder eller serier, och 18 vertikala kolumner, kallade grupper. Grupper är märkta högst upp i varje kolumn. I USA var etiketterna traditionellt siffror med stora bokstäver. IUPAC rekommenderar dock att siffrorna 1 till 18 används, och dessa etiketter är vanligare. För att tabellen ska passa på en enda sida skrivs vanligtvis delar av två av raderna, totalt 14 kolumner, under tabellens huvuddel.

figur \(\PageIndex{2}\): element i det periodiska systemet är organiserade enligt deras egenskaper.
många element skiljer sig dramatiskt i sina kemiska och fysikaliska egenskaper, men vissa element liknar deras beteenden. Till exempel verkar många element glänsande, är formbara (kan deformeras utan att bryta) och duktila (kan dras in i ledningar) och leda värme och El väl. Andra element är inte glänsande, formbara eller duktila och är dåliga ledare av värme och El. Vi kan sortera elementen i stora klasser med gemensamma egenskaper: metaller (element som är glänsande, formbara, bra ledare av värme och El—skuggad gul); nonmetals( element som verkar tråkiga, dåliga ledare av värme och El—skuggad grön); och metalloider (element som leder värme och El måttligt bra och har vissa egenskaper hos metaller och vissa egenskaper hos icke—metaller-skuggad lila).
elementen kan också klassificeras i huvudgruppselementen (eller representativa element) i kolumnerna märkta 1, 2 och 13-18; övergångsmetallerna i kolumnerna märkta 3-12; och inre övergångsmetaller i de två raderna längst ner i tabellen (de översta radelementen kallas lantanider och de nedre radelementen är aktinider; figur \(\PageIndex{3}\)). Elementen kan delas vidare med mer specifika egenskaper, såsom sammansättningen av de föreningar de bildar. Exempelvis bildar elementen i Grupp 1 (den första kolumnen) föreningar som består av en atom av elementet och en väteatom. Dessa element (utom väte) är kända som alkalimetaller, och de har alla liknande kemiska egenskaper. Elementen i Grupp 2 (den andra kolumnen) bildar föreningar som består av en atom av elementet och två atomer av väte: dessa kallas jordalkalimetaller, med liknande egenskaper bland medlemmar i den gruppen. Andra grupper med specifika namn är pnictogener (Grupp 15), kalkogener (grupp 16), halogener (Grupp 17) och ädelgaserna (Grupp 18, även känd som inerta gaser). Grupperna kan också hänvisas till av gruppens första element: till exempel kan kalkogenerna kallas syregruppen eller syrefamiljen. Väte är ett unikt, icke-metalliskt element med egenskaper som liknar både grupp 1 och Grupp 17 element. Av den anledningen kan väte visas högst upp i båda grupperna, eller av sig själv.
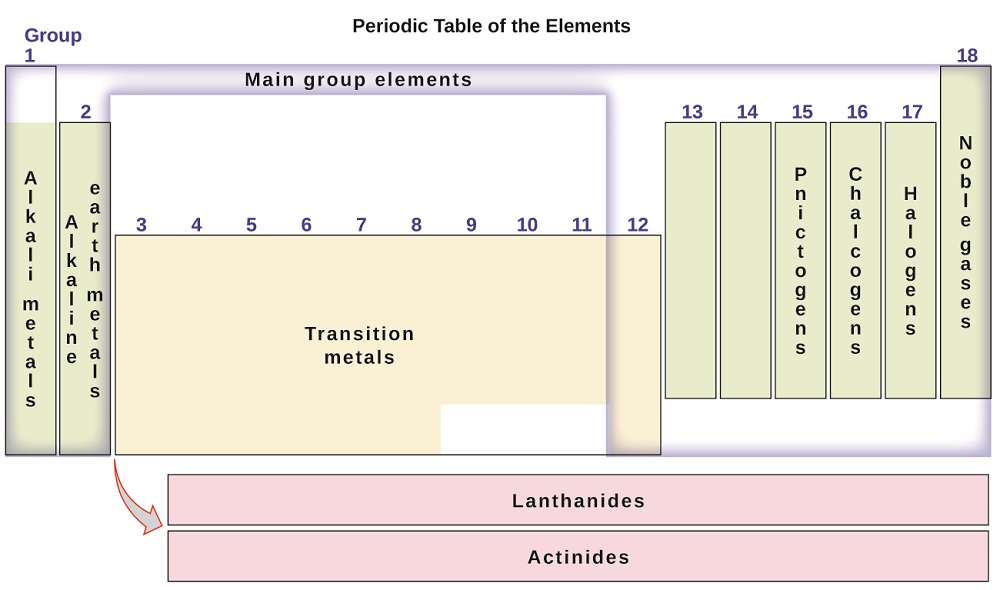
figur \(\PageIndex{3}\): det periodiska systemet organiserar element med liknande egenskaper i grupper.
exempel \(\PageIndex{1}\): namngivning av grupper av element
atomer av vart och ett av följande element är väsentliga för livet. Ge gruppnamnet för följande element:
- chlorine
- calcium
- sodium
- sulfur
Solution
The family names are as follows:
- halogen
- alkaline earth metal
- alkali metal
- chalcogen
Exercise \(\PageIndex{1}\)
Give the group name for each of the following elements:
- krypton
- selen
- barium
- litium
svar a
ädelgas
svar b
chalcogen
svar c
jordalkalimetall
svar d
alkalimetall
när du studerar det periodiska systemet kanske du har märkt något om atommassorna hos några av elementen. Element 43 (technetium), element 61 (prometium) och de flesta av elementen med atomnummer 84 (polonium) och högre har sin atommassa i hakparenteser. Detta görs för element som helt består av instabila radioaktiva isotoper (du kommer att lära dig mer om radioaktivitet i kapitlet kärnkemi). En genomsnittlig atomvikt kan inte bestämmas för dessa element eftersom deras radioisotoper kan variera avsevärt i relativ överflöd, beroende på källan, eller kanske inte ens existerar i naturen. Antalet inom hakparenteser är atommassantalet (och ungefärlig atommassa) för den mest stabila isotopen för det elementet.
sammanfattning
Video \(\PageIndex{3}\): en sammanfattning av upptäckten och egenskaperna hos det periodiska systemet.
upptäckten av det periodiska återfallet av liknande egenskaper bland elementen ledde till formuleringen av det periodiska systemet, där elementen är ordnade i ordning med ökande atomnummer i rader som kallas perioder och kolumner som kallas grupper. Element i samma grupp i det periodiska systemet har liknande kemiska egenskaper. Element kan klassificeras som metaller, metalloider och icke-metaller, eller som huvudgruppselement, övergångsmetaller och inre övergångsmetaller. Grupperna är numrerade 1-18 från vänster till höger. Elementen i Grupp 1 är kända som alkalimetallerna; de i Grupp 2 är jordalkalimetallerna; de i 15 är pnictogenerna; de i 16 är kalkogenerna; de i 17 är halogenerna; och de i 18 är ädelgaserna.