inlärningsmål
i slutet av detta avsnitt kommer du att kunna:
- förklara förhållandet mellan mikroskopiska och makroskopiska mängder i en gas
- lösa problem som involverar blandningar av gaser
- lösa problem som involverar avståndet och tiden mellan en gasmolekyls kollisioner
Vi har undersökt tryck och temperatur baserat på deras makroskopiska definitioner. Tryck är kraften dividerad med det område på vilket kraften utövas och temperaturen mäts med en termometer. Vi kan få en bättre förståelse för tryck och temperatur från den kinetiska teorin om gaser, teorin som relaterar gasernas makroskopiska egenskaper till rörelsen hos molekylerna de består av. Först gör vi två antaganden om molekyler i en idealisk gas.
- Det finns ett mycket stort antal n molekyler, alla identiska och var och en har massa m.molekylerna följer Newtons lagar och är i kontinuerlig rörelse, vilket är slumpmässigt och isotropiskt, det vill säga detsamma i alla riktningar.
för att härleda den ideala gaslagen och sambandet mellan mikroskopiska kvantiteter, såsom energin hos en typisk molekyl och makroskopiska kvantiteter, såsom temperatur, analyserar vi ett prov av en idealisk gas i en styv behållare, om vilken vi gör ytterligare två antaganden:
- molekylerna är mycket mindre än det genomsnittliga avståndet mellan dem, så deras totala volym är mycket mindre än deras behållare (som har volym V). Med andra ord tar vi van der Waals konstant b, volymen av en mol gasmolekyler, för att vara försumbar jämfört med volymen av en mol gas i behållaren.molekylerna gör perfekt elastiska kollisioner med behållarens väggar och med varandra. Andra krafter på dem, inklusive gravitation och attraktionerna representerade av Van der Waals konstant a, är försumbara (vilket är nödvändigt för antagandet av isotropi).
kollisionerna mellan molekyler förekommer inte i härledningen av den ideala gaslagen. De stör inte härledningen heller, eftersom kollisioner mellan molekyler som rör sig med slumpmässiga hastigheter ger nya slumpmässiga hastigheter. Dessutom, om hastigheterna hos gasmolekyler i en behållare initialt inte är slumpmässiga och isotropa, är molekylära kollisioner det som gör dem slumpmässiga och isotropa.
vi gör ytterligare antaganden som förenklar beräkningarna men inte påverkar resultatet. Först låter vi behållaren vara en rektangulär låda. För det andra börjar vi med att överväga monatomiska gaser, de vars molekyler består av enstaka atomer, såsom helium. Då kan vi anta att atomerna inte har någon energi utom deras translationella kinetiska energi; till exempel har de varken rotations-eller vibrationsenergi. (Senare diskuterar vi giltigheten av detta antagande för verkliga monatomiska gaser och undviker det att överväga diatomiska och polyatomiska gaser.)
figur \(\PageIndex{1}\) visar en kollision av en gasmolekyl med en behållares vägg, så att den utövar en kraft på väggen (enligt Newtons tredje lag). Dessa kollisioner är källan till tryck i en gas. När antalet molekyler ökar ökar antalet kollisioner och därmed trycket. På samma sätt, om molekylernas genomsnittliga hastighet är högre, är gastrycket högre.
i ett prov av gas i en behållare orsakar slumpmässigheten hos den molekylära rörelsen antalet kollisioner av molekyler med någon del av väggen under en given tid att fluktuera. Men eftersom ett stort antal molekyler kolliderar med väggen på kort tid, varierar antalet kollisioner på tids-och rymdskalorna vi mäter med endast en liten, vanligtvis observerbar fraktion från genomsnittet. Vi kan jämföra denna situation med ett kasino, där resultaten av insatserna är slumpmässiga och kasinots insatser varierar per minut och timme. Men under långa tider som ett år är kasinots insatser mycket nära de medelvärden som förväntas av oddsen. En tank med gas har enormt fler molekyler än ett kasino har spelarna på ett år, och molekylerna gör enormt fler kollisioner på en sekund än ett kasino har satsningar.
en beräkning av den genomsnittliga kraften som utövas av molekyler på lådans väggar leder oss till den ideala gaslagen och till sambandet mellan temperatur och molekylär kinetisk energi. (I själva verket kommer vi att ta två medelvärden: en över tiden för att få den genomsnittliga kraften som utövas av en molekyl med en given hastighet, och sedan ett annat medelvärde över molekyler med olika hastigheter.) Detta tillvägagångssätt utvecklades av Daniel Bernoulli (1700-1782), som är mest känd inom fysiken för sitt arbete med vätskeflöde (hydrodynamik). Anmärkningsvärt gjorde Bernoulli detta arbete innan Dalton etablerade synen på materia som bestående av atomer.
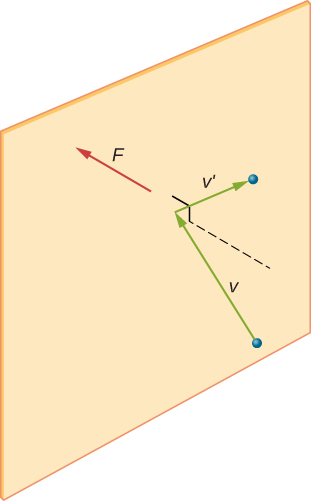
figur \(\PageIndex{2}\) visar en behållare full av gas och en utökad vy av en elastisk kollision av en gasmolekyl med en vägg av behållaren, uppdelad i komponenter. Vi har antagit att en molekyl är liten jämfört med separationen av molekyler i gasen och att dess interaktion med andra molekyler kan ignoreras. Under dessa förhållanden är den ideala gaslagen experimentellt giltig. Eftersom vi också har antagit att väggen är styv och partiklarna är punkter är kollisionen elastisk (genom energibesparing—det finns ingenstans för en partikels kinetiska energi att gå). Därför förblir molekylens kinetiska energi konstant, och därmed förblir dess hastighet och storleken på dess momentum också konstant. Detta antagande är inte alltid giltigt, men resultaten i resten av denna modul erhålls också i modeller som låter molekylerna utbyta energi och momentum med väggen.
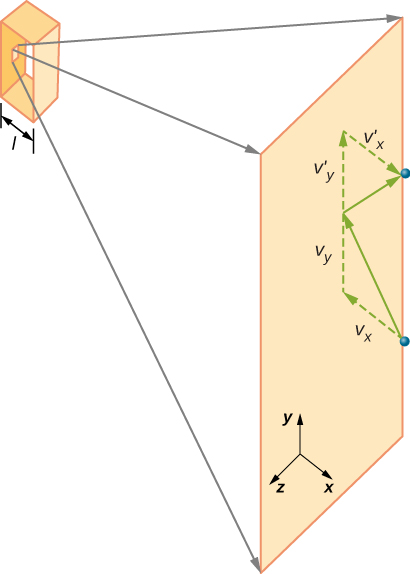
om molekylens hastighet förändras i x-riktningen ändras dess momentum från \(-m_x\) till \(+mv_x\). Således är dess förändring i momentum \(\Delta mv = +mv_x- (- mv_x) = 2mv_x\). Enligt impuls-momentumsatsen som ges i kapitlet om linjär momentum och kollisioner ges kraften som utövas på ith-molekylen, där jag märker molekylerna från 1 till N, av \
(i denna ekvation ensam representerar p momentum, inte tryck.) Det finns ingen kraft mellan väggen och molekylen utom när molekylen rör vid väggen. Under kollisionens korta tid är kraften mellan molekylen och väggen relativt stor, men det är inte den kraft vi letar efter. Vi letar efter den genomsnittliga kraften, så vi tar \(\Delta t\) för att vara den genomsnittliga tiden mellan kollisioner av den givna molekylen med denna vägg, vilket är den tid då vi förväntar oss att hitta en kollision. Låt l representera lådans längd i X-riktningen. Då är\ (\Delta t\) den tid molekylen skulle ta för att gå över lådan och tillbaka, ett avstånd 2l, med en hastighet av \ (v_x\). Således \(\delta t = 2l/v_x\), och uttrycket för kraften blir
\
denna kraft beror på en molekyl. För att hitta den totala kraften på väggen, F, måste vi lägga till bidrag från alla n-molekyler:
\
vi använder nu definitionen av medelvärdet, som vi betecknar med en stapel, för att hitta kraften:
\
vi vill ha kraften i termer av hastigheten v, snarare än X-komponenten i hastigheten. Observera att den totala hastigheten kvadrerad är summan av kvadraterna för dess komponenter, så att
\
med antagandet om isotropi är de tre medelvärdena på höger sida lika, så
\
att ersätta detta i uttrycket för F ger
\
trycket är F/A, så vi får
\ där vi använde \(V = Al\) för volymen. Detta ger det viktiga resultatet
\
kombinera denna ekvation med \(pV = Nk_BT\) ger
\
Vi kan få den genomsnittliga kinetiska energin hos en molekyl, \(\frac{1}{2}m\overline{v}^2\), från vänster sida av ekvationen genom att dela ut N och multiplicera med 3/2.
Genomsnittlig kinetisk energi per molekyl
den genomsnittliga kinetiska energin hos en molekyl är direkt proportionell mot dess absoluta temperatur:
\
ekvationen \(\overline{K} = \frac{3}{2} k_BT\) är den genomsnittliga kinetiska energin per molekyl. Observera särskilt att ingenting i denna ekvation beror på molekylmassan (eller någon annan egenskap) hos gasen, trycket eller något annat än temperaturen. Om prover av helium-och xenongas, med mycket olika molekylmassor, har samma temperatur, har molekylerna samma genomsnittliga kinetiska energi.
den inre energin i ett termodynamiskt system är summan av de mekaniska energierna hos alla molekyler i den. Vi kan nu ge en ekvation för den inre energin hos en monatomisk idealgas. I en sådan gas är molekylernas enda energi deras translationella kinetiska energi. Därför betecknar vi den inre energin med \(E_{int}\) vi har helt enkelt \(E_{int} = n\overline{K}\) eller
\
ofta vill vi använda denna ekvation i termer av mol:
\
Vi kan lösa \(\overline{K} = \frac{1}{2}m\overline{v}^2 = \frac{3}{2}k_bt\) för en typisk hastighet av en molekyl i en idealisk gas i termer av temperatur för att bestämma vad som kallas rot-medel-kvadrat (RMS) hastighet av en molekyl.
RMS-hastigheten för en molekyl
roten-medelkvadrat (rms) hastighet för en molekyl, eller kvadratroten av medelvärdet av kvadraten av hastigheten \(\overline{v}^2\), är
\
RMS-hastigheten är inte medelvärdet eller den mest sannolika hastigheten för molekyler, som vi kommer att se i fördelningen av Molekylhastigheter, men det ger en lätt beräknad uppskattning av molekylernas hastighet som är lika med den hastighet som relaterade till deras kinetiska energi. Återigen kan vi skriva denna ekvation när det gäller gaskonstanten R och molmassan M i kg / mol:
\
vi avviker ett ögonblick för att svara på en fråga som kan ha uppstått för dig: när vi tillämpar modellen på atomer istället för teoretiska punktpartiklar, förändrar rotationskinetisk energi våra resultat? För att svara på denna fråga måste vi vädja till kvantmekanik. I kvantmekanik kan rotationskinetisk energi inte ta på sig något värde; det är begränsat till en diskret uppsättning värden, och det minsta värdet är omvänt proportionellt mot rotationsinergheten. Rotationströgheten hos en atom är liten eftersom nästan hela dess massa ligger i kärnan, som vanligtvis har en radie mindre än \(10^{-14} m\). Således är en atoms minsta rotationsenergi mycket mer än \(\frac{1}{2}k_BT\) för varje uppnåelig temperatur, och den tillgängliga energin räcker inte för att få en atom att rotera. Vi kommer att återvända till denna punkt när vi diskuterar diatomiska och polyatomiska gaser i nästa avsnitt.
exempel \(\PageIndex{1}\): Beräkning av kinetisk energi och hastighet för en gasmolekyl
- Vad är den genomsnittliga kinetiska energin hos en gasmolekyl vid \(20.0^oC\) (rumstemperatur)?
- hitta RMS-hastigheten för en kvävemolekyl (\(N_2\)) vid denna temperatur.
strategi
(A) den kända i ekvationen för den genomsnittliga kinetiska energin är temperaturen:
\
innan vi ersätter värden i denna ekvation måste vi konvertera den givna temperaturen till kelvin: \(T = (20,0 + 273)\, K = 293\, K\). Vi kan hitta RMS-hastigheten för en kvävemolekyl genom att använda ekvationen
\
men vi måste först hitta massan av en kvävemolekyl. Erhållande av molmassan av kväve \(N_2\) från det periodiska systemet finner vi
\
lösning
- temperaturen ensam är tillräcklig för att vi ska hitta den genomsnittliga translationella kinetiska energin. Att ersätta temperaturen i den translationella kinetiska energiekvationen ger \
- att ersätta denna massa och värdet för \(k_B\) i ekvationen för \(v_{rms}\) ger \
betydelse
Observera att molekylens genomsnittliga kinetiska energi är oberoende av typen av molekyl. Den genomsnittliga translationella kinetiska energin beror endast på absolut temperatur. Den kinetiska energin är mycket liten jämfört med makroskopiska energier, så att vi inte känner när en luftmolekyl träffar vår hud. Å andra sidan är det mycket större än den typiska skillnaden i gravitationspotentialenergi när en molekyl rör sig från, säg, toppen till botten av ett rum, så vår försummelse av gravitation är motiverad i typiska verkliga situationer. Kvävemolekylens RMS-hastighet är överraskande stor. Dessa stora molekylhastigheter ger inte makroskopisk rörelse av luft, eftersom molekylerna rör sig i alla riktningar med lika sannolikhet. Den genomsnittliga fria vägen (avståndet som en molekyl rör sig i genomsnitt mellan kollisioner, diskuteras lite senare i detta avsnitt) av molekyler i luft är mycket liten, så molekylerna rör sig snabbt men kommer inte så långt på en sekund. Det höga värdet för RMS-hastighet återspeglas i ljudets hastighet, vilket är cirka 340 m/s vid rumstemperatur. Ju högre rms-hastighet för luftmolekyler, desto snabbare ljudvibrationer kan överföras genom luften. Ljudets hastighet ökar med temperaturen och är större i gaser med små molekylmassor, såsom helium (se figur \(\PageIndex{3}\)).
exempel \(\PageIndex{2}\): Beräkning av temperatur: flyghastighet för heliumatomer
för att undkomma jordens gravitation måste ett objekt nära toppen av atmosfären (på en höjd av 100 km) resa bort från jorden med 11,1 km / s. denna hastighet kallas flykthastigheten. Vid vilken temperatur skulle heliumatomer ha en RMS-hastighet lika med flykthastigheten?
strategi
identifiera knowns och okända och bestämma vilka ekvationer som ska användas för att lösa problemet.
lösning
- identifiera knowns: v är flykthastigheten, 11,1 km/s.
- identifiera de okända: vi måste lösa för temperatur, T. Vi måste också lösa för massan m av heliumatomen.
- Bestäm vilka ekvationer som behövs.
- för att få massan m av heliumatomen kan vi använda information från det periodiska systemet: \
- för att lösa för temperatur T kan vi ordna om \ för att ge \
- ersätta de kända värdena i ekvationerna och lösa för de okända, \ och \
betydelse
denna temperatur är mycket högre än atmosfärstemperaturen, vilket är ungefär 250 K (\(-25^oC\) eller \(-10^av\)) vid hög höjd. Mycket få heliumatomer finns kvar i atmosfären, men många var närvarande när atmosfären bildades, och fler skapas alltid av radioaktivt sönderfall (se kapitlet om kärnfysik). Orsaken till förlusten av heliumatomer är att ett litet antal heliumatomer har hastigheter högre än jordens flykthastighet även vid normala temperaturer. Hastigheten på en heliumatom ändras från en kollision till nästa, så att det vid varje ögonblick finns en liten men icke-noll chans att atomens hastighet är större än flykthastigheten. Chansen är tillräckligt hög att under jordens livstid har nästan alla heliumatomer som har varit i atmosfären nått flykthastighet vid höga höjder och rymt från jordens gravitationskraft. Tyngre molekyler, såsom syre, kväve och vatten, har mindre RMS-hastigheter, och så är det mycket mindre troligt att någon av dem kommer att ha hastigheter större än flykthastigheten. Faktum är att sannolikheten är så liten att miljarder år krävs för att förlora betydande mängder tyngre molekyler från atmosfären. Figur \(\PageIndex{4}\) visar effekten av brist på atmosfär på månen. Eftersom månens gravitationskraft är mycket svagare har den förlorat nästan hela atmosfären. Atmosfären på jorden och andra kroppar jämförs i detta kapitels övningar.

övning \(\PageIndex{2}\)
om du betraktar ett mycket litet föremål, såsom ett pollenkorn, i en gas, skulle antalet molekyler som slår på dess yta också vara relativt litet. Skulle du förvänta dig att pollenkornet upplever några fluktuationer i tryck på grund av statistiska fluktuationer i antalet gasmolekyler som slår på det under en viss tid?
svar
Ja. Sådana fluktuationer förekommer faktiskt för en kropp av vilken storlek som helst i en gas, men eftersom antalet molekyler är enorma för makroskopiska kroppar är fluktuationerna en liten andel av antalet kollisioner, och de medelvärden som talas om i detta avsnitt varierar omärkligt. Grovt sett är fluktuationerna omvänt proportionella mot kvadratroten av antalet kollisioner, så för små kroppar kan de bli betydande. Detta observerades faktiskt på nittonde århundradet för pollenkorn i vatten och är känt som brunisk rörelse.
ångtryck, partialtryck och Daltons lag
trycket som en gas skulle skapa om den upptog den totala tillgängliga volymen kallas gasens partialtryck. Om två eller flera gaser blandas kommer de att komma till termisk jämvikt som ett resultat av kollisioner mellan molekyler; processen är analog med värmeledning som beskrivs i kapitlet om temperatur och värme. Som vi har sett från kinetisk teori, när gaserna har samma temperatur, har deras molekyler samma genomsnittliga kinetiska energi. Således följer varje gas den ideala gaslagen separat och utövar samma tryck på väggarna i en behållare som den skulle göra om den var ensam. Därför är det totala trycket i en blandning av gaser summan av partiella tryck av komponentgaserna, förutsatt idealiskt gasbeteende och inga kemiska reaktioner mellan komponenterna. Denna lag är känd som Daltons lag om partiellt tryck, efter den engelska forskaren John Dalton (1766-1844) som föreslog det. Daltons lag överensstämmer med det faktum att trycket lägger till enligt Pascals princip.
i en blandning av ideala gaser i termisk jämvikt är antalet molekyler av varje gas proportionell mot dess partialtryck. Detta resultat följer av att tillämpa den ideala gaslagen på var och en i formen \(p/n = RT/V\). Eftersom den högra sidan är densamma för vilken gas som helst vid en given temperatur i en behållare med en given volym, är den vänstra sidan också densamma.
- partialtryck är det tryck som en gas skulle skapa om den existerade ensam.
- Daltons lag säger att det totala trycket är summan av partialtrycket för alla närvarande gaser.
- för två gaser (märkta 1 och 2) i jämvikt i en behållare, \(\frac{p_1}{n_1} = \frac{p_2}{n_2}.\ )
en viktig tillämpning av partialtryck är att det i kemi fungerar som koncentrationen av en gas vid bestämning av reaktionshastigheten. Här nämner vi bara att partialtrycket av syre i en persons lungor är avgörande för liv och hälsa. Andningsluft som har ett partialtryck av syre under 0,16 atm kan försämra samordning och bedömning, särskilt hos personer som inte acklimatiseras till en hög höjd. Lägre deltryck på \ (O_2\) har allvarligare effekter; deltryck under 0,06 atm kan snabbt vara dödligt och permanent skada är sannolikt även om personen räddas. Men känslan av att behöva andas, som när man håller andan, orsakas mycket mer av höga koncentrationer av koldioxid i blodet än av låga koncentrationer av syre. Således, om ett litet rum eller garderob är fyllt med luft med låg syrekoncentration, kanske för att en läckande cylinder av någon komprimerad gas lagras där, kommer en person inte att känna någon ”kvävande” känsla och kan gå in i kramper eller förlora medvetandet utan att märka något fel. Säkerhetsingenjörer ger stor uppmärksamhet åt denna fara.
en annan viktig tillämpning av partialtryck är ångtryck, vilket är partialtrycket för en ånga vid vilken den är i jämvikt med vätskan (eller fast, vid sublimering) fas av samma substans. Vid vilken temperatur som helst kan partialtrycket i vattnet i luften inte överstiga vattentrycket vid den temperaturen, eftersom när partialtrycket når ångtrycket kondenseras vatten ur luften. Dagg är ett exempel på denna kondens. Temperaturen vid vilken kondensation uppstår för ett prov av luft kallas daggpunkten. Det mäts lätt genom att långsamt kyla en metallkula; daggpunkten är den temperatur vid vilken kondens först uppträder på bollen.
ångtrycket av vatten vid vissa temperaturer av intresse för meteorologi anges i tabell\(\PageIndex{1}\).
| T(\(^oC\)) | ångtryck (Pa) |
|---|---|
| 0 | 610,5 |
| 3 | 757,9 |
| 5 | 872.3 |
| 8 | 1073 |
| 10 | 1228 |
| 13 | 1497 |
| 15 | 1705 |
| 18 | 2063 |
| 20 | 2338 |
| 23 | 2809 |
| 25 | 3167 |
| 30 | 4243 |
| 35 | 5623 |
| 40 | 7376 |
The relative humidity (R.H.) vid en temperatur t definieras av
\
en relativ fuktighet på \(100\%\) betyder att partialtrycket av vatten är lika med ångtrycket; med andra ord är luften mättad med vatten.
exempel \(\PageIndex{3}\): Beräkning av relativ fuktighet
vad är den relativa luftfuktigheten när lufttemperaturen är \(25^oC\) och daggpunkten är \(15^oC\)?
strategi
vi tittar helt enkelt upp ångtrycket vid den givna temperaturen och det vid daggpunkten och hittar förhållandet.
lösning
\
betydelse
Rh är viktigt för vår komfort. Värdet på \(53.8\%\) ligger inom intervallet \(40\%\) till \(60\%\) rekommenderas för komfort inomhus.
som noterats i kapitlet om temperatur och värme faller temperaturen sällan under daggpunkten, för när den når daggpunkten eller frostpunkten kondenserar vatten och släpper ut en relativt stor mängd latent förångningsvärme.
Mean Free Path och Mean Free Time
vi överväger nu kollisioner uttryckligen. Det vanliga första steget (vilket är allt vi tar) är att beräkna den genomsnittliga fria vägen, \(\lambda\), det genomsnittliga avståndet En molekyl färdas mellan kollisioner med andra molekyler och den genomsnittliga fritiden \(\tau\), den genomsnittliga tiden mellan kollisionerna av en molekyl. Om vi antar att alla molekyler är sfärer med en radie \(r\) kommer en molekyl att kollidera med en annan om deras centra ligger inom ett avstånd 2r från varandra. För en given partikel säger vi att området för en cirkel med den radien, \(4\pi r^2\), är ”tvärsnittet” för kollisioner. När partikeln rör sig spårar den en cylinder med den tvärsnittsarean. Den genomsnittliga fria vägen är längden \(\lambda\) så att det förväntade antalet andra molekyler i en cylinder med längd \(\lambda\) och tvärsnitt \(4\pi r^2\) är 1. Om vi tillfälligt ignorerar rörelsen hos andra molekyler än den vi tittar på, är det förväntade antalet molekylernas taltäthet, N / v, gånger volymen och volymen är \(4 \ pi r^2 \lambda\), så vi har \((N/V)4\pi r^2 \lambda = 1\), eller
\
med hänsyn till rörelsen av alla molekyler gör beräkningen mycket svårare, men den enda förändringen är en faktor av \(\sqrt{2}\). Resultatet är
\
i en idealisk gas kan vi ersätta \(V/N = k_BT/p\) för att erhålla
\
medelfritiden \(\tau\) är helt enkelt Den genomsnittliga fria vägen dividerad med en typisk hastighet, och det vanliga valet är rms-hastigheten. Sedan
\
beräkna Medelfritiden
hitta medelfritiden för argonatomer (\(M = 39,9 \, g/mol\)) vid en temperatur av \(0^oC\) och ett tryck på 1,00 atm. Ta radien för en argonatom att vara \(1,70 \gånger 10^{-10}\space m\).
lösning
- identifiera knowns och konvertera till SI-enheter. Vi vet att molmassan är 0.0399 kg/mol, temperaturen är 273 K, trycket är \(1,01 \gånger 10^5 \, Pa\) och radien är \(1,70 \gånger 10^{-10}\, m\).
- hitta RMS-hastigheten: \(v_{rms} = \sqrt {\frac{3RT}{m}} = 413 \, m / s\).
- substitut i ekvationen för medelfritiden: \
betydelse
Vi kan knappast jämföra detta resultat med vår intuition om gasmolekyler, men det ger oss en bild av molekyler som kolliderar med extremt hög frekvens.
övning \(\PageIndex{4}\)
som har en längre genomsnittlig fri väg, flytande vatten eller vattenånga i luften?
svar
i en vätska är molekylerna mycket nära varandra och kolliderar ständigt med varandra. För att en gas ska vara nästan idealisk, eftersom luft är under vanliga förhållanden, måste molekylerna vara mycket långt ifrån varandra. Därför är den genomsnittliga fria vägen mycket längre i luften.
bidragsgivare och attribut
-
Samuel J. Ling (Truman State University), Jeff Sanny (Loyola Marymount University) och Bill Moebs med många bidragande författare. Detta verk är licensierat av OpenStax University Physics under en Creative Commons Attribution License (av 4.0).