molekylära orbitaler av en Allylkarbookation
stabiliteten hos karbokokationen av propen beror på ett konjugerat elektronsystem av CI. En ”dubbelbindning” existerar inte riktigt. I stället är det en grupp av 3 intilliggande, överlappande, icke-hybridiserade p-orbitaler som vi kallar ett konjugerat Audi-elektronsystem. Du kan tydligt se interaktionerna mellan alla tre p-orbitalerna från de tre kolarna vilket resulterar i en riktigt stabil katjon. Allt kommer ner till var platsen för det elektronbristiga kolet är.
molekylära orbitalbeskrivningar kan förklara allylstabilitet på ännu ett sätt med 2-propenyl. Fig.6
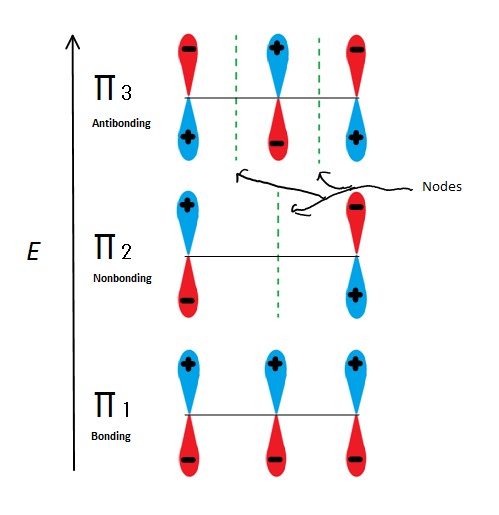
Fig.6 visar de 3 möjliga molekylära orbitalerna av 2-propenyl
om vi bara tar den molekylära orbitalenmix och inte någon av s, får vi tre av dem. SR1 är bindning utan noder, SR2 är nonbonding (med andra ord samma energi som en vanlig p-orbital) med en nod och SR3 är antibonding med 2 noder (ingen av orbitalerna interagerar). De två första elektronerna kommer att gå in i den molekylära orbitalen av molekylen i 1-molekylen, oavsett om det är en katjon, radikal eller anjon. Om det är en radikal eller anjon, går nästa elektron in i den molekylära orbitalen i 2-molekylen. Den sista anjonelektronen går också in i den icke-bonding orbitalen. Så oavsett vilken typ av kolcentrum som finns, kommer ingen elektron någonsin att gå in i antibonding orbitalen.
Bindningsorbitalerna är de lägsta energiorbitalerna och är gynnsamma, varför de fylls först. Även om de icke-bonding orbitalerna kan fyllas, är systemets totala energi fortfarande lägre och stabilare på grund av de fyllda bindningsmolekylära orbitalerna.
den här siffran visar också att jacob2 är den enda molekylära orbitalen där elektrionen skiljer sig, och det är också där en enda nod passerar genom mitten. På grund av detta är laddningarna av molekylen huvudsakligen på de två terminala kolerna och inte mittkolet.
denna molekylära orbitalbeskrivning kan också illustrera stabiliteten hos allylkolcentra i Figur 7.
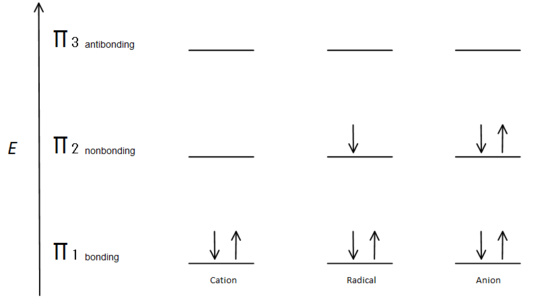
Fig.7 diagram som visar hur elektronerna fyller baserat på Aufbau-principen.
den kubanska bindningsbanan är lägre i energi än den icke-bindande p-banan. Eftersom varje kolcentrum som visas har två elektroner i den lägre energin, bindningsmicrobital, sänks energin i varje system totalt (och därmed stabilare), oavsett katjon, radikal eller anjon.