związki Antyaromatyczne są niezwykle niestabilne
Jakie są kluczowe czynniki decydujące o tym, czy cząsteczka jest antyaromatyczna?
w naszych poprzednich postach w naszej serii o aromatyczności widzieliśmy, że cząsteczki aromatyczne są niezwykle stabilne. Mają szczególnie duże Energie rezonansowe, mają tendencję do reakcji substytucji zamiast addycji i mają zdelokalizowane elektrony pi (np. wszystkie długości wiązań C-C w benzenie są równe).
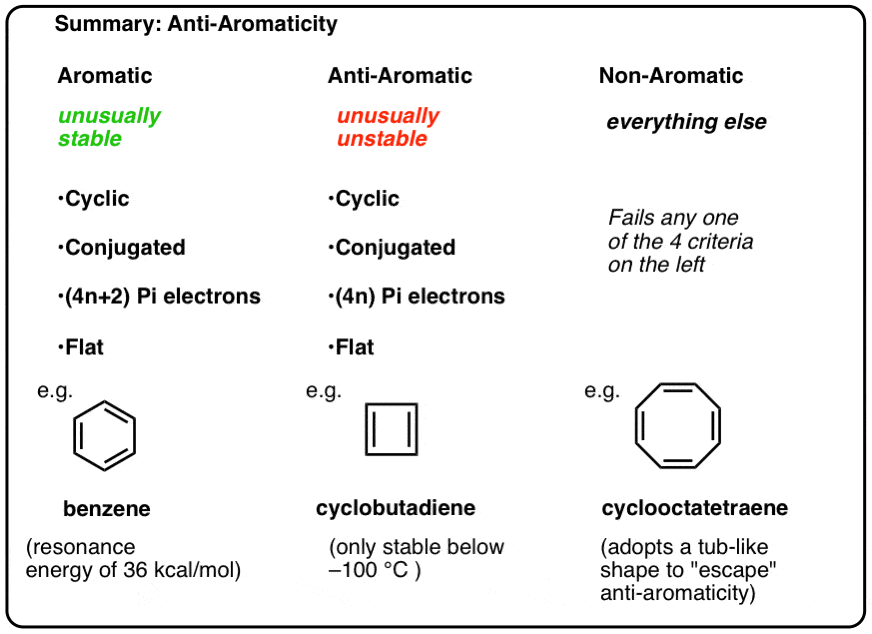
aby cząsteczka była aromatyczna, musi posiadać następujące cztery cechy strukturalne:
- cykliczne
- sprzężone dookoła pierścienia
- mają elektrony pi
- płaskie (planarne)
Jeśli te cztery warunki są spełnione, cząsteczka jest aromatyczna.
Jeśli odpali chociaż jedno pytanie na teście, to nie jest aromatyczne.
to chyba jasne. A może jest?
można się domyślić ze sposobu w jaki piszę to pytanie, że odpowiedź brzmi „niezupełnie”.
spis treści
- niektóre cząsteczki są tak spektakularnie i niezwykle niestabilne i trudne do wyodrębnienia, że zasługują na własną kategorię: Antyaromatyczny
- Cyklopentadienyl kation: „stabilizowany rezonansem” Karbokacja, która nie jest stabilna
- Antyaromatyczne pierścienie trójczłonowe: Oksiren, 1h – Aziren, Tiiren
- Cyklobutadien jest Antyaromatyczny
- 8 pi-elektronowy przykład związku antyaromatycznego: Pentalen
- co sprawia, że cząsteczka jest anty-aromatyczna?
- Cyklooktatetraen „ucieka” Antyaromatyczność poprzez skręcenie z płaskości
- wniosek: związki Przeciwaromatyczne
- uwagi
- zaawansowane: Referencje i dalsze czytanie
1. Spektakularnie niestabilne cząsteczki, które tworzą kategorię dla siebie: „anty-aromatyczne”
oto chodzi. Istnieje niewielka liczba cząsteczek, które oblewają test aromatyczności, które nie są tylko niearomatyczne: mają tę właściwość, że są tak spektakularnie i niezwykle niestabilni i trudni do wyizolowania, że zasługują na inną nazwę.
nazywamy te cząsteczki „anty-aromatycznymi”.
interesujące jest to, że w wielu przypadkach same cząsteczki nie wyglądają na szczególnie niestabilne od pierwszych zasad, w przeciwieństwie do, powiedzmy, Kubanu. Dość zabawne, można kupić cubane (mniej więcej) od Aldrich, ale większość anty-aromatycznych cząsteczek, które omówimy poniżej, jest stabilna tylko w ekstremalnie niskich temperaturach-jeśli w ogóle można je wyizolować!
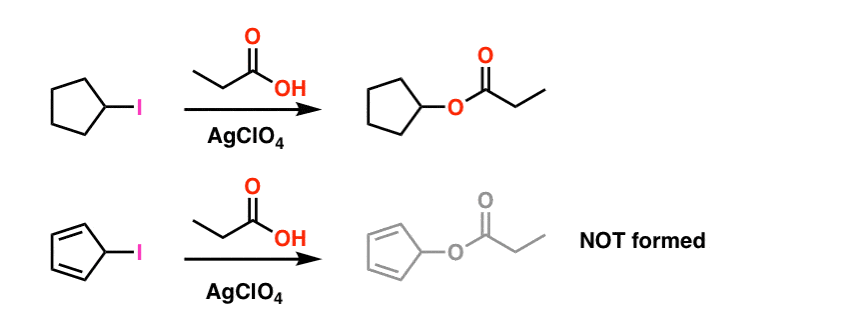
2. Kation Cyklopentadienylu: Karbokacja „stabilizowana rezonansem”, która nie jest stabilna
zacznijmy naszą podróż w dół króliczej nory od prostego przykładu, który powinien wydawać się znany z pierwszego semestru chemii organicznej.
pamiętasz reakcję SN1? Kot, który pierwszy opuszcza wygodne krzesło?
szybka recenzja: zacznij od halogenku alkilu. Pozostawiając liście grupowe, tworząc karbokazję. Ataki nukleofilów. Nazywa się SN1, ponieważ etap determinujący szybkość (tworzenie karbokacji) jest unimolekularny. Podsumowując: im bardziej stabilna karbokacja, tym szybciej przebiega reakcja. Stąd szybkość reakcji halogenków alkilowych jest trzeciorzędowa > wtórna > pierwotna, a karbokacja otrzymuje specjalne punkty bonusowe, jeśli jest stabilizowana przez rezonans.
spójrz na te dwie reakcje SN1. Jak myślisz, która z nich wydarzyłaby się szybciej-reakcja SN1, która przechodzi przez wtórną karbokację (A), czy reakcja SN1, która przechodzi przez wtórną karbokację i może tworzyć wiele form rezonansowych (B)?
ze wszystkiego, czego do tej pory się nauczyłeś, spodziewałbyś się, że odpowiedź będzie B).
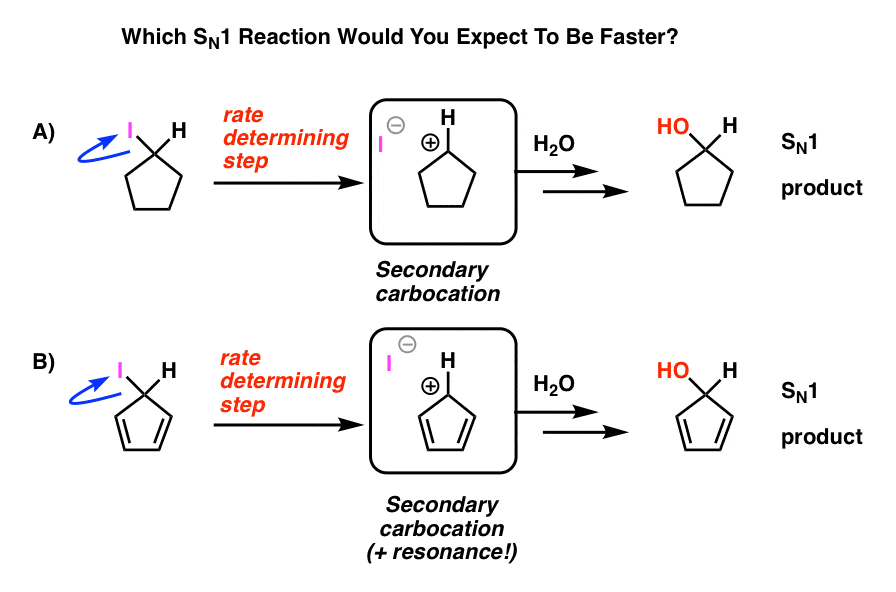
To nie jest.
odpowiedź jest taka, że reakcja a) dzieje się szybciej. Reakcja B nie zachodzi wcale.
to powinno cię dziwić.
jest!
Jak to jest, że ta rzekomo stabilizowana rezonansowo karbokacja jest mniej stabilna niż karbokacja wtórna?
W końcu ile razy wbija się w głowę, że rezonans stabilizuje cząsteczki, zwłaszcza karbokacje?
ale tutaj to chyba destabilizuje. Jest … jest …

ale jest niestabilny! Kation cyklopentadienylu jest niezwykle niestabilny i trudny do wytworzenia-i to nie z braku prób. Jest coś bardzo dziwnego w strukturze kationu cyklopentadienylu, co nadaje mu niezwykłą niestabilność.

Cykliczny, sprzężony, płaski…. i ma 4 elektrony pi. Ciekawe!
3. Antyaromatyczne pierścienie trójczłonowe: Oksiren, 1h-Aziren, Tiiren
inną klasą” nieuchwytnych ” cząsteczek jest rodzina pierścieni trójczłonowych. Można sobie przypomnieć z Org 1, że łatwo jest zrobić epoksydy z alkenów przy użyciu utleniacza, takiego jak M-CPBA.
zastanawiałeś się kiedyś, dlaczego nigdy nie opisaliśmy tej samej reakcji na alkiny?
Cóż, to nie z braku prób. Chemicy próbowali różnych metod epoksydowania alkinów i wiesz co? Reakcja po prostu nie działa.
na przykład epoksydacja acetylenu dałaby cząsteczkę poniżej (oksiren).
Sam Oksyren nigdy nie został zaobserwowany, chociaż istnieją kuszące ślady jego przelotnego istnienia. I przy okazji, ani Analog azotu, 1h-aziren, ani tiiren.
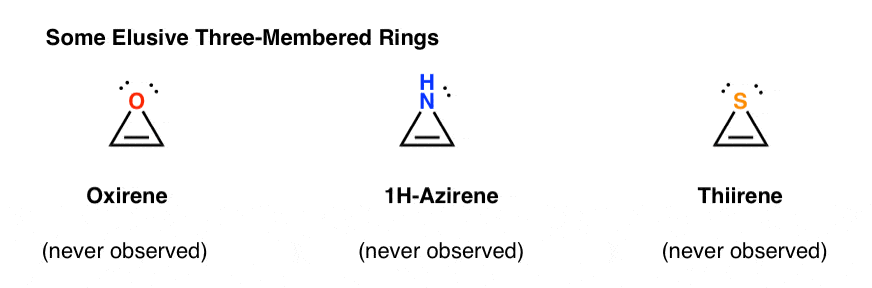
Dlaczego nie? Co jest specjalnego w każdej z tych przypadków?
można zauważyć, że, podobnie jak kation cyklopentadienylu, cząsteczki te są cykliczne, sprzężone, płaskie i mają 4 elektrony pi (dwa w wiązaniu pi i dwa z samotnej pary).
OK. Co jeszcze może być cykliczne, sprzężone, płaskie i mieć 4 elektrony pi?
4. Cyklobutadien jest Antyaromatyczny
Cyklobutadien wygląda na dość prostą cząsteczkę, ale w rzeczywistości nie został zsyntetyzowany aż do 1965 roku. I nawet wtedy okazało się, że nie jest stabilny w temperaturach powyżej 35 kelwinów.
pytanie brzmi, dlaczego?

oczywiście, jest to czteroczłonowy pierścień i tak, ma dużo szczepu pierścieniowego, ale wykonano więcej napiętych cząsteczek, które są faktycznie stabilne w temperaturze pokojowej.
Możesz również zauważyć, że podobnie jak w powyższych przykładach, cyklobutadien jest kolejnym przykładem cząsteczki, która jest cykliczna, sprzężona, ma 4 elektrony pi i jest płaska.
jeszcze ciekawsze jest to, czego dowiedzieliśmy się o geometrii cyklobutadienu. Zamiast być cząsteczką o identycznych długościach wiązania (jak benzen), stwierdzono, że cyklobutadien ma prostokątny kształt, co wskazuje, że elektrony nie były delokalizowane.
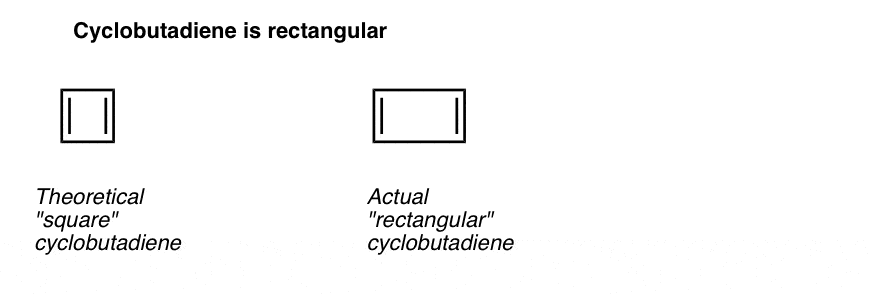
Co to mówi nam, że nawet gdy cząsteczka spełnia wszystkie warunki (cykliczne, sprzężone, płaskie, 4 elektrony pi), symetryczna geometria jest szczególnie niestabilna. . Bardzo interesujące!
8-elektronowy przykład związku Antyaromatycznego: Pentalen
do tej pory wszystkie przykłady, które widzieliśmy, miały 4 elektrony pi. Możesz się zastanawiać: czy są jakieś przykłady cząsteczek anty-aromatycznych, które mają więcej niż 4 elektrony pi? Tak.
cząsteczka poniżej nazywana jest „Pentalenem”. Został zsyntetyzowany, ale jest stabilny tylko poniżej -100 °C. powyżej tej temperatury łączy się z inną cząsteczką samą w sobie (referencyjną). Kolejny przykład spektakularnej niestabilności.

Pentalen ma 8 elektronów pi. To może wywołać alarm rozpoznawczy. Pamiętaj, jak liczba elektronów pi w cząsteczkach aromatycznych podążała za sekwencją (2, 6, 10, 14….) ?
Ten przykład sugeruje, że liczba elektronów pi w cząsteczkach anty-aromatycznych podąża za sekwencją (4, 8, 12…)
co sprawia, że cząsteczka jest anty-aromatyczna?
co te wszystkie molekuły w tej galerii mają wspólnego?
każdy z nich jest cykliczny, sprzężony i płaski – a kiedy policzysz liczbę elektronów pi, jest to wielokrotność 4. Tak więc podczas gdy cząsteczki aromatyczne mają (4N+2) elektrony pi, „regułą” dla cząsteczek anty aromatycznych jest (4n). (inny sposób patrzenia na to: liczba elektronów pi będzie dwukrotnie równa liczbie parzystej).
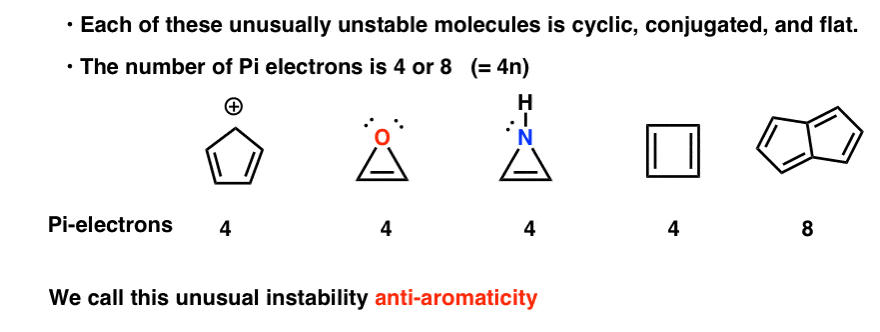
Ta niezwykła niestabilność nazywa się „antyaromatycznością”.
oznacza to, że możemy teraz sporządzić trzy kategorie cząsteczek według następujących kryteriów:
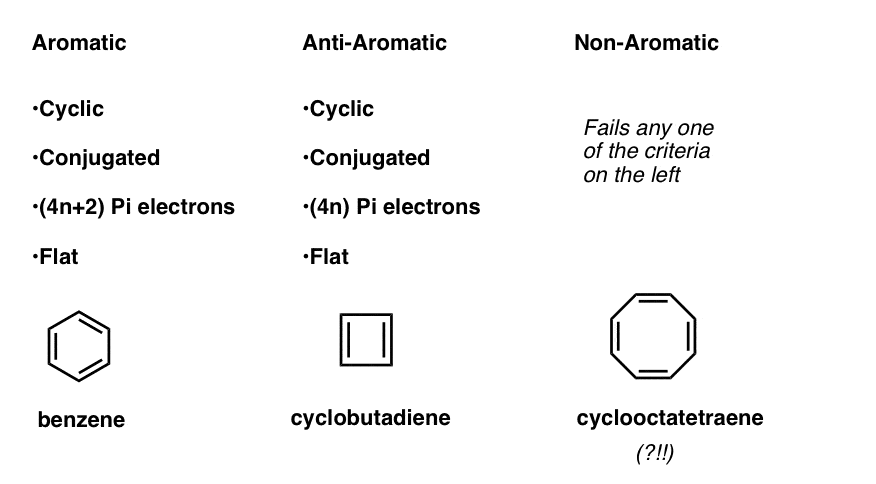
- cząsteczki aromatyczne są cykliczne, sprzężone, mają (4n+2) elektrony pi i są płaskie.
- cząsteczki anty-aromatyczne są cykliczne, sprzężone, mają elektrony (4N) pi i są płaskie.
- cząsteczki niearomatyczne to każda inna cząsteczka, która nie spełnia jednego z tych warunków.
poczekaj chwilę – możesz się zastanawiać, dlaczego cyklooktatetraen jest klasyfikowany jako „niearomatyczny”. Przy 8 elektronach pi (dwa razy liczba parzysta) nie powinno być „anty-aromatyczne”?
Cyklooktatetraen „ucieka” od Anty-aromatyczności poprzez przekręcanie płaskości
pomyśl o spełnieniu warunków „anty-aromatyczności” jako trochę jak kwalifikowanie się do niezwykle karanego podatku dochodowego. Biorąc pod uwagę możliwość znalezienia luki w podatkach, zrobiłbyś to? Prawdopodobnie.
Cyklooktatetraen jest antyaromatyczny tylko wtedy, gdy jest płaski. Jednak stosunkowo „dyskietkowa” struktura cyklooktatetraenu pozwala na pewną elastyczność. Wiązania mogą obracać się z dala od płaskości tak, że cząsteczka przyjmuje kształt „przypominający wannę”, unikając w ten sposób” podatku antyaromatycznego ” 18 12 kcal/mol, który byłby płacony, gdyby wszystkie orbitale p na cząsteczce zostały sprzężone ze sobą.
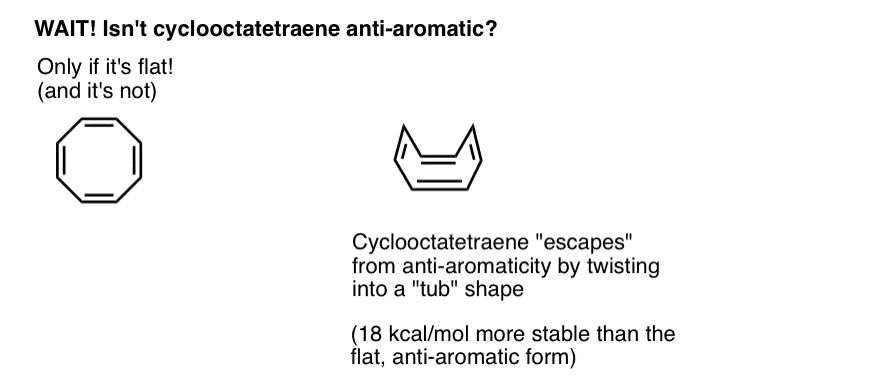
okazuje się, że cyklooktatetraen został zsyntetyzowany, jest stabilny (możesz go kupić na przykład tutaj) i zachowuje się jak „normalny” Alken, poddawany reakcjom dodawania, uwodorniania i tak dalej.
Pentalen (powyżej), który ma również 8 elektronów pi, ma bardzo sztywną strukturę bicykliczną, która zapobiega rotacji wiązań od płaskości. Dlatego utknął w swojej anty-aromatycznej konformacji.
znana jest anty-aromatyczność dla cząsteczek o więcej niż 8 elektronach pi, ale bardzo nietypowa. (Oto zabawny przykład innej „ucieczki” od aromatyczności dla cząsteczki z elektronami 18 pi.)
wniosek: związki Przeciwaromatyczne
do tej pory nasze leczenie aromatyczności i antyaromatyczności było czysto opisowe i empiryczne. Pokazaliśmy wiele przykładów i podaliśmy wiele zasad, ale brakuje w dyskusji jakiegokolwiek głębokiego wyjaśnienia „dlaczego”.
Co jest takiego specjalnego w pierścieniu benzenowym, że jest tak stabilny? Dlaczego jest stabilny?
co jest takiego specjalnego w systemie cyklobutadienu, że jest tak niestabilny. Dlaczego jest niestabilny?
aby odpowiedzieć na te głębsze pytania, będziemy musieli cofnąć się i zbadać orbitale molekularne tych dwóch cząsteczek, a następnie dojść do głębszego zrozumienia aromatyczności i anty-aromatyczności.
tak zrobimy w następnym poście.
podziękowania dla Mateusza Knowe za pomoc w przygotowaniu tego postu.
uwagi
przypis 1. Dla uproszczenia obraz pokazany w głównym artykule przedstawia rzeczywiste warunki reakcji. Rzeczywiste warunki eksperymentalne przedstawiono poniżej. Rozpuszczalnikiem jest kwas propionowy i dodaje się nadchloran Srebra kwasu Lewisa, aby pomóc w odciągnięciu jodu. .
nawet w tych warunkach karbokacja cyklopentadienylu nie powstaje, co świadczy o jego skrajnej niestabilności.
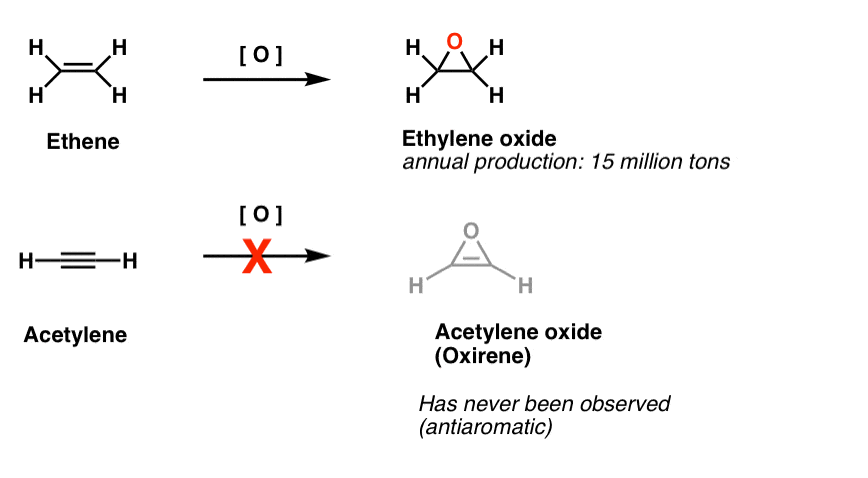
. Istnieją dobre dowody z badań znakowania izotopów, że oksyreny są przelotnymi półproduktami w niektórych rearanżacjach Wolffa. Istnieją również dwa przykłady oksyrenów, które zostały uwięzione w ekstremalnie niskiej temperaturze, ale rozłożone Powyżej 35 kelwinów.
postulowano ulotne istnienie 1h-azyryny w dodaniu nitrenu do acetylenu, który szybko przekształca się w (stabilny) 2h-aziren (poniżej).
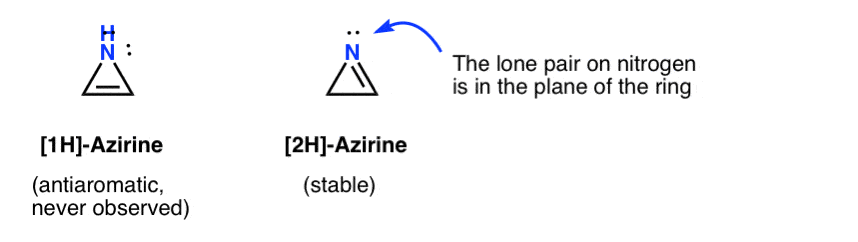
zauważ, że w 2h-azirenie pojedyncza para azotu jest pod kątem prostym do układu pi, więc ten układ jest niearomatyczny w przeciwieństwie do anty-aromatycznego.
Więcej dyskusji na ten temat można znaleźć w March ’ s Advanced Organic Chemistry. Pracuję nad piątym wydaniem, str. 62-63.
. Przypis 3. Bardzo sprytny eksperyment wykazał, że 1,2-dideutero cyklobutadien ma dwa izomery, a nie jeden (patrz poniżej). Oznacza to, że podwójne wiązania w cyklobutadienu nie są delokalizowane, ponieważ są w benzenie, ale są bardziej podobne do podwójnych wiązań w konwencjonalnym dienie.
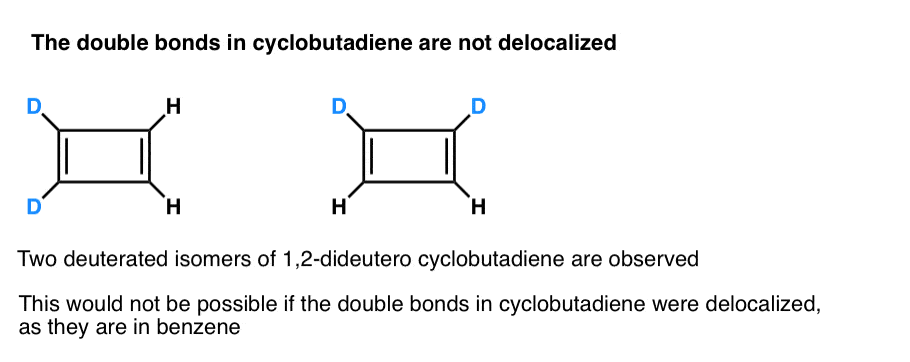
Cyklobutadien reaguje ze sobą w temperaturze 35 K tworząc „dimer”, na przykładzie reakcji Dielsa-Aldera.
przypis 4. Tak, to prawda, że samotną parę w azirene można umieścić w orbitalu hybrydowym sp3 (poniżej). Prawdopodobnie zmniejsza to nieco „karę” anty aromatyczną, ale cząsteczka jest nadal niewiarygodnie niestabilna. Anty-aromatyczność jest najprostszym sposobem, aby to wyjaśnić.

przypis 5. Geometria prostokątna wynika z efektu znanego jako efekt Jahna-Tellera. Pamiętasz zasadę wykluczenia Pauli, gdzie elektrony nie mogą mieć tej samej liczby kwantowej? Cóż, jak zobaczymy, kiedy spojrzymy na diagram orbitali molekularnych cyklobutadienu, „kwadratowy” cyklobutadien ma dwa „zdegenerowane” elektrony, tzn. mają te same energie i liczby kwantowe. Prowadzi to do zjawiska zwanego „odpychaniem Pauli”, gdzie wydłużenie wiązań zachodzi do momentu zróżnicowania poziomów energetycznych dwóch elektronów. Zdecydowanie zaawansowany temat.
(zaawansowane) Referencje i dalsze czytanie
- Transition-State Spectroscopy of Cyclooctatetraene
Paul G. Wenthold, David A. Hrovat, Weston T. Borden, W. C. Lineberger.
Nauka, 1996, 272, 1456-1459 .
DOI: 10.1126/nauka.272.5267.1456
to badanie jest podstawą stwierdzenia, że niearomatyczny stan podstawowy cyklooktatetraenu jest 12 kcal/mol poniżej konformacji „antyaromatycznej”. - Oswajanie Cyklobutadienu
Donald J. Cram, Martin E. Tanner, Robert Thomas
Chem. Int. Ed. 1991, 30 (8), 1024-1027
DOI: 10.1002/ania.199110241
Ten artykuł autorstwa laureata Nagrody Nobla prof. Donalda J. Crama (UCLA) opisuje pierwszą spektroskopową charakterystykę cyklobutadienu. Osiąga się to poprzez zamknięcie prekursora w hemicarcerand (kompleks klatkowy), a następnie napromieniowanie go światłem UV, tworząc w ten sposób cyklobutadien, który nie jest w stanie nic zrobić, ponieważ jest uwięziony. - Cyklobutadien
Thomas Bally, Satoru Masamune
Tetrahedron 1980, 36 (3), 343-370
Doi: 1016/0040-4020(80)87003-7
Ten artykuł z 1980 roku zawiera przegląd prac wykonanych nad cyklobutadienem do tego czasu. Jest to podzielone na 2 części – eksperymentalne wysiłki syntetyczne i obliczenia teoretyczne. - Tetrahedrane i Cyklobutadien
Günther Maier
Chem. Int. Ed. 1988, 27 (3), 309-332
DOI: 10.1002/ania.198803093
w artykule omówiono syntetyczne wysiłki w kierunku tetrahedranu i cyklobutadienu – obie cząsteczki mają wzór C4H4. Tylko podstawione (tetra t-butyl i tetra trimetylosilil) tetraedrany zostały z powodzeniem zsyntetyzowane i wyizolowane do tej pory. - Cyklobutadien – and Benzocyclobutadien-Iron Tricarbonyl Complexes
F. Emerson, L. Watts, and R. Pettit
Journal of the American Chemical Society 1965, 87 (1), 131-133
doi: 10.1021/ja01079a032 - Cyklobutadieneiron Tricarbonyl. Nowy system aromatyczny
D. Fitzpatrick, L. Watts, G. F. Emerson, and R. Pettit
Journal of the American Chemical Society 1965, 87 (14), 3254-3255
doi: 10.1021/ja01092a050
temat bonusowy: cyklobutadien można stabilizować metalami – kompleks metaloorganiczny cyklobutadien żelazo trikarbonyl jest stabilnym, krystalicznym ciałem stałym. Jak wspominają autorzy, jest mało prawdopodobne, aby wolny cyklobutadien powstał w syntezie. - https://www.asu.edu/courses/chm233/notes/aromatic/aromaticRL1/antiaromatic.html
olanzapina przeciwpsychotyczna przyjmuje kształt motyla, aby uniknąć działania przeciwaromatycznego, podobny do cyklooktatetraenu. Jest to najwyraźniej kluczowe dla jego funkcji. - Antyaromatyczność
Ronald Breslow
Accounts of Chemical Research 1973, 6 (12), 393-398
Doi: 1021 / ar50072a001
co ciekawe, Prof. Breslow (Columbia) stwierdza w tym rachunku, że był osobą, która jako pierwsza zasugerowała termin „antyaromatyczny” dla szczególnie destabilizowanych związków cyklicznych z elektronami 4N P. Cytuje również inne prace Prof. M. J. S. Dewara i innych, w których antyaromatyczna destabilizacja cyklobutadienu jest obliczana na 18-33 kcal / mol w stosunku do liniowego butadienu. - Experimental Determination of the Antiaromatic of Cyclobutadien
Ashok A. Deniz, Kevin S. Peters, Gary J. Snyder
Science 1999, 286 (5442), 1119-1122
doi: 1126/science.286.5442.1119
jest to bardzo rygorystyczna praca, która wykorzystuje nowe techniki spektroskopowe do określenia antyaromatycznej destabilizacji cyklobutadienu. W odniesieniu do hipotetycznego sprzężonego odniesienia dienowego bez szczepu, cyklobutadien jest destabilizowany łącznie o 87 kcal / mol, z czego 32 kcal/mol można przypisać szczepowi pierścieniowemu, a 55 kcal/mol antyaromatyczności (w porównaniu z 21 kcal / mol dla aromatycznej stabilizacji benzenu). - Unsubstituted cyclopentadienyl cation, a ground-state triplet
Saunders, R. Berger, A. Jaffe, J. M. McBride, J. O ’ Neill, R. Breslow, J. M. Hoffmann, C. Perchonock, E. Wasserman, R. S. Hutton, V. J. Kuck
Journal of the American Chemical Society 1973, 95 (9), 3017-3018
Doi: 10.1021 / ja00790a049
kation cyklopentadienylu można przygotować tylko z trudem, jak opisuje niniejszy artykuł. Po uformowaniu ma trójpłytowy elektroniczny stan podstawowy (z 2 niesparowanymi elektronami) i może być scharakteryzowany przez spektroskopię EPR (electron paramagnetic resonance). - Oxirenes
Errol G. Lewars
recenzje chemiczne 1983, 83 (5), 519-534
doi: 10.1021 / cr00057a002