49-letni mężczyzna z historią nadużywania alkoholu przedstawia ED ze skargami uogólnionego bólu brzucha i wymiotami przez ostatnie 36 godzin. Pacjent jest dobrze znany Departamentowi z wizyt związanych z alkoholem i nadal pije codziennie. Po przybyciu ma tachykardię i tachykardię, a wyniki badań fizykalnych obejmują suche błony śluzowe, zmniejszoną sakin turgor, tkliwość nadbrzuszną i drżenie obu rąk. Badania laboratoryjne wykazują stężenie wodorowęglanów w surowicy 10 mEq/L, lukę anionową 30, stężenie glukozy w surowicy 95 mg / dL, kwasicę mleczanową o pH 7,2, hipofosfatemię i śladową ketonurię. Tomografia brzucha w normie. Zaprzecza przeszłości cukrzycy, spożyciu toksycznych alkoholi lub niedawnej chorobie.
ten pacjent może mieć jedną z wielu diagnoz, ale jego prezentacja i wyniki badań są najbardziej zgodne z alkoholową kwasicą ketonową (AKA). AKA może być powszechną diagnozą ED i zwykle występuje u przewlekłych pijących alkohol, którzy mają nagłe zaprzestanie spożycia alkoholu w połączeniu ze zmniejszonym spożyciem glikemii i niedoborem objętości wewnątrznaczyniowej.1
w większości przypadków, zdarzenia takie jak zapalenie trzustki, zapalenie błony śluzowej żołądka lub zachłystowe zapalenie płuc prowadzi do nagłego spadku spożycia doustnego. Około 24 do 72 godzin po zaprzestaniu przyjmowania PO, aka może się rozwinąć.2 pacjenci ci zwykle mają niskie lub nieobecne stężenie alkoholu w surowicy i mogą wykazywać różne stopnie odstawienia alkoholu. Jednak wyraźny sensorium jest cechą charakterystyczną tego stanu. Obecność zmiany w świadomości silnie sugeruje, że obecny jest inny proces.3
chociaż podstawowa patofizjologia jest złożona, właściwe zrozumienie znacznie pomaga w diagnozowaniu i leczeniu tego stanu.
istnieją trzy ogólne pojęcia, które napędzają AKA:
- spożycie alkoholu, połączone ze zmniejszonym spożyciem kalorii i odwodnieniem, sprzyja stanowi ketotycznemu.
kwasica ketonowa jest spowodowana przez kombinację czynników, w tym hipoinsulinemię wywołaną głodem, utlenianie alkoholu do różnych metabolitów ketonowych, lipolizę z uwalnianiem wolnego kwasu tłuszczowego (FFA) i skurcz objętości wewnątrznaczyniowej. Względny stan głodu w AKA prowadzi do nadmiernego wydzielania glukagonu i zmniejszenia obwodowego stężenia insuliny, co odgrywa kluczową rolę w rozwoju kwasicy ketonowej. Metabolizm tłuszczów poprzez lipolizę wytwarza beta-hydroksymaślan (BHB) i octan acytylu (ACA). Te Ketony są wykorzystywane do oddychania komórkowego, aby zapewnić energię poprzez produkcję adenozynotrifosforanu (ATP), ale dodać do kwasicy szczeliny anionowej widzianej w AKA.
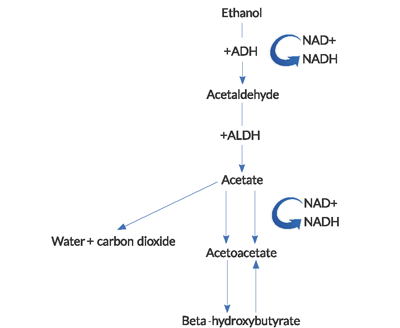
- podczas metabolizmu etanolu powstają duże ilości NADH (zredukowanej postaci dinukleotydu nikotynamidowo-adeninowego).4
NAD+ jest koenzymem używanym do przenoszenia elektronów w wewnątrzkomórkowych reakcjach redoks. Zmniejszenie NAD+ i wynikające z tego nagromadzenie i nierównowaga NADH w metabolizmie etanolu ma kilka ważnych konsekwencji. Generacja BHB dominuje nad produkcją ACA w tym wysokim stosunku NADH do NAD+. Ten nieprawidłowy stosunek prowadzi do zahamowania cyklu kwasu cytrynowego i glukoneogenezy wątroby, co częściowo wyjaśnia, dlaczego hiperglikemia jest rzadka u tych pacjentów.Prawie przeciwnie, występuje brak regeneracji normalnych poziomów NAD+ i ACA w AKA. Ponowne utlenianie NADH do NAD+ wydaje się być ograniczone przez kombinację czynników, w tym hipofosfatemię i blok funkcjonalny w mitochondriach.2kwasica mleczanowa u AKA jest spowodowana nieprawidłowym stanem redoks. Pirogronian jest substratem stosowanym w licznych szlakach wytwarzania energii, ale w alkoholowej kwasicy ketonowej jest przenoszony z normalnych szlaków metabolicznych na inne, które zwiększają produkcję mleczanów. Ponadto zaburzona jest regeneracja pirogronianu z kwasu mlekowego.
- podwyższony stan adrenergiczny i zmniejszenie objętości pogarszają ketozę i hamują glukoneogenezę, tworząc stan, który sprzyja tworzeniu i utrzymaniu środowiska ketotycznego.
organizm reaguje na głód, odwodnienie i hipoglikemię dzięki uwalnianiu hormonów przeciwregulacyjnych. Hormony te zwiększają napięcie współczulne, zmniejszają uwalnianie insuliny i zwiększają stężenie ketonów poprzez uwalnianie FFA i zmniejszają metabolizm ketonów obwodowych. Wszystkie te zmiany utrwalają stan ketotyczny, dopóki glukoza nie zostanie ponownie wprowadzona do systemu. Znaczne odwodnienie spowodowane wymiotami i zmniejszonym przyjmowaniem doustnym prowadzi do upośledzenia klirensu ketonów nerkowych, co dodatkowo pogarsza sytuację.2 diagnoza różnicowa dla AKA powinna obejmować ketozę głodową i cukrzycową kwasicę ketonową (DKA). Chociaż dokładna historia może pomóc w zawężeniu różnicowania, panel metaboliczny jest niezbędny do potwierdzenia diagnozy. Luki anionowe 30 mEq / L lub więcej można zobaczyć w AKA, choć luka może być zasłonięta przez towarzyszącą pierwotną zasadowicę metaboliczną z powodu wymiotów. W rzeczywistości istnieją doniesienia o przypadkach pacjentów z AKA, którzy mają alkalemiczne pH surowicy z powodu nadmiernych wymiotów.Luka anionowa w ketozie głodowej jest zazwyczaj znacznie niższa, przy poziomach wodorowęglanów rzadko poniżej 18 mEq / L, a Ph surowicy zwykle powyżej 7,30.2 w DKA natomiast szczelina anionowa może być dość wysoka, przy czym poziom wodorowęglanów często dochodzi do pojedynczych cyfr. Hiperglikemia z glikozurią, zwykle obserwowana w cukrzycowej kwasicy ketonowej (DKA), jest rzadka z AKA.Przewlekłe niedożywienie prowadzi do niskich rezerw glikogenu, a podwyższone napięcie adrenergiczne prowadzi do zahamowania glukoneogenezy wątroby. Ketonuria, obecna we wszystkich trzech tych schorzeniach, może zaburzać nasilenie AKA.Ketonuria jest mierzona za pomocą testu nitroprusydowego, w którym zmiana koloru wskazuje na względne stężenie acetonu i ACA w moczu. Obecność BHB, najwybitniejszego ketonu obecnego w AKA, nie jest odzwierciedlona w teście nitroprusydowym. To wyjaśnia, dlaczego pacjenci z AKA mogą nie wykazywać ketonurii lub tylko nieznaczne przy początkowej Prezentacji, z paradoksalnym wzrostem, gdy stan jest odwrócony. Ponieważ stosunek ACA: BHB normalizuje się, zarówno wykrywalne ACA, jak i BHB są usuwane z moczu.
diagnostyka różnicowa
w diagnostyce różnicowej należy również uwzględnić inne stany zagrażające życiu, które mogą powodować znaczącą kwasicę anionową. Toksyczne alkohole, w szczególności metanol i glikol etylenowy, mogą być celowo lub przypadkowo spożywane w tej populacji pacjentów. Spożycie to może powodować znaczną zachorowalność i śmiertelność, jeśli nie jest odpowiednio zarządzane.5 zmieniony stan psychiczny jest wspólną cechą spożywania toksycznego alkoholu, ale nie jest zwykle postrzegane w AKA.5
pacjenci zazwyczaj mają początkową lukę osmolarną, która przechodzi w zwiększoną lukę anionową, gdy toksyczny alkohol jest metabolizowany. Podwyższone stężenie BHB w surowicy może być dość podwyższone w AKA, ale to niekoniecznie wyklucza możliwość spożycia toksycznego alkoholu; ani brak szczeliny osmolarnej lub anionowej wyklucza diagnozę. Podczas gdy pacjenci w AKA mają niewielką kwasicę mleczanową, obecność znacznie podwyższonego poziomu mleczanów powinna skłaniać do poszukiwania podstawowej choroby. Rzadko może wystąpić połączenie AKA i jednego z tych innych zdarzeń i stanowić zagadkę diagnostyczną. Przemyślane rozważenie czasu, rodzaju i ilości połknięcia oraz towarzyszących objawów, w połączeniu z obserwacją i badaniami laboratoryjnymi, należy zastosować do tego rozróżnienia, jeśli brakuje jasnej i dokładnej historii.
leczenie
odwrócenie ketozy i energiczne nawodnienie są centralne w leczeniu AKA. Oprócz wymiany płynów izotonicznych potrzebne są płyny dożylne zawierające dekstrozę. Zazwyczaj 5% dekstrozy z półwytrawnym roztworem soli fizjologicznej w tempie 150 mL na godzinę zapewnia wystarczającą ilość glukozy, aby stymulować trzustkę do wydzielania insuliny, umożliwiając tkankom obwodowym metabolizowanie ketonów i hamowanie uwalniania FFA.2 pozwala również organizmowi regenerować NAD+, który jest hamowany przez zmiany metaboliczne spowodowane przez AKA. Dożylne wlewy płynów zawierających dekstrozę należy przerwać, gdy stężenie wodorowęglanów osiągnie 18-20 mEq/l, a pacjent toleruje przyjmowanie doustne. Zwykle dzieje się to po 8 do 16 godzinach od rozpoczęcia leczenia.2 odstawienie alkoholu u tych pacjentów powinno być agresywnie zarządzane za pomocą dożylnych benzodiazepin. Tiamina, kwas foliowy i inne elektrolity, w szczególności fosforan i potas, mogą wymagać uzupełnienia u tych pacjentów.6 Co ciekawe, większość zachorowalności u AKA wynika z leżącego u podstaw procesu, który spowodował zaprzestanie spożywania alkoholu.
podsumowanie przypadku
pacjent otrzymał 4 litry soli fizjologicznej i został rozpoczęty od d5-1/2 NS przed przyjęciem. Do odstawienia alkoholu podawano mu IV valium, a tiaminę, kwas foliowy i fosforan uzupełniano. Był hospitalizowany przez trzy dni w celu leczenia AKA i odstawienia alkoholu, a następnie zwolniony po tolerowaniu doustnego spożycia i w dobrym stanie. Był widziany trzy tygodnie później w oddziale ratunkowym na podobną prezentację.
Tabela 1. Characteristics of Common Ketoacidoses
| Diabetic Ketoacidosis | Alcoholic Ketoacidosis | Starvation Ketoacidosis | |
| Bicarbonate | Can reach single digits | Can reach single digits | > 18 |
| Glucose | Elevated | Low to mildly elevated | Low to normal |
| Measurable ketonuria | Present | Absent or present | Present |
Figure 1. Szlak metabolizmu alkoholu
(ADH = dehydrogenaza alkoholowa, ALDH = dehydrogenaza aldehydu octowego).
- Palmer, Jerry P. Alcohol ketoacidosis: clinical and laboratory presentation, pathophysiology and treatment. Klinika Endokrynologii i metabolizmu 12.2 (1983): 381-389.
- Duffens K, Marx JA. Alkoholowy przegląd ketoacidosisa.The Journal of emergency medicine 5.5 (1987): 399-406.
- Wrenn KD, Slovis CM, Minion GE, et al. Zespół alkoholowej kwasicy ketonowej. The American journal of medicine 91.2 (1991): 119-128.
- Marx JA, Hockberger RS, Walls RM, et al., eds. Medycyna ratunkowa Rosens™: koncepcje i praktyka kliniczna. Philadelphia, PA: Mosby / Elsevier; 2013. Rozdział 185 choroba alkoholowa Johna T. Finnella.
- Kraut ja, Kurtz I. “Toxic spożycie alkoholu: cechy kliniczne, diagnoza, i zarządzanie. Clinical Journal of the American Society of Nephrology 3.1 (2008): 208-225.
- Miller PD, Heinig R, Waterhouse C. Leczenie kwasicy alkoholowej: rola dekstrozy i fosforu. Archives of internal medicine 138.1 (1978): 67-72.