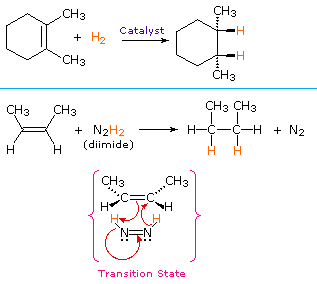
dodanie wodoru do wiązania podwójnego węgiel-węgiel nazywa się uwodornieniem. Ogólnym efektem takiego dodawania jest redukcyjne usunięcie grupy funkcyjnej wiązania podwójnego. Regioselektywność nie jest problemem, ponieważ ta sama grupa (atom wodoru)jest związana z każdym z atomów węgla o podwójnym wiązaniu. Najprostszym źródłem dwóch atomów wodoru jest wodór cząsteczkowy (H2), ale mieszanie alkenów z wodorem nie powoduje żadnej dostrzegalnej reakcji. Chociaż ogólna reakcja uwodornienia jest egzotermiczna, wysoka energia aktywacji uniemożliwia jej zajście w normalnych warunkach. Ograniczenie to można obejść poprzez zastosowanie katalizatora, jak pokazano na poniższym schemacie.

katalizatory to substancje, które zmieniają szybkość (prędkość) reakcji chemicznej, nie będąc zużyte ani nie pojawiając się jako część produktu. Katalizatory działają poprzez obniżenie energii aktywacji reakcji, ale nie zmieniają względnej energii potencjalnej reagentów i produktów. Drobno podzielone metale, takie jak platyna, pallad i nikiel, należą do najczęściej stosowanych katalizatorów uwodornienia. Katalityczne uwodornienie odbywa się w co najmniej dwóch etapach, jak przedstawiono na schemacie. Po pierwsze, Alken musi być adsorbowany na powierzchni katalizatora wraz z częścią wodoru. Następnie dwa wodory przechodzą z powierzchni metalu do węgli wiązania podwójnego, a powstały nasycony węglowodór, który jest słabiej adsorbowany, opuszcza powierzchnię katalizatora. Dokładny charakter i czas ostatnich wydarzeń nie jest dobrze poznany.
jak pokazano na wykresie energetycznym, uwodornienie alkenów jest egzotermiczne, a ciepło jest uwalniane zgodnie z ΔE (kolor zielony) na wykresie. To ciepło reakcji można wykorzystać do oceny stabilności termodynamicznej alkenów posiadających różną liczbę podstawników alkilowych na wiązaniu podwójnym. Na przykład w poniższej tabeli wymieniono nagrzewanie uwodornienia dla trzech alkenów C5H10, które dają ten sam produkt alkanowy (2-metylobutan). Ponieważ duże ciepło reakcji wskazuje na wysoką energię reagenta, te ciepło jest odwrotnie proporcjonalne do stabilności izomerów alkenów. Z przybliżeniem widzimy, że każdy podstawnik alkilowy na podwójnym wiązaniu stabilizuje tę grupę funkcyjną o nieco więcej niż 1 kcal / mol.
| izomer Alkenowy | (CH3)2CHCH=CH2 3-metylo-1-buten |
CH2=C(CH3)ch2ch3 2-metylo-1-buten |
(CH3)2C=chch3 2-metylo-2-buten |
|---|---|---|---|
| ciepło reakcji ( δhº ) |
-30,3 kcal/mol | -28,5 kcal/mol | -26,9 kcal/kret |
z pokazanego tutaj mechanizmu spodziewalibyśmy się, że dodanie wodoru nastąpi z syn-STEREOSELEKTYWNOŚCIĄ. Często jest to prawdą, ale katalizatory uwodornienia mogą również powodować izomeryzację wiązania podwójnego przed dodaniem wodoru, w którym to przypadku stereoselektywność może być niepewna.
tworzenie kompleksów metali przejściowych z alkenami zostało przekonująco wykazane przez izolację stabilnych kompleksów platyny, takich jak sól Zeise ’ a, K. H2o i etylenobis(trifenylofosfina)platyna, 2PT(H2C=CH2). W tej ostatniej platyna jest trójwartościowa i zerowartościowa, podczas gdy sól Zeise ’ a jest pochodną platyny(II). Model soli Zeise ’ a i omówienie niezwykłych wiązań w takich kompleksach można obejrzeć klikając tutaj. Podobne kompleksy odnotowano dla niklu i palladu, metali, które również działają jako katalizatory uwodornienia alkenów.
niekatalityczna procedura dodawania wodoru przez syn wykorzystuje nietrwały związek diimidowy, N2H2. Odczynnik ten musi być świeżo wytworzony w układzie reakcyjnym, zwykle przez utlenianie hydrazyny, a silnie egzotermiczna reakcja sprzyja eliminacji gazu azotowego (bardzo stabilnego związku). Diimid może występować jako izomery cis-trans; tylko izomer cis służy jako środek redukujący. Przykłady redukcji alkenów w obu procedurach przedstawiono poniżej.
autorzy
- William Reusch, profesor Emeritus (Michigan State U.), wirtualny Podręcznik Chemii Organicznej