diagram Lewisa wielu cząsteczek nie jest jednak zgodny z obserwowanymi właściwościami cząsteczki.
przykład 1: Jon azotanowy
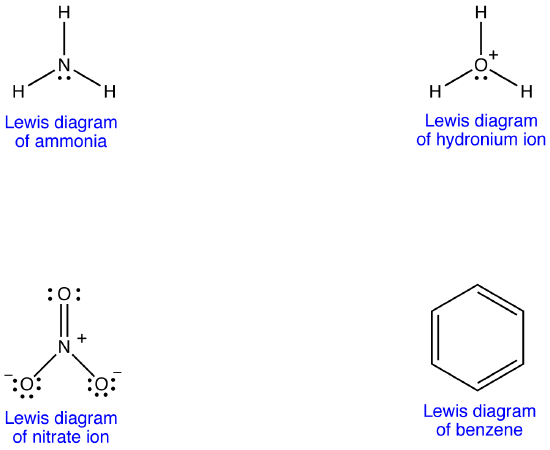
jon azotanowy, zgodnie z diagramem Lewisa, ma dwa rodzaje wiązań azotowo-tlenowych, jedno wiązanie podwójne i dwa wiązania pojedyncze, co sugeruje, że jedno wiązanie azotowo-tlenowe w Jonie azotanowym jest krótsze i silniejsze niż każde z pozostałych dwóch. Ponadto struktura Lewisa zakłada, w odniesieniu do ładunku formalnego, że istnieją dwa rodzaje atomów tlenu w Jonie azotanowym, jeden formalnie neutralny i każdy z pozostałych dwóch noszących ładunek formalny -1. Eksperymentalnie jednak, trzy wiązania azot-tlen w Jonie azotanowym mają taką samą długość wiązania i taką samą energię wiązania, a trzy atomy tlenu są nie do odróżnienia. Diagram Lewisa nie wyjaśnia w sposób zadowalający struktury i wiązania jonów azotanowych.
można narysować dwa dodatkowe diagramy Lewisa dla jonu azotanowego.
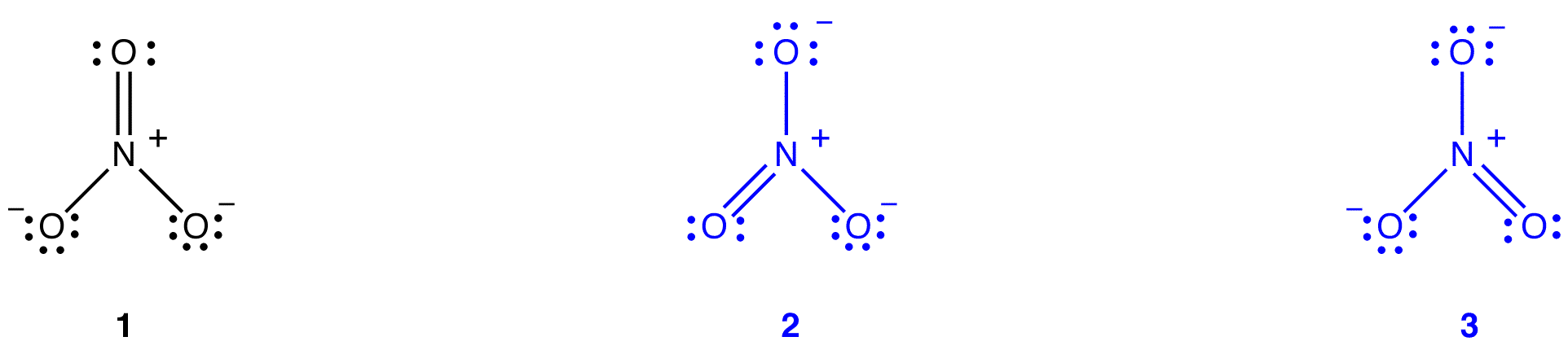
jednak żaden z nich nie jest zgodny z obserwowanymi właściwościami jonu azotanowego i dlatego nie przedstawia prawidłowo jonu azotanowego.
przykład 2: Benzen
benzen, zgodnie z diagramem Lewisa, ma dwa rodzaje wiązań węgiel-węgiel, trzy podwójne wiązania i trzy pojedyncze wiązania, co sugeruje, że każde z trzech wiązań węgiel-węgiel w benzenie jest krótsze i silniejsze niż każde z pozostałych trzech. Eksperymentalnie jednak sześć wiązań węgiel-węgiel w benzenie ma taką samą długość wiązania i taką samą energię wiązania. Diagram Lewisa nie wyjaśnia w sposób zadowalający struktury i wiązania benzenu.
atrybutem cząsteczek, których klasyczny diagram Lewisa nie jest zgodny z obserwowanymi właściwościami, jest możliwość wygenerowania dla nich innych ważnych diagramów Lewisa. Dla benzenu można narysować dodatkowy diagram Lewisa.

jednak żaden z nich nie jest zgodny z obserwowanymi właściwościami benzenu i dlatego nie przedstawia prawidłowo benzenu.
teoria rezonansu jest próbą wyjaśnienia struktury gatunku, np. jonu azotanowego czy benzenu, którego żaden diagram Lewisa nie jest zgodny z obserwowanymi właściwościami gatunku. Główną zaletą teorii rezonansu jest to, że chociaż opiera się na rygorystycznej analizie matematycznej, teoria rezonansu może być z powodzeniem stosowana, odwołując się do małej lub żadnej matematyki. Teoria rezonansu jest wyjaśniona poniżej, używając jonu azotanowego jako przykładu.
zgodnie z teorią rezonansu, struktura jonu azotanowego Nie wynosi 1 Ani 2 ani 3, ale średnią wszystkich trzech z nich, ważoną stabilnością. Diagramy Lewisa 1, 2 i 3 nazywane są postaciami rezonansowymi, strukturami rezonansowymi lub wkładami rezonansowymi jonu azotanowego. Struktura jonu azotanowego jest uważana za hybrydę rezonansową lub po prostu hybrydę form rezonansowych 1, 2 i 3. Ilekroć konieczne jest pokazanie struktury jonu azotanowego, formularze rezonansowe 1, 2 i 3 są rysowane, połączone podwójną strzałką.
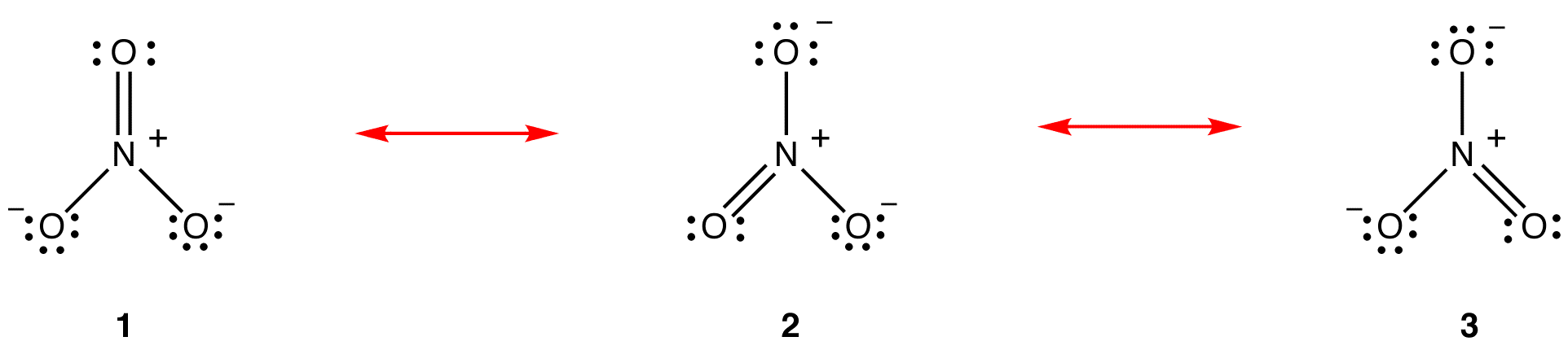
trzy formy rezonansowe jonu azotanowego, 1, 2 i 3, są identyczne, więc mają taką samą stabilność i dlatego w równym stopniu przyczyniają się do hybrydy. Ponieważ dokładny stopień, w jakim każda forma rezonansowa jonu azotanowego przyczynia się do hybrydy, jest znany, można łatwo określić kolejność wiązania każdego wiązania azot-tlen, a także formalny ładunek na każdym atomie tlenu w hybrydzie:
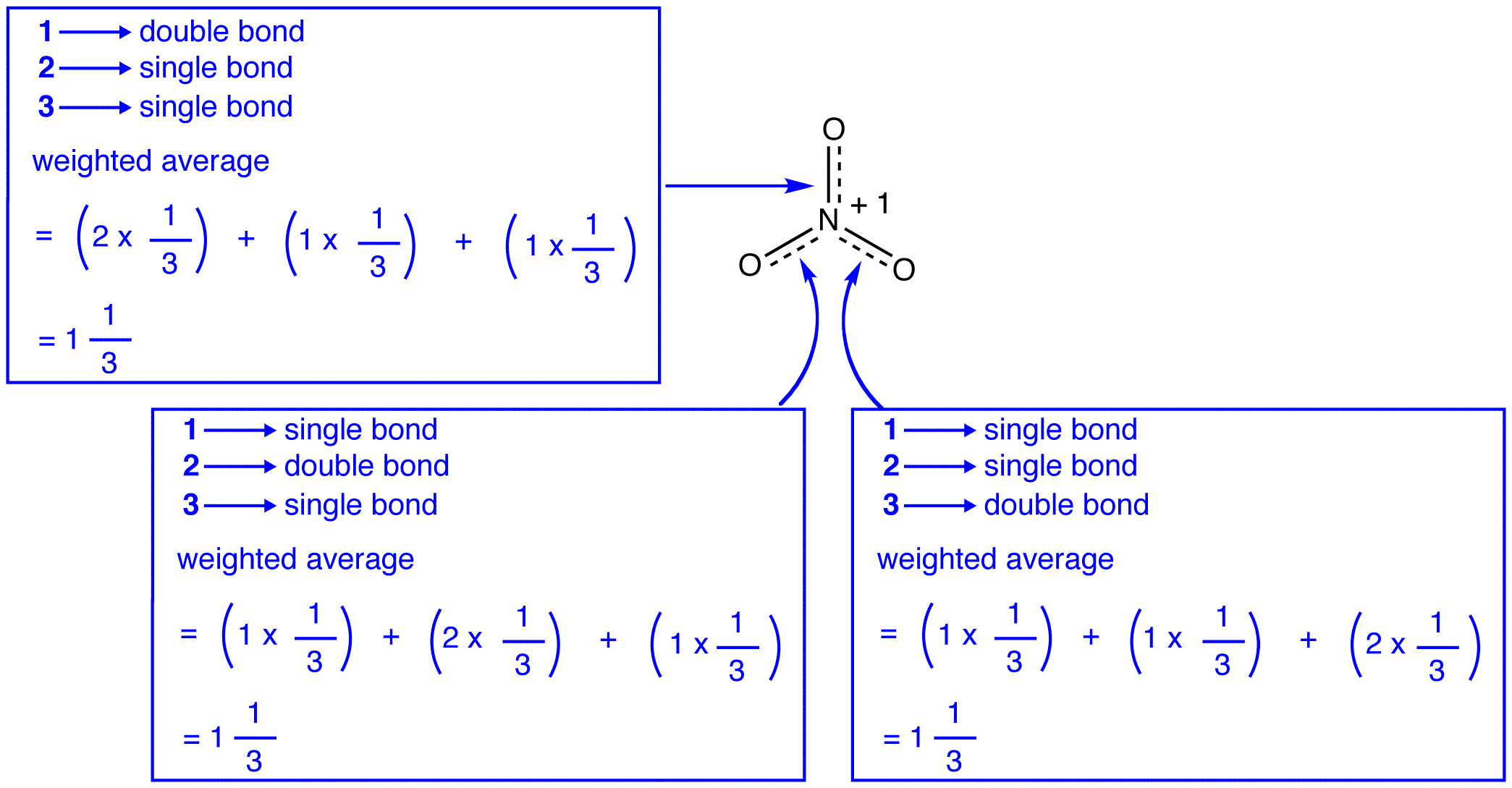
zgodnie z teorią rezonansu, każde Wiązanie w Jonie azotanowym jest jedną i jedną trzecią wiązania, co jest zgodne z obserwacją, że trzy wiązania w Jonie azotanowym mają tę samą długość wiązania i tę samą energię wiązania.
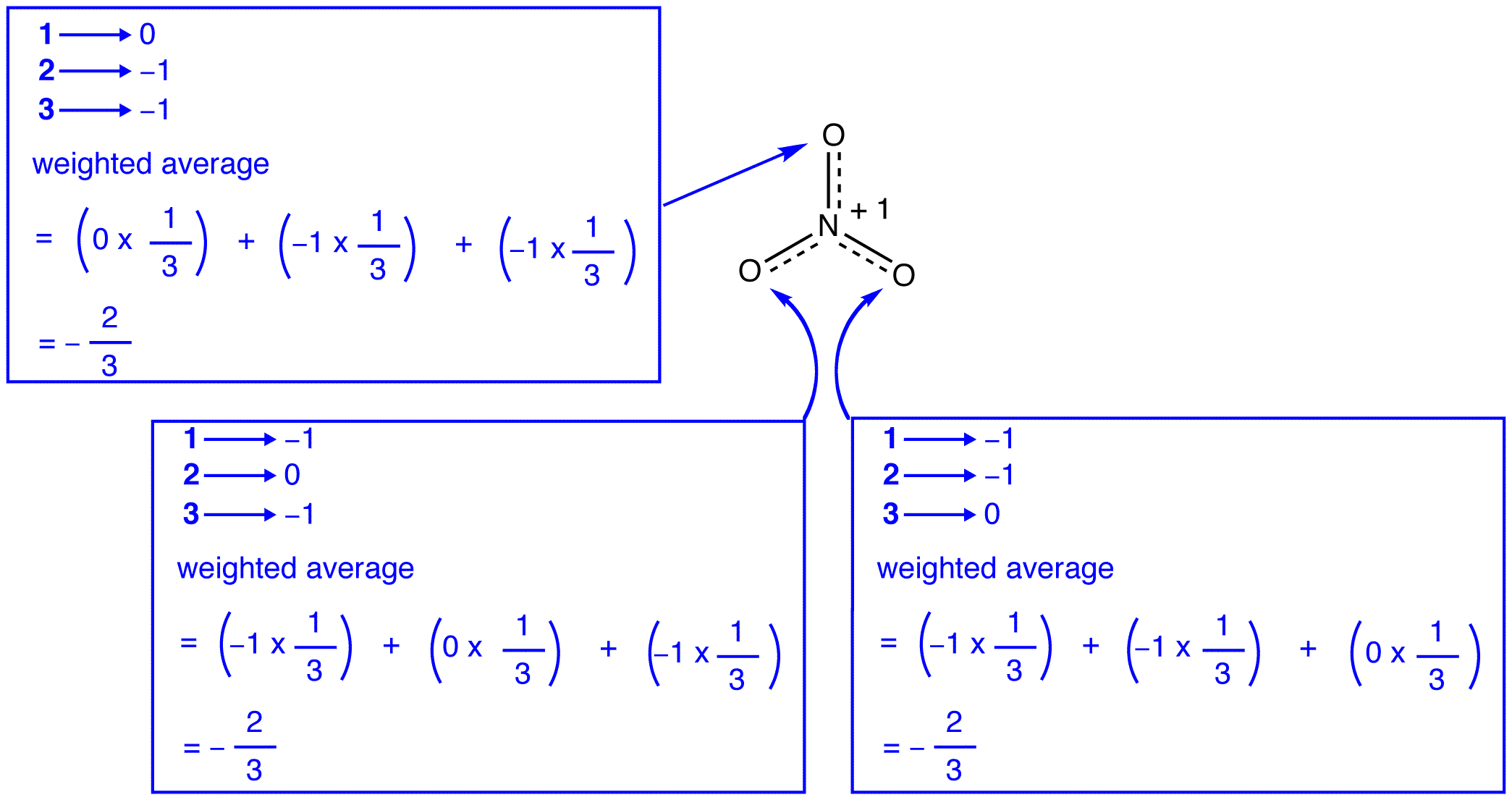
zgodnie z teorią rezonansu, każdy atom tlenu w Jonie azotanowym ma formalny ładunek -2 / 3, co w połączeniu z faktem, że trzy wiązania azot-tlen są identyczne, jest zgodne z obserwacją, że trzy atomy tlenu w Jonie azotanowym są nie do odróżnienia.
w każdej formie rezonansowej jonu azotanowego występują dwa elektrony pi i dzielą je tylko dwa atomy. Mówi się, że elektron dzielony tylko przez dwa atomy jest zlokalizowany. Tak więc, dwa elektrony pi w każdej formie rezonansowej jonu azotanowego są zlokalizowane. Jon azotanowy, reprezentowany przez hybrydę, ma dwa elektrony pi:
# elektrony w jednym wiązaniu pi = 2
# elektrony w jednej trzeciej wiązania pi = 2/3
# elektrony w trzech z nich = 3 x (2/3) = 2
dwa elektrony pi w Jonie azotanowym dzielą się w sumie czterema atomami, jednym atomem azotu i trzema atomami tlenu. Mówi się, że elektron dzielony przez więcej niż dwa atomy jest delokalizowany. Tak więc dwa elektrony pi w Jonie azotanowym są delokalizowane. Delokalizacja elektronów pi w Jonie azotanowym wymaga, aby cztery atomy znajdowały się na tej samej płaszczyźnie, umożliwiając boczne nakładanie się na nie orbitali P.

Jeśli energia jonu azotanowego była średnią ważoną energii jego trzech form rezonansowych, tak jak struktura jonu azotanowego jest średnią ważoną struktur jego trzech form rezonansowych, powinna być równa energii jednej z trzech identycznych form rezonansowych:

jeśli energia hybrydy była równa energii postaci rezonansowej, biorąc pod uwagę, że wszystkie jednostki chemiczne (cząstki elementarne, Atomy, cząsteczki itp.) naturalnie mają tendencję do znajdowania się w najniższym możliwym stanie energetycznym, nie byłoby korzyści dla jonu azotanowego, aby istniał jako hybryda; może on po prostu istnieć jako forma rezonansowa. Ponieważ jon azotanowy istnieje jako hybryda, a nie jako forma rezonansowa, można wywnioskować, że energia hybrydy jest niższa niż energia którejkolwiek z form rezonansowych.

zgodnie z teorią rezonansu energia cząsteczki jest niższa od energii najniższej formy rezonansowej. Ponieważ jon azotanowy ma niższą energię, a zatem jest bardziej stabilny niż jakakolwiek z jego form rezonansowych, mówi się, że Jon azotanowy jest stabilizowany rezonansowo.
istnieją dwa błędne przekonania na temat teorii rezonansu wśród początkujących studentów, prawdopodobnie z powodu dosłownej interpretacji słowa rezonans. Są one opisane poniżej, używając jonu azotanowego jako przykładu.
nieporozumienie 1: Jon azotanowy istnieje jako forma rezonansowa 1 przez chwilę, a następnie zmienia się albo w formę rezonansową 2, albo w formę rezonansową 3, która interkonwertuje lub wraca do 1.

struktura jonu azotanowego nie jest 1 Ani 2 ani 3, ale hybrydą i nie zmienia się z czasem, chyba że przechodzi reakcję.
błędne przekonanie 2: w próbce jonów azotanowych w danym momencie jedna trzecia jonów występuje jako forma rezonansowa 1, kolejna jedna trzecia jako forma rezonansowa 2, a pozostała jedna trzecia jako forma rezonansowa 3.

w próbce jonów azotanowych w danym momencie wszystkie jony mają tę samą strukturę, która jest hybrydą.
klasyczną analogią używaną do wyjaśnienia tych dwóch błędnych przekonań jest mule (Morrison, R. T.; Boyd, R. N. Organic Chemistry, fifth edition; Allyn and Bacon: Boston, 1987, str. 373). Biologicznie muł jest hybrydą konia i osła. Nie oznacza to, że muł przez chwilę przypomina konia, a następnie zmienia się w osła. Wygląd muła jest połączeniem wyglądu konia i osła i nie zmienia się z czasem. Nie oznacza to również, że w stadzie niektóre muły przypominają konia, a inne osła. W stadzie wszystkie muły mają taki sam wygląd, który jest połączeniem konia i osła. Słabością tej analogii jest to, że konie i osły istnieją, podczas gdy formy rezonansowe są ściśle hipotetyczne. Lepszą analogią, cytowaną w Morrisonie i Boydzie, jest nosorożec. Widząc nosorożca, można go opisać jako hybrydę smoka i jednorożca, dwóch nieistniejących stworzeń.
zasady rysowania formularzy rezonansowych
1. Formy rezonansowe to diagramy Lewisa, które opierają się na teorii wiązań walencyjnych.Muszą zatem przestrzegać podstawowych zasad teorii wiązania walencyjnego. Tak więc Wodór nie może mieć więcej niż dwa elektrony walencyjne; okres-dwa elementy nie mogą mieć więcej niż osiem elektronów walencyjnych; elementy w okresie trzecim i poniżej mogą mieć więcej niż osiem elektronów walencyjnych. na przykład: w każdej postaci rezonansowej jonu azotanowego występują dwa pierwiastki, azot i tlen, które są okresem-dwa pierwiastki. W żadnej z form rezonansowych jonów azotanowych jest więcej niż osiem elektronów walencyjnych na każdym z atomów.
2. Wszystkie formy rezonansowe muszą mieć tę samą strukturę wiązania sigma, różniącą się jedynie położeniem elektronów pi i niezwiązanych elektronów walencyjnych. np: wszystkie trzy formy rezonansowe jonu azotanowego mają tę samą strukturę wiązania sigma:
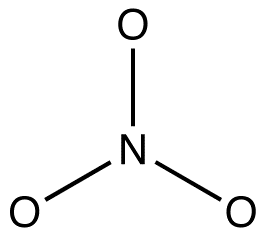
różnią się od siebie jedynie lokalizacją elektronów pi i samotnych par.
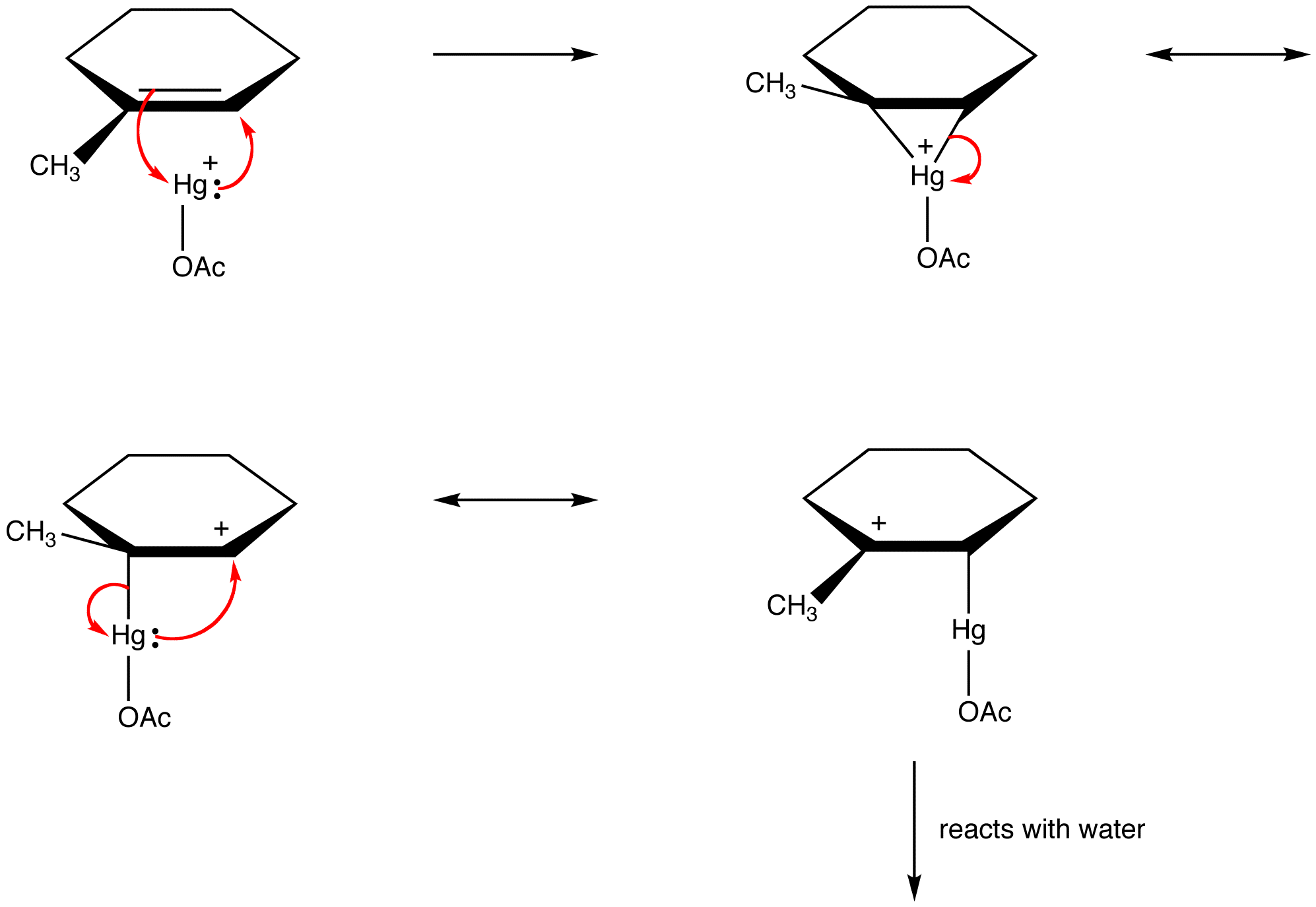
chemicy organiczni coraz częściej łamią tę zasadę w celu wyjaśnienia struktur reaktywnych półproduktów jako gatunków stabilizowanych rezonansem. np: oksymerkuracja
określenie względnego udziału form rezonansowych w hybrydzie
trzy formy jonu azotanowego są identyczne i dlatego mają taką samą stabilność. W konsekwencji w równym stopniu przyczyniają się do hybrydy. Formy rezonansowe większości cząsteczek stabilizowanych rezonansami różnią się od siebie, więc nie przyczyniają się w równym stopniu do hybrydy. Im bardziej stabilna forma rezonansu, tym bardziej przyczynia się do hybrydy. Tak więc określenie względnego udziału lub postaci rezonansowych w hybrydzie wymaga określenia ich względnej stabilności. Użyj następujących zasad, aby określić względną stabilność form rezonansowych.
Zasada 1:
forma rezonansowa, w której wszystkie atomy mają oktet elektronów walencyjnych, jest bardziej stabilna niż ta, w której przynajmniej jeden atom nie ma. eg:
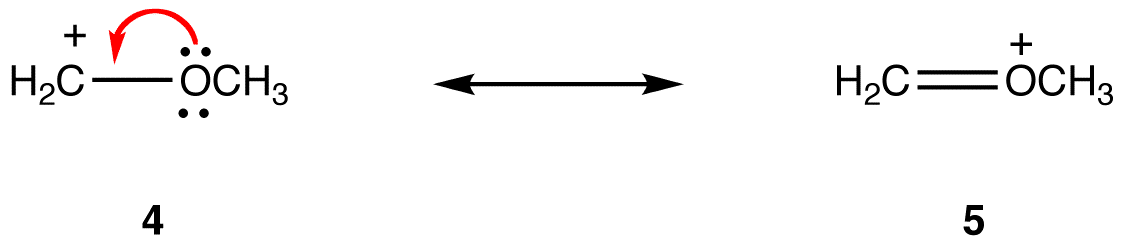
w formie rezonansu 5 wszystkie atomy mają oktet elektronów walencyjnych; w 4, jeden atom, atom węgla noszący formalny ładunek +1, nie. Tak więc forma rezonansowa 5 jest bardziej stabilna niż forma rezonansowa 4.
reguła 2:
Wszystko inne jest równe, forma rezonansowa, która ma formalny ładunek ujemny na atomie bardziej elektroujemnym, jest bardziej stabilna niż ta, która ma formalny ładunek ujemny na atomie mniej elektroujemnym. eg:
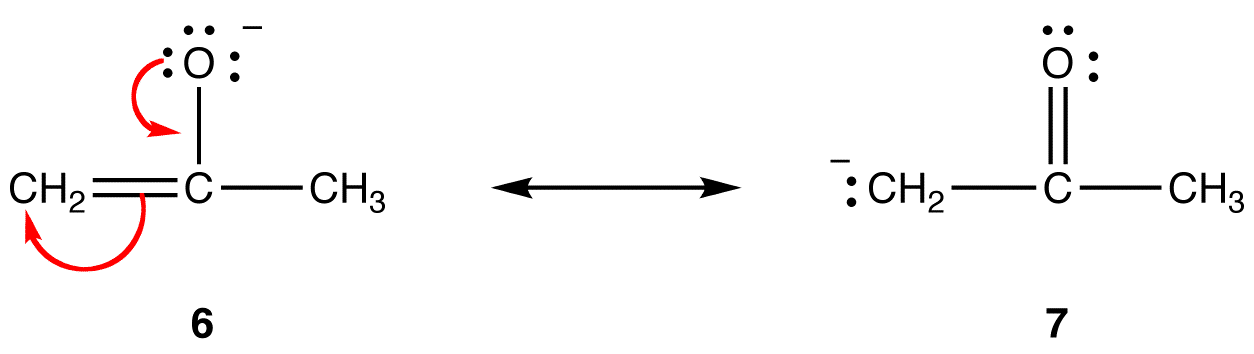
w postaci rezonansowej 6 formalny ładunek ujemny znajduje się na atomie tlenu, w 7-na atomie węgla. Tlen jest bardziej elektroujemny niż węgiel. Tak więc forma rezonansowa 6 jest bardziej stabilna niż forma rezonansowa 7.
tendencja jest odwrotna w odniesieniu do formalnych obciążeń dodatnich. Wszystko inne jest równe, forma rezonansowa, która ma formalny ładunek dodatni na atomie mniej elektroujemnym, jest bardziej stabilna niż ta, która ma formalny ładunek dodatni na atomie bardziej elektroujemnym. eg:
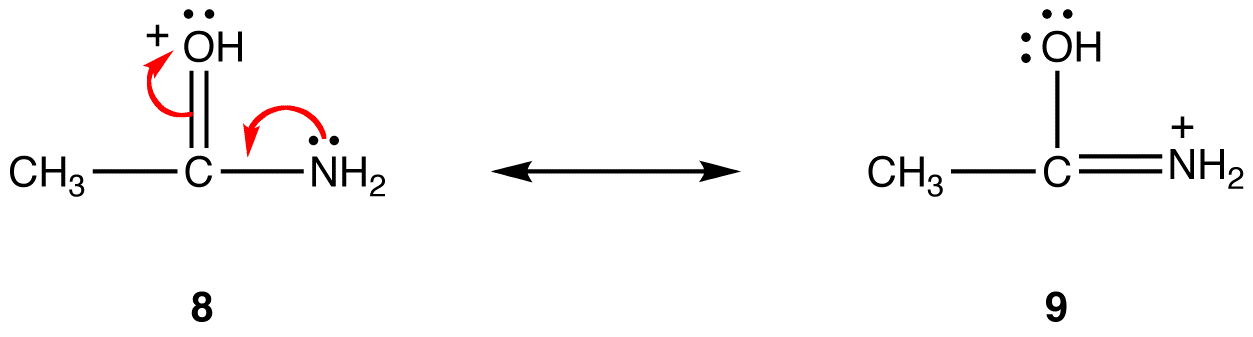
w postaci rezonansowej 8 formalny ładunek dodatni znajduje się na atomie tlenu, w 9-na atomie azotu. Azot jest mniej elektroujemny niż tlen, dlatego forma rezonansowa 9 jest bardziej stabilna niż forma rezonansowa 8.
reguła 3:
Wszystko inne jest równe, forma rezonansowa, która nie ma separacji ładunku, zwana formą rezonansu dipolarnego, jest bardziej stabilna niż ta, która ma. NP:
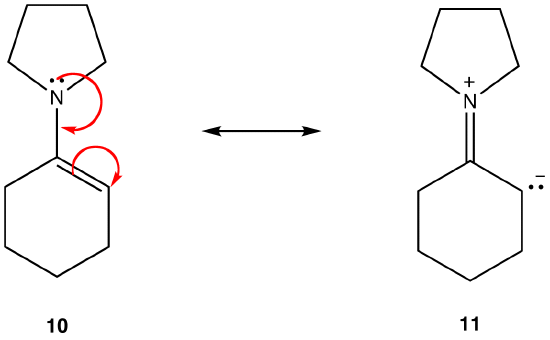
forma rezonansu 11 jest formą rezonansu dipolarnego; 10 nie jest. Tak więc 10 jest bardziej stabilne niż 11. Reguła ta jest konsekwencją wektorowej postaci prawa Coloumba, zgodnie z którą ładunki przeciwne przyciągają. Następstwem jest to, że aby utrzymać przeciwne ładunki oddzielone, potrzebna jest energia, co oznacza, że 11 ma wyższą energię niż 10, więc 10 jest bardziej stabilne niż 11.
reguła 4:
w formach rezonansu dipolarnego, Wszystko inne jest równe, im większa odległość między oddzielonymi ładunkami, tym bardziej stabilna jest forma rezonansu. NP:
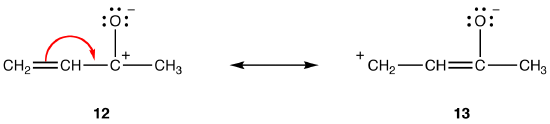
obie formy rezonansu 12 i 13 są formami rezonansu dipolarnego. Odległość między oddzielonymi ładunkami jest większa w 13 (trzy wiązania) niż w 12 (jedno wiązanie), więc 13 jest bardziej stabilny niż 12. Zasada ta jest konsekwencją postaci skalarnej prawa Coloumba, które mówi, że siła przyciągania między przeciwnymi ładunkami jest odwrotnie proporcjonalna do kwadratu odległości między nimi. Tak więc energia potrzebna do rozdzielenia przeciwnych ładunków w 12 jest wyższa niż w 13, co oznacza, że 12 ma wyższą energię niż 13, więc 13 jest bardziej stabilny niż 12.
powyższe zasady nie mogą mieć zastosowania do rezonansu z udziałem pierwiastków z okresu trzeciego i poniżej, ze względu na ich zdolność do pomieścić więcej niż osiem elektronów w powłoce walencyjnej. NP:
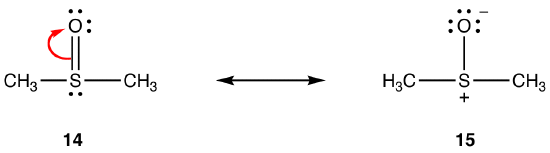
wiązanie podwójne w 14 składa się z wiązania sigma i wiązania utworzonego przez nałożenie się orbitalu 2P, zawierającego dwa elektrony, w atomie tlenu i pusty orbital 3d w atomie siarki. Te dwa orbitale mają bardzo różne energie, rozmiary i kształty, więc nakładanie się między nimi, znane jako interakcja pn–dn, jest słabe. W związku z tym w wiązaniu Siarka-tlen w hybrydzie nie ma charakteru wiązania podwójnego, tzn. 15 jest główną formą rezonansu.
autorzy i atrybuty
- Gamini Gunawardena ze strony OChemPal (Utah Valley University)