Chemguide: Core Chemistry 14 – 16
podwójne i potrójne wiązania kowalencyjne
ta strona wprowadza możliwość wielokrotnych (podwójnych lub potrójnych) wiązań kowalencyjnych między atomami przy użyciu tlenu, azotu, dwutlenku węgla i etenu jako przykłady. Są one wybierane, ponieważ wszystkie są powszechnie określone w brytyjskich sylabusach dla dzieci w wieku 14-16 lat.
zakładam, że przeczytałeś stronę wprowadzającą wiązanie kowalencyjne i masz dostęp do układu okresowego takiego jak ten, który możesz pobrać z tej strony.
podwójne wiązanie w tlenie
Jeśli spojrzysz na tlen w układzie okresowym, zobaczysz, że ma on liczbę atomową 8 – a więc ATOM neutralny ma 8 protonów i 8 elektronów. Będą one rozmieszczone 2,6.
więc masz dwa atomy w ten sposób:
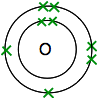
każdy ma dwa niesparowane elektrony. Aby uzyskać maksymalną stabilność energetyczną, wszystkie te elementy muszą zostać sparowane.
więc atomy tlenu dzielą dwie pary elektronów:
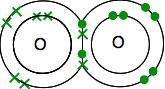
To jest znacznie łatwiejsze do zobaczenia za pomocą linii do reprezentowania par wspólnych elektronów:
![]()
potrójne Wiązanie w Azocie
Jeśli znajdziesz azot w układzie okresowym, będzie można obliczyć, że jego struktura elektroniczna wynosi 2,5. Porównując go z tlenem, ma więc jedną parę elektronów i trzy niesparowane elektrony na swoim zewnętrznym poziomie.
aby był jak najbardziej stabilny energetycznie, będzie musiał sparować wszystkie te wiązania W wiązania kowalencyjne. Dwa atomy azotu połączą się w ten sposób:
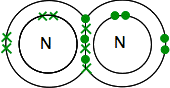
ponownie jest to znacznie łatwiejsze do zaobserwowania za pomocą linii do reprezentowania par wspólnych elektronów:
![]()
podwójne wiązanie w elektronach dwutlenek węgla
struktura elektronowa węgla wynosi 2,4 z 4 niesparowanymi elektronami na poziomie zewnętrznym.
tlen wynosi 2,6 z 2 parami elektronów i 2 niesparowanymi elektronami na poziomie zewnętrznym.
musisz skończyć ze wszystkimi elektronami sparowanymi-i jest tylko jeden sposób, aby to zrobić.
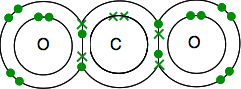
jak poprzednio, Wiązanie jest łatwiejsze do zaobserwowania za pomocą linii do wiązania par elektronów.
![]()
Jeśli istnieją dwie pary wiązań elektronów między dwoma atomami, nazywa się to wiązaniem podwójnym. Więc każdy tlen jest połączony z atomem węgla w środku podwójnym wiązaniem.
podwójne wiązanie w etenie, C2H4
Eten i inne podobne związki z podwójnymi wiązaniami między atomami węgla są ważnymi substancjami w chemii. Poznasz ich bardziej szczegółowo w dalszej części kursu.
przyjrzyj się uważnie diagramowi kropek i krzyży i upewnij się, że rozumiesz, jak to wszystko do siebie pasuje. Musi tak być, aby wszystkie pojedyncze elektrony zarówno w węglach, jak i wodorach były sparowane w pary wiążące.
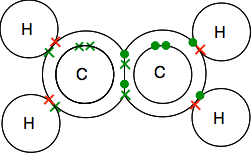
Jeśli natkniesz się na diagramy przedstawiające pary łączące jako linie, możesz znaleźć jedną z dwóch wersji.
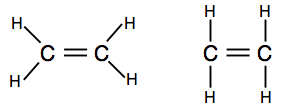
pierwszy pokazuje rzeczywisty kształt cząsteczki lepiej, ale drugi jest również doskonale akceptowalny na tym poziomie.
gdzie chciałbyś teraz pojechać?
do następnej strony w tym dziale o wiązaniu kowalencyjnym. . .
do menu Struktura atomowa i Wiązanie . . .
do menu Chemia 14-16 . . .
do Menu Głównego Chemguide . . .