nazwa ogólna: fluocinonide
postać dawkowania: maść
Drugs.com. Ostatnia aktualizacja Dec 22, 2020.
- przegląd
- skutki uboczne
- dawkowanie
- profesjonalne
- interakcje
- Więcej
tylko Rx
Nazwa marki Lidex została wycofana w USA.jeśli generyczne wersje tego produktu zostały zatwierdzone przez FDA, mogą być dostępne ich generyczne odpowiedniki.
Lidex opis
LIDEX® (fluocinonide) maść 0,05% jest przeznaczony do podawania miejscowego. Aktywnym składnikiem jest fluocynonid kortykosteroidu, który jest 21-octanowym estrem acetonidu fluocynolonu i ma nazwę chemiczną pregna-1,4-dieno-3,20-dion,21-(acetyloksy)-6,9-difluoro-11-hydroksy-16,17–,(6α,11β,16α)-. Ma następującą strukturę chemiczną:
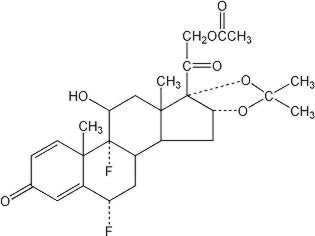
maść Lidex zawiera fluocynonid 0.5 mg / g w specjalnie opracowanej bazie maści składającej się z monostearynianu glicerylu, białej wazeliny, węglanu propylenu, glikolu propylenowego i białego wosku. Zapewnia okluzyjne i zmiękczające działanie pożądane w maści.
w tym składzie składnik aktywny jest całkowicie w roztworze.
Lidex – Farmakologia kliniczna
miejscowe kortykosteroidy mają działanie przeciwzapalne, przeciwświądowe i zwężające naczynia krwionośne.
mechanizm działania przeciwzapalnego miejscowych kortykosteroidów jest niejasny. Różne metody laboratoryjne, w tym testy zwężające naczynia krwionośne, są używane do porównywania i przewidywania mocy i / lub skuteczności klinicznej miejscowych kortykosteroidów. Istnieją pewne dowody sugerujące, że istnieje rozpoznawalna korelacja między siłą skurczu naczyń a skutecznością terapeutyczną u ludzi.
farmakokinetyka
stopień przezskórnego wchłaniania kortykosteroidów stosowanych miejscowo zależy od wielu czynników, w tym nośnika, integralności bariery naskórkowej i stosowania opatrunków okluzyjnych.
miejscowe kortykosteroidy mogą być wchłaniane z normalnej nienaruszonej skóry. Stan zapalny i / lub inne procesy chorobowe w skórze zwiększają wchłanianie przezskórne. Opatrunki okluzyjne znacznie zwiększają przezskórne wchłanianie miejscowych kortykosteroidów. Tak więc opatrunki okluzyjne mogą być cennym dodatkiem terapeutycznym w leczeniu opornych dermatoz (patrz dawkowanie i sposób podawania).
po wchłonięciu przez skórę, miejscowe kortykosteroidy są obsługiwane przez szlaki farmakokinetyczne podobne do kortykosteroidów podawanych systemowo. Kortykosteroidy wiążą się z białkami osocza w różnym stopniu. Kortykosteroidy są metabolizowane głównie w wątrobie, a następnie wydalane przez nerki. Niektóre miejscowe kortykosteroidy i ich metabolity są również wydalane do żółci.
wskazania i zastosowanie Lidexu
maść Lidex jest wskazana do łagodzenia objawów zapalnych i świądowych dermatoz reagujących na kortykosteroidy.
przeciwwskazania
miejscowe stosowanie kortykosteroidów jest przeciwwskazane u pacjentów z nadwrażliwością na którykolwiek ze składników preparatu w wywiadzie.
środki ostrożności
ogólne
ogólnoustrojowe wchłanianie kortykosteroidów do stosowania miejscowego powodowało odwracalne zahamowanie osi podwzgórze-przysadka-nadnercza (HPA), objawy zespołu Cushinga, hiperglikemię i glukozurię u niektórych pacjentów.
warunki, które zwiększają wchłanianie ogólnoustrojowe, obejmują stosowanie silniejszych steroidów, stosowanie na dużych powierzchniach, długotrwałe stosowanie i dodanie opatrunków okluzyjnych.
dlatego pacjenci otrzymujący dużą dawkę silnego miejscowego steroidu stosowanego na dużą powierzchnię lub pod opatrunkiem okluzyjnym powinni być okresowo oceniani pod kątem supresji osi HPA za pomocą testów stymulacji kortyzolu wolnego od moczu i ACTH. Jeśli zauważono tłumienie osi HPA, należy podjąć próbę wycofania leku, zmniejszenia częstotliwości stosowania lub zastąpienia słabszego steroidu.
odzyskanie funkcji osi HPA jest na ogół szybkie i kompletne po odstawieniu leku. Rzadko mogą wystąpić objawy podmiotowe i przedmiotowe odstawienia steroidów, wymagające uzupełnienia kortykosteroidów o działaniu ogólnoustrojowym.
dzieci mogą wchłaniać proporcjonalnie większe ilości kortykosteroidów stosowanych miejscowo i tym samym być bardziej podatne na toksyczność ogólnoustrojową (patrz środki ostrożności-stosowanie u dzieci). W przypadku wystąpienia podrażnienia należy przerwać stosowanie kortykosteroidów do stosowania miejscowego i zastosować odpowiednie leczenie.
podobnie jak w przypadku innych miejscowych kortykosteroidów, długotrwałe stosowanie może spowodować zanik skóry i tkanek podskórnych. W przypadku stosowania na obszarach międzykręgowych lub zginaczy lub na twarzy, może to wystąpić nawet przy krótkotrwałym stosowaniu.
w przypadku zakażeń dermatologicznych należy zastosować odpowiedni środek przeciwgrzybiczy lub Przeciwbakteryjny. Jeśli korzystna odpowiedź nie wystąpi szybko, należy przerwać stosowanie kortykosteroidów do czasu uzyskania odpowiedniej kontroli zakażenia.
informacje dla pacjenta
pacjenci stosujący miejscowo kortykosteroidy powinni otrzymać następujące informacje i instrukcje:
- ten lek należy stosować zgodnie z zaleceniami lekarza. Jest przeznaczony wyłącznie do użytku zewnętrznego. Unikać kontaktu z oczami.
- pacjentom należy zalecić, aby nie stosowali tego leku w żadnych innych zaburzeniach niż te, na które został przepisany.
- leczonego obszaru skóry nie należy zabandażować ani w inny sposób zakrywać ani owijać tak, aby był okluzyjny, chyba że zaleci to lekarz.
- pacjenci powinni zgłaszać wszelkie objawy miejscowych działań niepożądanych, zwłaszcza pod opatrunkiem okluzyjnym.
- rodzicom dzieci należy zalecić, aby nie używali obcisłych pieluszek ani plastikowych spodni na dziecku leczonym w obszarze pieluchy, ponieważ odzież ta może stanowić opatrunek okluzyjny.
badania laboratoryjne
poniższe badania mogą być pomocne w ocenie tłumienia osi HPA:
Test kortyzolu bez moczu
test stymulacji ACTH
Karcynogeneza, mutageneza i zaburzenia płodności
nie przeprowadzono długoterminowych badań na zwierzętach w celu oceny potencjalnego działania rakotwórczego lub wpływu miejscowych kortykosteroidów na płodność.
badania mające na celu określenie mutagenności prednizolonu i hydrokortyzonu wykazały negatywne wyniki.
ciąża Kategoria C
kortykosteroidy są na ogół teratogenne u zwierząt laboratoryjnych, gdy są podawane układowo przy stosunkowo małych dawkach. Wykazano, że silniejsze kortykosteroidy mają działanie teratogenne po zastosowaniu przez skórę u zwierząt laboratoryjnych. Nie przeprowadzono odpowiednich i dobrze kontrolowanych badań dotyczących działania teratogennego kortykosteroidów stosowanych miejscowo u kobiet w ciąży. Dlatego też miejscowe stosowanie kortykosteroidów powinno być stosowane w okresie ciąży tylko wtedy, gdy potencjalne korzyści przewyższają potencjalne ryzyko dla płodu. Leki z tej klasy nie powinny być szeroko stosowane u kobiet w ciąży, w dużych ilościach lub przez dłuższy czas.
matki karmiące
nie wiadomo, czy miejscowe podawanie kortykosteroidów może spowodować wchłanianie ogólnoustrojowe wystarczające do wytworzenia wykrywalnych ilości w mleku matki. Kortykosteroidy podawane systemowo są wydzielane do mleka matki w ilościach, które nie mogą mieć szkodliwego wpływu na niemowlę. Niemniej jednak, należy zachować ostrożność podczas miejscowego podawania kortykosteroidów kobietom karmiącym piersią.
stosowanie u dzieci
pacjenci pediatryczni mogą wykazywać większą wrażliwość na miejscowo indukowaną kortykosteroidami supresję osi podwzgórze-przysadka-nadnercza (HPA) I Zespół Cushinga niż pacjenci Dojrzali z powodu większego stosunku powierzchni skóry do masy ciała.
u dzieci otrzymujących miejscowo kortykosteroidy donoszono o supresji osi HPA, zespole Cushinga i nadciśnieniu śródczaszkowym. Objawy supresji nadnerczy u dzieci obejmują liniowe opóźnienie wzrostu, opóźniony przyrost masy ciała, niski poziom kortyzolu w osoczu i brak odpowiedzi na stymulację ACTH. Objawy nadciśnienia śródczaszkowego obejmują wybrzuszenie ciemiączek, bóle głowy i obustronne brodawczaka.
miejscowe podawanie kortykosteroidów dzieciom powinno być ograniczone do najmniejszej ilości zgodnej ze skutecznym schematem terapeutycznym. Przewlekłe leczenie kortykosteroidami może wpływać na wzrost i rozwój dzieci.
działania niepożądane
następujące miejscowe działania niepożądane są zgłaszane rzadko w przypadku miejscowych kortykosteroidów, ale mogą występować częściej w przypadku stosowania opatrunków okluzyjnych. Reakcje te są wymienione w przybliżonym malejącym porządku występowania:
| Burning | Perioral dermatitis |
| Itching | Allergic contact dermatitis |
| Irritation | Maceration of the skin |
| Dryness | Secondary infection |
| Folliculitis | Skin atrophy |
| Hypertrichosis | Striae |
| Acneiform eruptions | Miliaria |
| Hypopigmentation |
Overdosage
Topically applied corticosteroids can be absorbed in sufficient amounts to produce systemic effects (see PRECAUTIONS).
LIDEX Dawkowanie i sposób podawania
maść Lidex jest zwykle nakładana na obszar dotknięty chorobą w postaci cienkiej warstwy od dwóch do czterech razy na dobę, w zależności od ciężkości choroby.
opatrunki okluzyjne mogą być stosowane w leczeniu łuszczycy lub chorób opornych.
W przypadku wystąpienia zakażenia należy przerwać stosowanie opatrunków okluzyjnych i wdrożyć odpowiednie leczenie przeciwdrobnoustrojowe.
jak jest dostarczany Lidex
LIDEX® (fluocinonide) maść 0.05% jest dostarczany w
rurce 15 g –NDC 99207-514-13
rurce 30 g –NDC 99207-514-14
rurce 60 g –NDC 99207-514-17
rurce 120 g –NDC 99207-514-22
Przechowywać w temperaturze pokojowej. Unikać temperatury powyżej 30 ° C (86°F).
patent USA nr 4,017,615
wyprodukowany dla:
MEDICIS, The Dermatology Company®
Scottsdale, AZ 85258
przez: Patheon, Inc.
Mississauga, Ontario
Canada L5N 7K9
IN-5070/S
| Lidex fluocinonide ointment |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Labeler – MEDICIS
Frequently asked questions
- Is it used for hair loss?
- What is a substitute for fluocinonide cream?
- Is fluocinonide an antifungal cream?
- How long should you use fluocinonide for?
- What is fluocinonide cream good for?
- czy fluocynonid można stosować w leczeniu wysypki z trującego bluszczu?
- czy to steryd?
- czy to antybiotyk?
więcej o Lidex (Fluocinonide miejscowe)
- skutki uboczne
- podczas ciąży lub karmienia piersią
- Informacje o dawkowaniu
- interakcje leków
- 8 opinii
- dostępność generyczna
- klasa leków: sterydy miejscowe
zasoby konsumenckie
- zaawansowane Czytanie
- LIDEX Mild (zaawansowane Czytanie)
- LIDEX Regular (zaawansowane Czytanie)
profesjonalne zasoby
- informacje o przepisywaniu
- LIDEX Topical Solution (FDA)
- LIDEX Gel (FDA)
inne marki Vanos, LIDEX-e
poradniki leczenia
- atopowe zapalenie skóry
- wyprysk
- zapalenie skóry
- łuszczyca
oświadczenie lekarskie