cele nauki
pod koniec tej sekcji będziesz mógł:
- zbadać transfer ciepła.
- Oblicz temperaturę końcową na podstawie wymiany ciepła.
do tej pory omawialiśmy zmiany temperatury spowodowane transferem ciepła. Nie następuje zmiana temperatury z wymiany ciepła, jeśli lód topi się i staje się ciekłą wodą (tj. podczas zmiany fazy). Na przykład rozważ kapiącą wodę z sopli topniejących na dachu rozgrzanym przez słońce. Odwrotnie, woda zamarza w tacy Lodowej chłodzonej przez otoczenie o niższej temperaturze.

Rysunek 1. Ciepło z powietrza przenosi się do lodu, powodując jego stopienie. (kredyt: Mike Brand)
energia jest wymagana do stopienia ciała stałego, ponieważ spoiste wiązania między cząsteczkami w ciele stałym muszą być rozbite tak, że w cieczy cząsteczki mogą poruszać się przy porównywalnych energiach kinetycznych; tak więc nie ma wzrostu temperatury. Podobnie, energia jest potrzebna do odparowania cieczy, ponieważ cząsteczki w cieczy oddziałują ze sobą poprzez siły atrakcyjne. Nie ma zmiany temperatury, dopóki zmiana fazy nie zostanie zakończona. Temperatura filiżanki sody początkowo w 0ºC pozostaje w 0ºC, aż cały lód stopi się. Odwrotnie, energia jest uwalniana podczas zamrażania i kondensacji, zwykle w postaci energii cieplnej. Praca jest wykonywana przez siły kohezyjne, gdy cząsteczki są połączone. Odpowiednia energia musi Zostać oddana (rozproszona), aby mogły pozostać razem Rysunek 2.
energia związana ze zmianą fazy zależy od dwóch głównych czynników: liczby i siły wiązań lub par sił. Liczba wiązań jest proporcjonalna do liczby cząsteczek, a tym samym do masy próbki. Siła sił zależy od rodzaju cząsteczek. Ciepło Q wymagane do zmiany fazy próbki o masie M jest podane przez
Q = mLf (topienie / zamrażanie,
Q = mLv (waporyzacja/kondensacja),
gdzie utajone ciepło fuzji, Lf i utajone ciepło parowania, Lv, są stałymi materiałowymi, które są określone eksperymentalnie. Zob. Tabela 1.

Rysunek 2. (a) energia jest wymagana do częściowego przezwyciężenia sił atrakcyjnych między cząsteczkami w ciele stałym, aby utworzyć ciecz. Ta sama energia musi zostać usunięta, aby doszło do zamrożenia. (b) cząsteczki są oddzielone dużymi odległościami podczas przechodzenia od cieczy do pary, wymagając znacznej energii do przezwyciężenia przyciągania molekularnego. Ta sama energia musi zostać usunięta, aby doszło do kondensacji. Nie ma zmiany temperatury, dopóki zmiana fazy nie zostanie zakończona.
ciepło utajone mierzy się w jednostkach J/kg. Zarówno Lf, jak i Lv zależą od substancji, w szczególności od siły jej sił molekularnych, jak wspomniano wcześniej. Lf i Lv są łącznie nazywane utajonymi współczynnikami ciepła. Są one utajone lub ukryte, ponieważ podczas zmian fazowych energia wchodzi lub opuszcza system bez powodowania zmiany temperatury w systemie; tak więc, w efekcie, energia jest ukryta. Tabela 1 zawiera reprezentatywne wartości Lf i Lv wraz z punktami topnienia i wrzenia.
tabela pokazuje, że znaczne ilości energii biorą udział w zmianach fazowych. Przyjrzyjmy się na przykład, ile energii jest potrzebne do stopienia kilograma lodu w temperaturze 0ºC, aby wyprodukować kilogram wody w temperaturze 0°C. używając równania dla zmiany temperatury i wartości dla wody z tabeli 1, stwierdzamy, że Q = mLf = (1.0 kg) (334 kJ/kg) = 334 kJ to energia do stopienia kilograma lodu. Jest to dużo energii, ponieważ stanowi taką samą ilość energii potrzebną do podniesienia temperatury 1 kg ciekłej wody z 0ºC do 79,8 ºC. Jeszcze więcej energii jest potrzebne do odparowania wody; potrzeba 2256 kJ, aby zmienić 1 kg ciekłej wody w normalnej temperaturze wrzenia (100ºC przy ciśnieniu atmosferycznym) na parę (parę wodną). Ten przykład pokazuje, że energia dla zmiany fazy jest ogromna w porównaniu do energii związanej ze zmianami temperatury bez zmiany fazy.
| Table 1. Heats of Fusion and Vaporization | ||||||
|---|---|---|---|---|---|---|
| Lf | Lv | |||||
| Substance | Melting point (ºC) | kJ/kg | kcal/kg | Boiling point (°C) | kJ/kg | kcal/kg |
| Helium | −269.7 | 5.23 | 1.25 | −268.9 | 20.9 | 4.99 |
| Hydrogen | −259.3 | 58.6 | 14.0 | −252.9 | 452 | 108 |
| Nitrogen | −210.0 | 25.5 | 6.09 | −195.8 | 201 | 48.0 |
| Oxygen | −218.8 | 13.8 | 3.30 | −183.0 | 213 | 50.9 |
| Ethanol | −114 | 104 | 24.9 | 78.3 | 854 | 204 |
| Ammonia | −75 | 108 | −33.4 | 1370 | 327 | |
| Mercury | −38.9 | 11.8 | 2.82 | 357 | 272 | 65.0 |
| Water | 0.00 | 334 | 79.8 | 100.0 | 2256 | 539 |
| Sulfur | 119 | 38.1 | 9.10 | 444.6 | 326 | 77.9 |
| Lead | 327 | 24.5 | 5.85 | 1750 | 871 | 208 |
| Antimony | 631 | 165 | 39.4 | 1440 | 561 | 134 |
| Aluminum | 660 | 380 | 90 | 2450 | 11400 | 2720 |
| Silver | 961 | 88.3 | 21.1 | 2193 | 2336 | 558 |
| Gold | 1063 | 64.5 | 15.4 | 2660 | 1578 | 377 |
| Copper | 1083 | 134 | 32.0 | 2595 | 5069 | 1211 |
| Uranium | 1133 | 84 | 20 | 3900 | 1900 | 454 |
| Tungsten | 3410 | 184 | 44 | 5900 | 4810 | 1150 |
Phase changes can have a tremendous stabilizing effect even on temperatures that are not near the melting and boiling points, because evaporation and condensation (conversion of a gas into a liquid state) occur even at temperatures below the boiling point. Weźmy na przykład fakt, że Temperatura powietrza w wilgotnym klimacie rzadko przekracza 35,0 ºC, co wynika z faktu, że większość ciepła przechodzi do odparowującej wody do powietrza. Podobnie, temperatury w wilgotnej pogodzie rzadko spadają poniżej punktu rosy, ponieważ ogromne ciepło jest uwalniane podczas kondensacji pary wodnej.
badamy skutki zmiany fazy dokładniej, rozważając dodanie ciepła do próbki lodu w temperaturze −20ºC (ryc. 3). Temperatura lodu wzrasta liniowo, pochłaniając ciepło ze stałą szybkością 0,50 cala / g⋅ºC, aż osiągnie 0ºC. Po osiągnięciu tej temperatury lód zaczyna się topić, aż cały lód się stopi, pochłaniając 79,8 cal/g ciepła. Podczas tej zmiany fazy temperatura pozostaje stała na poziomie 0ºC. Gdy lód stopi się, Temperatura ciekłej wody wzrasta, pochłaniając ciepło z nową stałą szybkością 1,00 cal/G º ºC. W temperaturze 100ºC woda zaczyna wrzeć, a temperatura ponownie pozostaje stała, podczas gdy woda pochłania 539 cal/G ciepła podczas tej zmiany fazy. Gdy cała ciecz stanie się parą, Temperatura ponownie wzrośnie, pochłaniając ciepło z szybkością 0,482 cal/G º ºC.
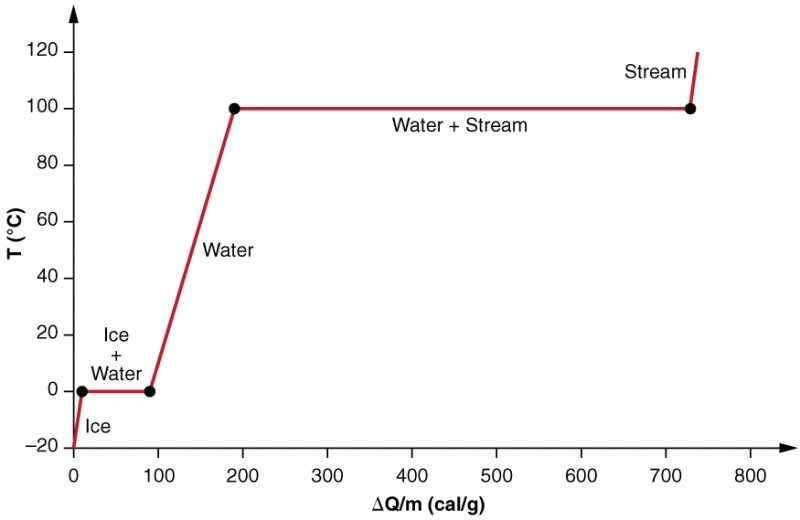
Rysunek 3. Dodano wykres temperatury w stosunku do energii. System jest skonstruowany tak, że żadna para nie odparowuje, podczas gdy lód rozgrzewa się, aby stać się ciekłą wodą, i tak, że gdy zachodzi parowanie, para pozostaje w systemie. Długie odcinki stałych wartości temperatury w 0ºC i 100ºC odzwierciedlają odpowiednio duże utajone ciepło topnienia i parowania.
woda może odparować w temperaturze poniżej temperatury wrzenia. Potrzeba więcej energii niż w temperaturze wrzenia, ponieważ energia kinetyczna cząsteczek wody w temperaturach poniżej 100ºC jest mniejsza niż w temperaturze 100ºC, stąd mniej energii jest dostępne z przypadkowych ruchów termicznych. Weźmy na przykład fakt, że w temperaturze ciała pot ze skóry wymaga ciepła o wartości 2428 kJ/kg, co jest o około 10 procent wyższe niż utajone ciepło parowania w temperaturze 100ºC. Ciepło to pochodzi ze skóry, a tym samym zapewnia skuteczny mechanizm chłodzenia w upalne dni. Wysoka wilgotność hamuje parowanie, dzięki czemu temperatura ciała może wzrosnąć, pozostawiając nierównomierny pot na czole.
przykład 1. Oblicz temperaturę końcową ze zmiany fazy: chłodzenie sody kostkami lodu
trzy kostki lodu służą do chłodzenia sody w temperaturze 20ºC o masie msoda = 0,25 kg. Lód jest w temperaturze 0ºC, a każda kostka lodu ma masę 6,0 g. Załóżmy, że soda jest przechowywana w pojemniku z pianką, dzięki czemu straty ciepła mogą być ignorowane. Załóżmy, że soda ma taką samą pojemność cieplną jak woda. Znajdź ostateczną temperaturę, gdy cały lód się stopi.
kostki lodu mają temperaturę topnienia 0ºC. Ciepło jest przenoszone z sody do lodu w celu topienia. Topnienie lodu następuje w dwóch etapach: najpierw następuje zmiana fazy i w temperaturze topnienia ciało stałe (lód) przekształca się w ciekłą wodę, a następnie Temperatura tej wody wzrasta. Topnienie daje wodę o temperaturze 0ºC, więc więcej ciepła jest przenoszone z sody do tej wody, aż system water plus soda osiągnie równowagę termiczną, Qice = − Qsoda.
ciepło przekazywane do lodu wynosi
Qice
Qice
+ „micecW” (Tf−0ºC).
ciepło wydzielane przez sodę to Qsoda = msodacW(tf−20ºC). Ponieważ ciepło nie jest tracone, Qice = – Qsoda, tak że
myszy Lf + micecW(tf−0ºC) = –msodacW(TF−20ºC).
wszystkie terminy dotyczące Tf po lewej stronie i wszystkie inne terminy po prawej stronie. Rozwiąż nieznaną ilość Tf:
\displaystyle{T}_{\text{f}}=\frac{m_{\text{soda}}c_{\text{W}}\left(20^{\circ}\text{C}\right)-m_{\text{ice}}L_{\text{f}}}{\left(m_{\text{soda}}+m_{\text{ice}}\right)c_{\text{W}}}\\
rozwiązanie
- Masa lodu to 3 × 6,0 g = 0,018 kg, a masa sody to msoda = 0,25 kg.
- Oblicz wyrazy w liczniku: m sodacW(20ºC)=(0,25 kg)(4186 J/kg ⋅ ºC)(20ºC) = 20,930 J i miceLf = (0,018 kg)(334,000 J/kg) = 6012 J.
- Oblicz mianownik: (msoda + myszy)cW = (0,25 kg + 0.018 kg) (4186 K/(kg⋅ºC) = 1122 J/ºC.
- Oblicz temperaturę końcową: \displaystyle{t} _ {\text{f}}=\frac{20,930\text{ J}-6012\text{ J}}{1122\text{ J/}^{\circ}\text{C}}=13^{\circ}\text{C}\\
dyskusja
Ten przykład ilustruje ogromne Energie zaangażowane podczas zmiany fazy. Masa lodu wynosi około 7 procent masy wody, ale prowadzi do zauważalnej zmiany temperatury sody. Chociaż założyliśmy, że lód był w temperaturze zamarzania, jest to nieprawidłowe: typowa temperatura wynosi −6ºC. Jednak ta korekta daje ostateczną temperaturę, która jest zasadniczo identyczna z wynikiem, który znaleźliśmy. Możesz wyjaśnić dlaczego?

Rysunek 4. Kondensacja na szklance mrożonej herbaty. (kredyt: Jenny Downing)
widzieliśmy, że parowanie wymaga transferu ciepła do cieczy z otoczenia, tak że energia jest uwalniana przez otoczenie. Kondensacja jest procesem odwrotnym, zwiększającym temperaturę otoczenia. Wzrost ten może wydawać się zaskakujący, ponieważ kondensację kojarzymy z zimnymi przedmiotami-na przykład szkłem na rysunku. Jednak energia musi zostać usunięta z cząsteczek kondensujących, aby uzyskać kondensację pary. Energia jest dokładnie taka sama jak wymagana do zmiany fazy w innym kierunku, z cieczy do pary, a więc można ją obliczyć z Q = mLv .
kondensacja tworzy się na fig.4, ponieważ temperatura pobliskiego powietrza jest obniżona poniżej punktu rosy. Powietrze nie może pomieścić tyle wody, ile miało to miejsce w temperaturze pokojowej, więc woda skrapla się. Energia jest uwalniana, gdy woda skrapla się, przyspieszając topnienie lodu w szkle.
zastosowanie w świecie rzeczywistym
energia jest również uwalniana, gdy ciecz zamarza. Zjawisko to jest wykorzystywane przez sadowników na Florydzie do ochrony pomarańczy, gdy temperatura jest zbliżona do punktu zamarzania (0ºC). Hodowcy spryskują rośliny wodą w sadach, aby woda zamarzała i ciepło uwalniało się do rosnących pomarańczy na drzewach. Zapobiega to spadkowi temperatury wewnątrz pomarańczy poniżej zera, co uszkodziłoby owoce.

rysunek 14.11. Lód na tych drzewach uwalniał duże ilości energii, gdy zamarzał, pomagając zapobiec spadkowi temperatury drzew poniżej 0ºC. Woda jest celowo spryskiwana na sady, aby zapobiec silnym mrozom. (kredyt: Hermann Hammer)
Sublimacja jest przejście od fazy stałej do fazy parowej. Być może zauważyłeś, że śnieg może zniknąć w powietrzu bez śladu ciekłej wody lub zniknięcia kostek lodu w zamrażarce. Odwrotna jest również prawda: mróz może tworzyć się na bardzo zimnych oknach bez przechodzenia przez fazę ciekłą. Popularnym efektem jest wytwarzanie „dymu” z suchego lodu, który jest stałym dwutlenkiem węgla. Sublimacja występuje, ponieważ równowagowe ciśnienie pary ciał stałych nie jest zerowe. Niektóre odświeżacze powietrza wykorzystują sublimację substancji stałej do wstrzykiwania perfum do pomieszczenia. Kulki ćmy są lekko toksycznym przykładem fenolu (związku organicznego), który sublimuje, podczas gdy niektóre ciała stałe, takie jak tetroksyd osmu, są tak toksyczne, że muszą być przechowywane w zamkniętych pojemnikach, aby zapobiec ekspozycji ludzi na ich opary wytwarzane przez sublimację.

Rysunek 5. Bezpośrednie przejścia między ciałem stałym a oparami są powszechne, czasami użyteczne, a nawet piękne. a) suchy lód sublimuje bezpośrednio do dwutlenku węgla. Widoczna para zbudowana jest z kropelek wody. (kredyt: Windell Oskay) (b) mróz tworzy wzory na bardzo zimnym oknie, przykład bryły uformowanej bezpośrednio z pary. (kredyt: Liz West)
wszystkie przejścia fazowe obejmują ciepło. W przypadku bezpośrednich przejść ciało stałe-para, wymaganą energię daje równanie Q = mLs, gdzie Ls jest ciepłem sublimacji, czyli energią potrzebną do zmiany 1.00 kg substancji z fazy stałej do fazy parowej. Ls jest analogiczne do Lf i Lv, a jego wartość zależy od substancji. Sublimacja wymaga nakładu energii, tak że suchy lód jest skutecznym chłodziwem, podczas gdy proces odwrotny (tj. lukier) uwalnia energię. Ilość energii potrzebnej do sublimacji jest tego samego rzędu wielkości, co w przypadku innych przejść fazowych.
materiał przedstawiony w tej sekcji i poprzedniej sekcji pozwala nam obliczyć dowolną liczbę efektów związanych ze zmianą temperatury i fazy. W każdym przypadku konieczne jest określenie, które zmiany temperatury i fazy zachodzą, a następnie zastosowanie odpowiedniego równania. Należy pamiętać, że wymiana ciepła i praca mogą powodować zarówno zmiany temperatury, jak i fazy.
strategie rozwiązywania problemów w zakresie efektów wymiany ciepła
- Czy jest transfer ciepła do lub z systemu? Gdy obecność lub brak zmiany fazy nie jest oczywisty, możesz najpierw rozwiązać problem tak, jakby nie było zmian fazowych i zbadać uzyskaną zmianę temperatury. Jeśli wystarczy przejść przez temperaturę wrzenia lub topnienia, powinieneś wrócić i rozwiązać problem etapami-zmianą temperatury, zmianą fazy, późniejszą zmianą temperatury i tak dalej.
- identyfikuje i wypisuje wszystkie obiekty, które zmieniają temperaturę i fazę.
- Zidentyfikuj dokładnie to, co należy określić w problemie (zidentyfikuj niewiadome). Lista pisemna jest przydatna.
- Zrób listę tego, co jest podane lub co można wywnioskować z problemu, jak stwierdzono (zidentyfikuj znane).
- Rozwiąż odpowiednie równanie dla ilości, która ma być określona (nieznana). Jeżeli zachodzi zmiana temperatury, przenoszone ciepło zależy od ciepła właściwego (patrz Tabela 1 w zakresie zmiany temperatury i pojemności cieplnej), natomiast w przypadku zmiany fazy, przenoszone ciepło zależy od ciepła utajonego. Zob. Tabela 1.
- Zastąp znamiona wraz z ich jednostkami do odpowiedniego równania i uzyskaj rozwiązania numeryczne wraz z jednostkami. Jeśli proces składa się z więcej niż jednego etapu (np. zmiana temperatury, po której następuje zmiana fazy), należy to zrobić etapami.
- Sprawdź odpowiedź, czy jest sensowna: czy ma sens? Na przykład upewnij się, że zmiana temperatury nie powoduje również zmiany fazy, której nie wzięto pod uwagę.
Sprawdź swoje zrozumienie
Dlaczego śnieg pozostaje na stokach górskich nawet wtedy, gdy temperatura w ciągu dnia jest wyższa niż temperatura zamarzania?
roztwór
śnieg powstaje z kryształków lodu i tym samym jest fazą stałą wody. Ponieważ ogromne ciepło jest niezbędne do zmian fazowych, nagromadzenie tego ciepła z powietrza zajmuje pewną ilość czasu, nawet jeśli powietrze jest powyżej 0ºC. Im cieplejsze jest powietrze, tym szybciej następuje wymiana ciepła i tym szybciej topi się śnieg.
podsumowanie sekcji
- większość substancji może istnieć w postaci stałej, ciekłej i gazowej, które są określane jako „fazy.”
- zmiany fazowe zachodzą w ustalonych temperaturach dla danej substancji pod danym ciśnieniem, a temperatury te nazywane są punktami wrzenia i zamarzania (lub topnienia).
- podczas zmian fazowych ciepło absorbowane lub uwalniane jest przez: Q = mL, gdzie L jest współczynnikiem ciepła utajonego.
pytania koncepcyjne
- wymiana ciepła może powodować zmiany temperatury i fazy. Co jeszcze może spowodować te zmiany?
- w jaki sposób utajone ciepło fuzji wody pomaga spowolnić spadek temperatury powietrza, być może zapobiegając spadkowi temperatury znacznie poniżej ºC w pobliżu dużych zbiorników wodnych?
- jaka jest temperatura lodu zaraz po jego utworzeniu przez zamarzającą wodę?
- Jeśli umieścisz ºC lodu w ºC wody w izolowanym pojemniku, co się stanie? Czy trochę lodu się stopi, czy więcej wody zamarznie, czy nie będzie miało to miejsca?
- jaki wpływ na szybkość topnienia lodu ma kondensacja na szklance wody lodowej? Czy kondensacja przyspieszy proces topienia, czy spowolni?
- w bardzo wilgotnym klimacie, gdzie jest wiele zbiorników wodnych, takich jak Floryda, jest niezwykłe, że temperatury rosną powyżej około 35ºC (95ºF). Na pustyniach temperatury mogą jednak znacznie wzrosnąć. Wyjaśnij, w jaki sposób parowanie wody pomaga ograniczyć wysokie temperatury w wilgotnym klimacie.
- zimą w San Francisco jest często cieplej niż w pobliskim Sacramento, 150 km w głąb lądu. Latem w Sacramento jest prawie zawsze cieplej. Wyjaśnij, jak wody otaczające San Francisco łagodzą jego ekstremalne temperatury.
- umieszczenie pokrywki na garnku znacznie zmniejsza przenoszenie ciepła niezbędne do utrzymania wrzenia. Wyjaśnij dlaczego.
- żywność liofilizowana została odwodniona w próżni. Podczas procesu żywność zamarza i musi być podgrzewana, aby ułatwić odwodnienie. Wyjaśnij zarówno, w jaki sposób próżnia przyspiesza odwodnienie, jak i dlaczego żywność zamarza w wyniku.
- gdy wciąż powietrze ochładza się promieniując w nocy, jest niezwykłe, że temperatury spadają poniżej punktu rosy. Wyjaśnij dlaczego.
- podczas pokazu w klasie fizyki instruktor napompowuje balon ustami, a następnie chłodzi go ciekłym azotem. Kiedy jest zimno, skurczony balon ma w sobie niewielką ilość jasnoniebieskiego płynu, a także kryształki podobne do śniegu. Gdy się rozgrzewa, ciecz wrze, a część kryształów sublimuje, a niektóre kryształy utrzymują się przez jakiś czas, a następnie wytwarzają ciecz. Zidentyfikuj niebieską ciecz i dwie ciała stałe w zimnym balonie. Uzasadnij swoją identyfikację za pomocą danych z tabeli 1.
problemy& ćwiczenia
- ile ciepła (w kilokaloriach) jest wymagane do rozmrożenia 0,450-kg paczki mrożonych warzyw pierwotnie w temperaturze 0ºC, jeśli ciepło ich fuzji jest takie samo jak wody?
- worek zawierający 0ºC lodu jest o wiele bardziej efektywny w pochłanianiu energii niż worek zawierający taką samą ilość 0ºC wody. (a) ile wymiany ciepła jest konieczne, aby podnieść temperaturę 0,800 kg wody z 0ºC do 30,0 ºC? (b)ile wymiany ciepła jest wymagane do pierwszego stopienia 0.800 kg lodu 0ºC, a następnie podnieść jego temperaturę? (c) wyjaśnij, w jaki sposób Twoja odpowiedź wspiera twierdzenie, że lód jest bardziej skuteczny.
- (a) ile wymiany ciepła jest wymagane, aby podnieść temperaturę aluminiowego garnka o masie 0,750 kg zawierającego 2,50 kg wody z 30,0 ºC do temperatury wrzenia, a następnie zagotować 0,750 kg wody? (b) jak długo to trwa, jeśli szybkość wymiany ciepła wynosi 500 W 1 Wat = 1 dżul / sekundę (1 W = 1 J/s)?
- powstawanie kondensacji na szklance wody lodowej powoduje, że lód topi się szybciej niż w przeciwnym razie. Jeśli 8.00 g kondensacji tworzy się na szklance zawierającej zarówno wodę, jak i 200 g lodu, ile gramów lodu stopi się w wyniku? Załóżmy, że nie ma innego transferu ciepła.
- podczas podróży zauważasz, że worek lodu o wadze 3,50 kg wytrzymuje średnio jeden dzień w Twojej chłodni. Jaka jest średnia moc w watach wchodzących do lodu, jeśli zaczyna się od 0ºC i całkowicie topi się do 0ºC wody w dokładnie jeden dzień 1 Wat = 1 dżul / sekundę (1 W = 1 J/s)?
- w pewien suchy słoneczny dzień temperatura w basenie wzrośnie o 1,50 ºC, gdyby nie parowanie. Jaka frakcja wody musi wyparować, aby zabrać wystarczająco dużo energii, aby utrzymać stałą temperaturę?
- (a) ile wymiany ciepła jest konieczne, aby podnieść temperaturę 0,200 kg kawałka lodu z -20,0 ºC do 130ºC, w tym energię potrzebną do zmian fazowych? (b) ile czasu jest wymagane dla każdego etapu, przy założeniu stałej szybkości wymiany ciepła 20,0 kJ/s? (c) zrobić wykres temperatury w stosunku do czasu dla tego procesu.
- w 1986 roku z szelfu Lodowego Rossa na Antarktydzie oderwała się olbrzymia góra lodowa. Miał kształt prostokąta o długości 160 km, 40.0 km szerokości i 250 m grubości. (a) jaka jest masa tej góry lodowej, biorąc pod uwagę, że gęstość lodu wynosi 917 kg/m3? (b) ile wymiany ciepła (w dżulach) jest potrzebne do stopienia go? (C) ile lat zajmie samo światło słoneczne stopienie tak grubego lodu, jeśli lód pochłania średnio 100 W / m2, 12,00 h dziennie?
- ile gramów kawy musi wyparować z 350 g kawy w szklanym kubku o pojemności 100 g, aby schłodzić kawę od 95,0 ºC do 45,0 ºC? Można założyć, że kawa ma takie same właściwości termiczne jak woda i że średnie ciepło parowania wynosi 2340 kJ / kg (560 cal / g). (Możesz zaniedbać zmianę masy kawy, gdy się ochładza, co da ci odpowiedź, która jest nieco większa niż poprawna.)
- (a) trudno jest ugasić pożar na zbiornikowcu ropy naftowej, ponieważ każdy litr ropy naftowej uwalnia 2,80 × 107 J energii podczas spalania. Aby zilustrować tę trudność, oblicz liczbę litrów wody, które muszą zostać zużyte, aby pochłonąć energię uwalnianą przez spalanie 1,00 L ropy naftowej, jeśli woda ma podniesioną temperaturę z 20,0 ºC do 100ºC, gotuje się, a otrzymana para zostaje podniesiona do 300ºC. B) omów dodatkowe komplikacje spowodowane faktem, że ropa naftowa ma mniejszą gęstość niż woda.
- energia uwalniana z kondensacji podczas burz może być bardzo duża. Oblicz energię uwalnianą do atmosfery dla małej burzy o promieniu 1 km, zakładając, że 1,0 cm deszczu jest wytrącony równomiernie nad tym obszarem.
- aby zapobiec uszkodzeniu przez mróz, na drzewo owocowe rozpyla się 4,00 kg wody o temperaturze 0ºC. (a) ile wymiany ciepła następuje, gdy woda zamarza? (B) o ile zmniejszyłaby się temperatura 200-kg drzewa gdyby owa ilość ciepła przenoszonego z drzewa? Przyjmij ciepło właściwe na 3,35 kJ · kg * ºC i załóżmy, że nie następuje zmiana fazy.
- aluminiową miskę o wadze 0,250 kg, mieszczącą 0,800 kg zupy w temperaturze 25,0 ºC umieszcza się w zamrażarce. Jaka jest końcowa temperatura, jeśli 377 kJ energii jest przenoszone z miski i zupy, zakładając, że właściwości termiczne zupy są takie same jak właściwości wody?
- kostkę lodu o masie 0,0500 kg w temperaturze -30,0 ºC umieszcza się w 0,400 kg wody o temperaturze 35,0 ºC w bardzo dobrze izolowanym pojemniku. Jaka jest ostateczna temperatura?
- jeśli wylejesz 0,0100 kg wody 20,0 ºC na 1,20 kg bloku lodu (który początkowo ma temperaturę -15,0 ºC), jaka będzie ostateczna temperatura? Można założyć, że woda stygnie tak szybko, że Efekty otoczenia są znikome.
- tubylcy czasami gotują w wodoszczelnych koszach, umieszczając gorące skały w wodzie, aby doprowadzić ją do wrzenia. Jaką masę skały o temperaturze 500ºc należy umieścić w 4,00 kg wody o temperaturze 15,0 ºC, aby doprowadzić jej temperaturę do 100ºC, jeśli 0,0250 kg wody ucieknie jako para z początkowego skwierczenia? Możesz zaniedbywać wpływ otoczenia i wziąć średnie ciepło właściwe skał za granit.
- jaka byłaby końcowa temperatura patelni i wody przy obliczaniu końcowej temperatury, gdy ciepło jest przenoszone między dwoma ciałami: wlewanie zimnej wody do gorącej patelni, jeśli 0,260 kg wody zostało umieszczone w patelni, a 0,0100 kg wody wyparowało natychmiast, pozostawiając pozostałą część do osiągnięcia wspólnej temperatury z patelnią?
- w niektórych krajach ciekły azot jest stosowany w ciężarówkach mleczarskich zamiast mechanicznych lodówek. A 3.00-godzinna dostawa wymaga 200 L ciekłego azotu o gęstości 808 kg / m3. (a) obliczyć transfer ciepła niezbędny do odparowania tej ilości ciekłego azotu i podniesienia jego temperatury do 3,00 ºC. (Użyj cp i załóżmy, że jest stała w zakresie temperatur.) Wartość ta jest ilością chłodzenia dopływu ciekłego azotu. (b) jaka jest ta szybkość transferu ciepła w kilowatogodzinach? C) porównać ilość chłodzenia uzyskaną w wyniku topienia identycznej masy lodu o temperaturze 0ºC z ilością powstałą w wyniku odparowania ciekłego azotu.
- niektórzy miłośnicy broni robią własne kule, co polega na topieniu i rzucaniu ołowianych kul. Ile ciepła potrzeba, aby podnieść temperaturę i stopić 0,500 kg ołowiu, zaczynając od 25,0 ºC?
Słowniczek
ciepło sublimacji: energia potrzebna do zmiany substancji z fazy stałej na fazę parową
utajony współczynnik ciepła: stała fizyczna równa ilości ciepła przekazywanego na każde 1 kg substancji podczas zmiany fazy substancji
sublimacja: przejście z fazy stałej do fazy parowej
wybrane rozwiązania problemów & ćwiczenia
1. 35,9 kcal
3. a) 591 kcal; B) 4,94 × 103 s
5. 13,5 W
7. a) 148 kcal; B) 0,418 s, 3,34 s, 4,19 s, 22,6 s, 0,456 s
9. 33,0 g
10. (a) 9,67 L; (b) ropa naftowa jest mniej gęsta niż woda, więc unosi się na powierzchni wody, wystawiając ją na działanie tlenu w powietrzu, którego używa do spalania. Ponadto, jeśli woda znajduje się pod olejem, jest mniej efektywna w pochłanianiu ciepła wytwarzanego przez olej.
12. a) 319 kcal; b) 2.00 ºC
14. 20.6 ºC
16. 4,38 kg
18. a) 1,57 × 104 kcal; B) 18,3 kW ⋅ h; c) 1,29 × 104 kcal
- wartości podane w normalnej temperaturze topnienia i wrzenia przy standardowym ciśnieniu atmosferycznym (1 atm). ↵
- przy 37.0 ºC (temperatura ciała), ciepło parowania Lv dla wody wynosi 2430 kJ/kg lub 580 kcal/kg ↵
- przy 37.0 ºC (temperatura ciała), ciepło parowania LV dla wody wynosi 2430 kJ/kg lub 580 kcal/kg ↵