A Microbial Biorealm page on the genus Enterococcus faecalis
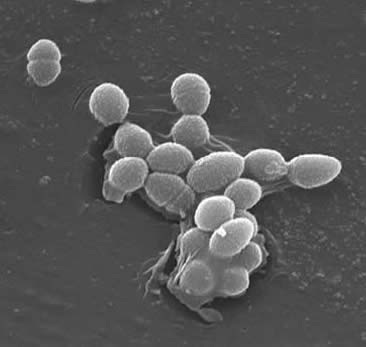
Classification
Higher order taxa
Bacteria; Firmicutes; Bacilli; Lactobacillales; Enterococcaceae; Enterococcus
gatunki
Enterococcus faecalis
opis i znaczenie
enterokoki to Gram-dodatnie koki, które mogą przetrwać trudne warunki w przyrodzie. Można je znaleźć w glebie, wodzie i roślinach. Niektóre szczepy są używane do produkcji żywności, podczas gdy inne są przyczyną poważnych infekcji u ludzi i zwierząt (np. wiadomo, że kolonizują układ pokarmowy i narządów płciowych ludzi). Są one związane zarówno z infekcjami nabytymi w społeczności, jak i w szpitalu. Enterokoki mogą rosnąć w zakresie temperatur od 10 do 42°C oraz w środowiskach o szerokich wartościach pH. Niektóre są znane jako ruchome. Chociaż istnieje ponad 15 gatunków z rodzaju Enterococcus, 80-90% izolatów klinicznych to E. faecalis (8). Enterokoki zazwyczaj tworzą krótkie łańcuchy lub są ułożone w pary. Jednak w pewnych warunkach wzrostu wydłużają się i pojawiają cocobacillary. Ogólnie enterokoki są Alfa-hemolityczne. Niektóre posiadają antygen Lancefielda grupy D i mogą być wykryte za pomocą testów aglutynacyjnych opartych na przeciwciałach monoklonalnych.Enterokoki są zazwyczaj katalazo ujemne i są beztlenowe. Są zdolne do wzrostu w 6,5% NaCl, mogą hydrolizować eskulinę w obecności 40% soli żółciowych i są dodatnimi arylamidazą pirolidonylową i arylamidazą leucyny (8). Enterokoki okazały się stanowić wyzwanie terapeutyczne ze względu na ich oporność na wiele leków przeciwdrobnoustrojowych, „w tym środki czynne ściany komórkowej; aminoglikozydy, penicylinę i ampicylinę oraz wankomycynę” (1). Enterokoki mają zdolność do nabywania wielu różnych czynników oporności przeciwdrobnoustrojowej, które stanowią poważne problemy w leczeniu pacjentów z infekcjami enterokokowymi (8). Ogólnie Izolaty enterokokowe o obniżonej wrażliwości na wankomycynę można sklasyfikować jako vanA, vanB i vanC. vana i vanB stanowią największe zagrożenie, ponieważ są najbardziej oporne, a geny oporności są przenoszone na plazmid. Ponieważ geny oporności są przenoszone na plazmidzie, są one łatwo przenoszone, E. faecalis może przenosić te plazmidy przez koniugację (2). E. faecalis są również odporne na teikoplaninę. Stwierdzono szczepy enterokokowe, które są zależne od wankomycyny, ale są rzadkie i rzadziej niż szczepy oporne na wankomycynę (określane jako „enterokoki oporne na wankomycynę” lub „VRE”) (1).
struktura genomu

ze względu na wiele zagrożeń dla zdrowia publicznego, dane o sekwencji genomu ze szczepu Enterococcus były konieczne. Szczepem wybranym do sekwencjonowania genomu DNA był E. faecalis V583, pierwszy izolat oporny na wankomycynę w Stanach Zjednoczonych. Genom szczepu V583 został zsekwencjonowany przez Institute for Genome Research (TIGR). Genom enterokokowy wykazuje, że E. faecalis jest metabolicznie zróżnicowany i zawiera szeroki zakres systemów regulacyjnych. Szczep V583 zawiera cztery cząsteczki DNA: główny 3,218,030 para zasad bakteryjnych chromosomu i trzy okrągłe plazmidy. Chromosom zawiera około 3500 otwartych ramek odczytu (ORFs), około 1/3 z nich nie ma funkcji przypisywalnej (8). Trzy plazmidy są okrągłymi cząsteczkami DNA zidentyfikowanymi jako plazmid-1, plazmid-2 i plazmid-3. Plazmid-1 zawiera 66 320 bp, plazmid-2 zawiera 17 963 bp, a plazmid-3 zawiera 57 660 bp. Plazmidy kodują wiele genów, w tym transpozazy, białka oporności na wiele leków i inhibitor wzrostu regulowany ppGpp (8). Średni skład G + C chromosomu E. faecalis wynosi 37,38%. Ponieważ cząsteczka DNA jest tak duża, występują regionalne odchylenia od średniej. Jedną z tych lokalizacji jest duży segment związany z „klastrem genów oporności na wankomycynę umieszczonym w pobliżu 2,22 Mb”, wykazujący duży wzrost procentowej zawartości G+C (8). Różnice te związane z opornością na antybiotyki lub zjadliwością sugerowały nabycie materiału genetycznego od obcego gatunku poprzez transfer poziomy. Nadal nie wiadomo, czy transfery są odpowiedzialne za zmiany w składzie DNA. Informacje zawarte w genomie E. faecalis V583 znacznie pomoże zrozumieć, w jaki sposób organizm przystosował się do bycia wszechstronnym ludzkim patogenem. Wykorzystując genomikę porównawczą, rola różnych elementów regulacyjnych będzie lepiej rozumiana w sposobie, w jaki reagują one na różne naprężenia środowiskowe i w ekspresji potencjalnych czynników zjadliwości (8). Więcej takich badań sugeruje nowe leki na infekcje bakteryjne wywołane przez enterokoki.Genom zawiera również 3 operony Ebp (kodujące pili związane z biofilmem wsierdzia), które są ważne dla produkcji biofilmu szczepu OG1RF E. faecalis. Szczep ten wykorzystuje te operony do produkcji pili powierzchniowych. . Pili powierzchniowe są używane do „przywiązania do powierzchni gospodarza i są antygenowe u ludzi podczas zapalenia wsierdzia” (9).
TIGR zawiera pełną listę genów chromosomów E. faecalis.
struktura komórkowa i metabolizm
metabolizm komórkowy
enterokoki żyją w trudnych warunkach, takich jak drogi jelitowe ludzi i zwierząt. Wzrost w tych nieprzyjaznych warunkach wymaga, aby E. faecalis miał metabolizm, który jest elastyczny. E. faecalis są zdolne nie tylko do fermentacji w celu wytworzenia kwasu mlekowego, ale także mogą „katabolizować spektrum źródeł energii z węglowodanów, glicerolu, mleczanu, jabłczanu, cytrynianu, kwasów diamino i wielu kwasów keto” (3).wykazano, że w wybranych warunkach wzrostu E. faecalis może zwiększyć wzrost poprzez fosforylację oksydacyjną przy użyciu siły napędowej protonu ustanowionej przez transport elektronów. Konsekwencją „rodzącego się oddychania jest wytwarzanie silnych utleniaczy” (np. ponadtlenku i nadtlenku wodoru), stres oksydacyjny, który E. faecalis może tolerować (3). Tolerancja tego stresu, w połączeniu z innymi ciężkimi warunkami wzrostu, pozwala E. faecalis rosnąć w temperaturze od 10 do 45°C, w solach żółciowych oraz przy bardzo niskim i wysokim pHs. Ponadto E. faecalis może być odporny na azydek, detergenty, metale ciężkie i Etanol. Ponieważ E. faecalis może wykorzystywać różne źródła cukru, może żyć w różnych środowiskach, zwłaszcza w jelitach, gdzie składniki odżywcze są ograniczone (2). W jelicie E. faecalis czerpie większość swojej energii z fermentacji niewchłanianych cukrów. E. faecalis może również uzyskać energię poprzez degradację mucyny, węglowodanu, który jest silnie glikozylowany i wytwarzany przez komórki kielicha jelitowego (2).E. faecalis używa „systemu fosfoenolipirogronianowego fosfotransferazy (PTS) do wykrywania cukrów poza komórką i wiązania wychwytu cukrów z fosforylacją” (2). W ten sposób marnuje się mniej energii (ATP) w porównaniu do tego, jak cukier jest gromadzony przez systemy inne niż PTS. Do cukrów metabolizowanych przez E. faecalis należą: d-glukoza, d-fruktoza, laktoza, maltoza (wszystkie substraty PTS). W Enterokokach PTS reguluje również metabolizm glicerolu, wydalanie induktorów i represje katabolitów (8). E. faecalis jest jedną z kilku Gram-dodatnich bakterii o niskiej zawartości G+C, które wydalają cukier podczas wzrostu na glukozie, zjawisko znane jako wydalenie induktora (8). E. faecalis może nawet fermentować glicerol w warunkach tlenowych i mikroaerofilowych. E. faecalis może również rosnąć na glicerolu w warunkach beztlenowych, ponieważ „wyraża gen dla aktywności dehydrogenazy glicerolu związanej z NAD+” (8). Glicerol może przenikać przez błonę komórkową za pomocą białka zwanego glicerol diffusion facilitator (GlpF). GlpF sprawia, że stężenie glicerolu wewnątrz i na zewnątrz komórki jest równe, białko jest hamowane przez glikolizę. E. faecalis są w stanie żyć w ekstremalnie zasadowym pH i wysokim stężeniu soli. Cechy te wymagają transportu kationów, aby utrzymać stały skład jonów cytozolowych niezbędny do homeostazy. Wszystkie komórki muszą wydalać nadmiar sodu, aby utrzymać stężenie cytozoli w zakresie, który sprzyja homeostazie. E. faecalis wykazuje zarówno antyporter Na + / H+, jak i atpazę typu wakuolarnego (2). Potas jest głównym kationem wewnątrzkomórkowym. Stężenie potasu w E. faecalis wynoszące 0,4 do 0,6 M jest niezbędne dla prawidłowego metabolizmu komórkowego, „neutralizuje aniony wewnątrzkomórkowe, aktywuje różnorodne enzymy i reguluje pH cytozoliczne” (8). E. faecalis wykazuje ekspresję co najmniej dwóch transporterów potasu do wykonywania regulacji, KtrI i KtrII wraz z systemem Kep do wytłaczania K+ (8). Chociaż wiadomo, że KtrI i KtrII są układami wychwytu K+ (są to symportery K+/H+), niewiele więcej wiadomo o białkach.
struktura komórkowa
enterokoki to Gram-dodatnie kokcyki, które zazwyczaj tworzą krótkie łańcuchy lub są ułożone w pary (3). W pewnych warunkach wzrostu mogą one wydłużać się i pojawiać coccobacillary. Ściana komórkowa E. faecalis stanowi od 20 do 38% suchej masy komórki (w komórkach w fazie wykładniczej i stacjonarnej). Biorąc pod uwagę, że E. faecalis jest bakterią Gram-dodatnią, istnieją trzy główne składniki, które tworzą jego ścianę komórkową: peptydoglikan, kwas teichowy i polisacharyd. 40% ściany komórkowej składa się z peptydoglikanu, podczas gdy reszta ściany komórkowej składa się z „polisacharydu zawierającego ramnozę i kwasu teichowego zawierającego rybitol” (3). Peptydioglikan działa (jak w większości komórek Gram-dodatnich), aby oprzeć się pękaniu wywołanemu wysokim cytoplazmatycznym ciśnieniem osmotycznym. E. faecalis jest ogólnie uważany za organizm nie kapsułkowany, czego dowodem jest „brak wykrywalnego fenotypu mukoidalnego” (3). Jednak podgrupy izolatów E. faecalis posiadają otoczkowy polisacharyd. E. faecalis może wymieniać materiał genetyczny (plazmidy) w procesach koniugacji indukowanych przez małe peptydowe feromony (2). Białko powierzchniowe „substancje agregujące, które rozpoznają specyficzny ligand na komórkach biorcy” zapewniają skuteczne połączenia do koniugacji (2).E. faecalis mają również zdolność do tworzenia pili powierzchniowych, co może prowadzić do tworzenia biofilmu. Szczepy E. faecalis powodujące zapalenie wsierdzia zawierają duże ilości tych pili. Pili pozwalają na przymocowanie do powierzchni żywiciela (np. tkanki serca). Szczepy E. odchody wywołujące zapalenie wsierdzia wytwarzają „biofilm znacznie częściej, a także w większym stopniu niż Izolaty nie-wsierdzia” (9).
Ekologia
E. faecalis jest bardzo zróżnicowanym gatunkiem enterokoków. Współdziała z wieloma innymi organizmami i ma wpływ na środowisko. Enterokoki są członkami społeczności bakteryjnej zamieszkującej jelita grubego u ludzi. Są one również naturalną częścią flory jelitowej większości innych ssaków i ptaków (8). Enterokoki występują również w glebie, roślinach i wodzie. Kiedy znajdują się one w wodzie jest to zazwyczaj dlatego, że woda została zanieczyszczona fekaliami. Chociaż E. faecalis nie pojawia się zbyt często w roślinach, inne szczepy enterokoków zostały znalezione wśród roślin i najprawdopodobniej występują w zanieczyszczonym źródle wody (8).Ekologia oporności na antybiotyki i transferu genów zjadliwości w środowisku nadal nie jest dobrze poznana. Owady, takie jak muchy domowe (HF), które rozwijają się w rozkładającym się materiale organicznym, mogą przenosić odporne na antybiotyki bakterie z odchodów zwierząt i innych rozkładających się podłoży organicznych do pomieszczeń mieszkalnych (7). HF są doskonałymi przekaźnikami ze względu na żywe społeczności mikrobiologiczne obecne w siedliskach, w których się rozwijają (np. kał). Dodatkowymi właściwościami transferowymi są sposób, w jaki HF karmią swoje młode (niedomykalność) i ich przyciąganie do ludzkiego pokarmu. Ponieważ HF może latać na duże odległości, owad ten jest bardzo dobry do rozprzestrzeniania bakterii kałowych, w tym patogenów ludzkich i zwierzęcych oraz prawdopodobnie odpornych na antybiotyki szczepów enterokoków (7). Niedawne badanie przesiewowe pod kątem oporności na antybiotyki i genów zjadliwości w Enterokokach z HF w restauracjach fast-food w Kanasas. Badanie to wykazało, że „muchy domowe w obiektach obsługujących żywność i obsługujących żywność mogą przenosić odporne na antybiotyki i potencjalnie wirulentne enterokoki, które mają zdolność do poziomego przenoszenia genów oporności na antybiotyki do innych bakterii” (7).Skutki, że E. faecalis ma na środowisko wydają się być bardziej negatywne. Zazwyczaj zanieczyszczają zasoby wody, które mogą prowadzić do zainfekowanych roślin, a także infekcji u ludzi (8). Czynniki antybiotyczne mogą być również transportowane przez różne owady (np. muchy domowe) i zwierzęta, co prowadzi do wzrostu liczby zjadliwych E. faecalis.
patologia
enterokoki stały się główną przyczyną zakażeń szpitalnych, a w tej grupie Enterococcus faecalis powoduje większość ludzkich zakażeń enterokokowych. Zakażenia te mogą być miejscowe lub systematyczne i obejmują zakażenia dróg moczowych i jamy brzusznej, zakażenia ran, bakteriemię i zapalenie wsierdzia (2). Ponieważ E. faecalis są zdolne do przetrwania licznych wyzwań środowiskowych (takich jak ekstremalne temperatury i obecność soli żółciowych) i ponieważ mogą nabyć oporność na wiele antybiotyków, bakterie te stały się poważnym problemem zdrowotnym. System National Nosocomial Infection Surveillance (NNIS) od 1989 r.odnotował wzrost częstości zakażeń wywołanych enterokokami opornymi na wankomycynę (VRE) (1). Może to oznaczać poważne problemy zdrowotne, w tym Brak dostępnej antybiotykoterapii w przypadku zakażeń VRE, ponieważ większość szczepów VRE wykazuje oporność na wiele antybiotyków poza wankomycyną (np. aminoglyscoides i ampicylina). Przeniesienie genów opornych na wanokmycynę z VRE do innych patogenów Gram-dodatnich jest poważnym problemem dla zdrowia publicznego. Najczęstszym sposobem, w jaki E. faecalis powoduje zakażenie występuje w szpitalu/zakładzie opieki długoterminowej, jest transmisja E. faecalis między pacjentami (8). Enterokoki mogą być noszone na rękach pracowników służby zdrowia i być przenoszone (przenoszone) od jednego pacjenta do drugiego. Wykazano, że VRE na rękach może utrzymywać się do 60 minut (8). Transmisja z rąk pracownika służby zdrowia do pacjenta może nastąpić po kontakcie z cewnikami dożylnymi lub moczowymi pacjenta. Termometry doodbytnicze, nieprawidłowo oczyszczone po użyciu, mogą również przesyłać VRE od pacjenta do pacjenta. Czasami transmisja może prowadzić do kolonizacji przewodu pokarmowego pacjenta z nabytym szczepem. Nowy szczep staje się następnie częścią endogennej flory pacjenta (8). Nabyty szczep, posiadający geny oporności na antybiotyki, jest w stanie żyć w przewodzie pokarmowym. Infekcje powstają wtedy z nowo nabytych szczepów E. faecalis.E. faecalis może powodować wiele infekcji w organizmie człowieka. Najczęstszym zakażeniem wywołanym przez enterokoki jest zakażenie dróg moczowych. E. faecalis może powodować infekcje dolnych dróg moczowych (zum), takie jak zapalenie pęcherza moczowego, zapalenie gruczołu krokowego i zapalenie najądrzy (8). E. faecalis występują również w infekcjach jamy brzusznej, miednicy i tkanek miękkich. E. faecalis może powodować bakteriemię szpitalną. Źródłem bakteriemii są najczęściej drogi moczowe, występujące z zakażonego cewnika dożylnego. Zapalenie wsierdzia jest najpoważniejszą infekcją enterokokową, ponieważ powoduje zapalenie zastawek serca. W wielu przypadkach zapalenia wsierdzia leczenie antybiotykiem nie powiedzie się i konieczna jest operacja usunięcia zainfekowanej zastawki (8). Mniej powszechne zakażenia wywołane przez E. faecalis obejmują zapalenie opon mózgowo-rdzeniowych, hematogenne, zapalenie kości i szpiku, septyczne zapalenie stawów i (bardzo rzadko) zapalenie płuc. Ze względu na oporność enterokoków na wiele antybiotyków leczenie tych infekcji jest trudne.
zastosowanie do biotechnologii
enterokoki zostały zbadane pod kątem możliwego zastosowania jako probiotyk (suplement diety zawierający żywe nie-wirulentne komórki drobnoustrojów, które po spożyciu są uważane za korzystnie wpływające na skład mikroflory jelitowej). Wykazano, że podawanie szczepu E. faecalis zmniejsza biegunkę. Probiotyki E. faecalis są stosowane w paszach dla kurcząt / świń/bydła w celu zmniejszenia biegunki u zwierząt (8).
ze względu na wysokie właściwości chorobotwórcze E. faecalis, przeprowadzono znacznie więcej badań nad powstrzymaniem zjadliwości E. faecalis niż korzystne stosowanie E. faecalis.
aktualne badania
1.) Nadzieja na infekcje wywołane przez Enterococcus faecalis (4)
wiadomo, że bakterie oporne na wankomycynę (np. E. faecalis) stwarzają wiele problemów dla społeczeństwa, powodując infekcje bakteryjne u ludzi, które są trudne do wyleczenia. Infekcje enterokokowe są trudne, ponieważ organizmy mają zdolność do szybkiego pozyskiwania i rozpowszechniania genów oporności. Ceftobiprol (BPR) był stosowany jako badana cefalosporyna przeciwko Gram-dodatnim kokci. BPR jest cefalosporyną pozajelitową o szerokim spektrum działania, o wysokim powinowactwie do białek wiążących penicylinę Gram-dodatnią i Gram-ujemną. Wykazuje również odporność na hydrolizę przez β-laktamazy.W badaniu tym zbadano aktywność BRP przeciwko dużej kolekcji E. faecalis, patrząc na działanie bakteriobójcze BPR przeciwko izolatom opornym na wankomycynę. Badanie wykazało, że podatny na BPR u E. faecalis nie ma wpływu na obecność oporności na wankomycynę ani na wytwarzanie β-laktamazy. W szczepach E. faecalis wykazujących oporność na wankomycynę (fenotypy VanA i VanB) lub oporność na ampicyliinę, BPR był bakteriobójczy. Naukowcy wykazali, że BPR wykazywał działanie bakteriobójcze przeciwko E. faecalis w dawce 750 mg, hamując 100% aktywności E. faecalis. Chociaż obecność enzymu β-laktamazy jest rzadka u E. faecalis, jego obecność utrudnia stosowanie najskuteczniejszych β-laktamów anty-enterokokowych (np. ampicyliny). BPR jest słabym substratem dla enzymu β-laktamazy, co tłumaczy jego doskonałą aktywność wobec β-laktamazy wytwarzającej E. faecalis.Badania te wykazały, że BPR ma silną aktywność przeciwko bardzo dużej kolekcji E. faecalis. Na aktywność BPR nie wpływała oporność na wankomycynę ani wytwarzanie β-laktamazy. Z tego względu BPR jest środkiem pomocniczym do stosowania w leczeniu wytwarzających β-laktamazy i opornych na wankomycynę zakażeń E. faecalis u ludzi.
2.) Badanie, w jaki sposób Enterococcus faecalis staje się oporny na lek linezolid (5)
antybiotyki stosowane w leczeniu infekcji bakteryjnej mogą mieć wpływ na florę jelitową. Oporne bakterie mogą być wybierane podczas leczenia, takie jak enterokoki, i są potencjalnie patogenne. Pojawienie się oporności jest problemem dla nowych antybiotyków, ponieważ może to zagrozić przydatności antybiotyków.W badaniu tym zbadano pojawienie się oporności na antybiotyki przez E. faecalis. Dokładniej, naukowcy przyjrzeli się oporności na linezolid (pierwszy z nowej klasy antybiotyków znanych jako „oksazolidynony”). Linezolid może być stosowany przeciwko opornym na wiele leków Gram-dodatnim kokom, w tym VRE. Hamuje syntezę białek bakteryjnych poprzez wiązanie specyficznie z domeną w podjednostce rybosomalnej 50s i nie ma wpływu na mechanizmy oporności, które wpływają na inne antybiotyki. W badaniu tym oceniano tempo powstawania opornych na linezolid mutantów E. faecalis w przewodzie pokarmowym myszy gnotobiotycznych. Does linezolidu podawano w wodzie w dawkach od 0,5, 0,005 do 0,005 g / L. mutanty były zależne od podanego linezolidu, poziomy oporności wzrastały wraz z czasem ekspozycji. Nie wyizolowano mutantów bez linezolidu, co sugeruje, że oporność de novo na linezolid była niezbyt częsta w Enterokokach.Badania wykazały, że mutacja w pojedynczym Genie 23s rRNA była krytycznym krokiem w powstawaniu oporności na linezolid. Pierwotną kolonizację mutantów z pojedynczą mutacją obserwowano u myszy już 5 dni po rozpoczęciu leczenia.Te eksperymenty z udziałem myszy pomagają wyjaśnić wzór powstawania oporności na linezolid obserwowany w izolatach klinicznych. Zespół badawczy wykazał, że dawka ma kluczowe znaczenie dla dynamiki oporu. Wyniki te powinny pomóc w określeniu najlepszych strategii terapeutycznych, aby zminimalizować pojawienie się oporności w warunkach klinicznych, prawdopodobnie ratując wiele istnień ludzkich.
3.) Stwierdzono, że kinaza Ser/Thr w Enterococcus faecalis pośredniczy w oporności na środki przeciwdrobnoustrojowe (6)
Enterococcus faecalis powoduje wiele zakażeń odpornych na antybiotyki w szpitalach, co jest konsekwencją wrodzonej odporności na niektóre antybiotyki oraz zdolności do przetrwania i namnażania się w przewodzie pokarmowym.Genetyczna podstawa oporności obserwowana w E. faecalis nie jest dobrze znany, badania te próbują zidentyfikować przyczynę oporności. Naukowcy wykazali, że PrkC, jednoskładnikowe białko sygnalizacyjne zawierające domenę kinazy Ser/Thr typu eukariotycznego, pozwoliło na wrodzoną oporność przeciwdrobnoustrojową i trwałość jelitową E. faecalis. Stwierdzono, że mutant E. faecalis pozbawiony PrkC rozwijał się w tempie dzikim przy braku stresu przeciwdrobnoustrojowego, ale wykazywał zwiększoną wrażliwość na związki aktywne otoczki komórkowej, w tym antybiotyki, które celowały w biogenezę ściany komórkowej i detergenty żółciowe.PrkC reguluje procesy fizjologiczne w E. faecalis, które są kluczem do jego sukcesu jako patogenu szpitalnego. Przewidywana przez naukowców struktura PrkC była domeną kinazy cytoplazmatycznej oddzieloną przez segment transbłonowy, który wiązał niezwiązany ze sobą peptydoglikan. Sugeruje to, że PrkC jest receptorem przezbłonowym, który monitoruje integralność ściany komórkowej E. faecalis i pośredniczy w odpowiedziach adaptacyjnych w celu utrzymania tej intergrity. PrKC jest ważne dla E. faecalis powoduje zakażenia szpitalne, co sugeruje, że białko sygnalizacyjne jest celem rozwoju terapii zapobiegających zakażeniom przez oporne na antybiotyki enterokoki.
1.) I. T. Paulsen, L. Banerjei, G. S. A. Myers, K. E. Nelson, R. Seshadri, T. D. Read, D. E. Fouts, J. A. Eisen, S. R. Gill, J. F. Heidelberg, H. Tettelin, R. J. Dodson, L. Umayam, L. Brinkac, M. Beanan, S. Daugherty, R. T. DeBoy, S. Durkin, J. Kolonay, R. Madupu, W. Nelson, J. Vamathevan, B. Tran, J. Upton, T. Hansen, J. Shetty, H. Khouri, T. Utterback, D. Radune, K. A. Ketchum, B. A. Dougherty, C. M. Fraser. „Role of Mobile DNA in the Evolution of Vancomycin-Resistant Enterococcus faecalis.”Nauka. Marzec 2003. Vol. 299, No. 5615. 2071-2074
2.) Murrary BE. Maj 1998. „Różnorodność wśród wielolekoopornych enterokoków.”Pojawiające Się Choroby Zakaźne. Vol. 4, Nr 1. S. 46-65.
3.) De la Maza, Luis M., Marie T. Pezzlo i Janet T. Shigei. Kolorowy Atlas bakteriologii medycznej. Washington, DC: American Society for Microbiology Press, 2004.
4.) Arias C., Singh K., Panesso D., Murray BE. „Time-Kill and Synergism Studies of ceftobiprole against Enterococcus faecalis, Including ß-Lactamase-Producing and Vancomycino-Resistant Isolates.”Środki przeciwdrobnoustrojowe i chemioterapia. Czerwiec 2007. Vol. 51, nr 6. S. 2043-2047.
5.) Bourgeois-Nicolaos N., Massias L., Coison B., Butel MJ, Andremont A., Doucet-Populaire F. ” Dose Dependence of Emergence of Resistance to Linezolid in Enterococcus faecalis In Vivo.”The Journal of Infectious Diseases. 2007. Vol. 195. 1480-1488.
6.) Kristich C., Wells C., Dunny G. „Kinaza Ser/Thr typu eukariotycznego w Enterococcus faecalis pośredniczy w oporności na środki przeciwdrobnoustrojowe i utrzymywaniu się jelit.”Proceedings of the National Academy of Sciences of the United States of America. Luty 2007. Vol. 104, No.9. P. 3508-3513.
7.) Macovei, L., Zurek, L. ” Ecology of Antybiotyc Resistance Genes: Characterization of Enterococci from Houseflies Collected in Food Settings.”Mikrobiologia stosowana i środowiskowa. Czerwiec 2006. Vol. 72, nr 6. P. 4028-4035.
8.) Gilmore, Michael. Enterokoki: patogeneza, Biologia molekularna i oporność na antybiotyki. Washington, DC: American Society for Microbiology Press, 2002.
9.) Nallapareddy SR, Singh KV, Sillanpää J, Garsin DA, Höök M,Erlandsen SL, Murray BE.. „Endocarditis and biofilm-associated pili of Enterococcus faecalis.”The Journal of Clinical Investigation. Październik 2006. Nr 116. P. 2799-2807.
red. Richard A. Martinez z UC San Diego, uczeń Rachel Larsen.