co to jest wiązanie jonowe?
wiązania chemiczne tworzą się, gdy całkowita energia połączonych atomów jest niższa niż całkowita energia oddzielnych atomów.Forma, jaką przyjmuje Wiązanie, zależy od układu elektronów, który minimalizuje energię.
w niektórych przypadkach elektrony są dzielone między Atomy – nazywa się to wiązaniem kowalencyjnym.
w innych przypadkach dochodzi do całkowitego przeniesienia jednego lub więcej elektronów z jednego atomu do drugiego.Atom, który traci elektrony staje się dodatnio naładowany jon.Atom, który otrzymuje elektrony, staje się ujemnie naładowanym Jonem.
prowadzi to do wiązania jonowego-wzajemnego przyciągania elektrostatycznego dodatniego i ujemnego charges.In jego najczystsza forma, wiązanie jonowe nie jest kierunkowe. Można ją uznać za proste przyciąganie Kulombiczne między ładunkami punktowymi.Różni się to od wiązania kowalencyjnego, w którym współdzielenie elektronów powoduje wiązania kierunkowe.
Transfer elektronów
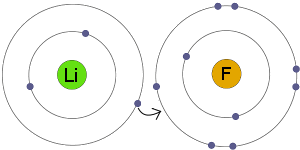
Li przenosi elektron do F. rezultatem jest to, że zarówno wynik jony stają się naładowane elektrycznie i mają kompletne, stabilne powłoki elektronowe.
przyciąganie elektrostatyczne
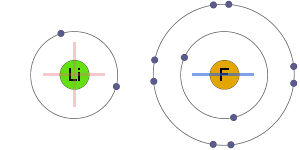
jony dodatnie i ujemne są elektrostatycznie przyciągane do siebie, co powoduje wiązanie jonowe.
Siła kulombiczna nie ma preferowanego kierunku, w wyniku czego związki jonowe mają tendencję do istnienia jako gigantyczne struktury sieci krystalicznej jonów upakowanych razem.
próbka sieci krystalicznej fluorku litu

elektroujemność i wiązanie jonowe
dwa elementy mają tendencję do wiązania jonowego, gdy różnią się znacznie elektroujemnością.
układ okresowy elektroujemności
im jaśniejszy odcień zieleni, tym wyższa elektroujemność. Szary oznacza, że żadna wartość nie jest znana. (Kliknij obraz, aby powiększyć widok.)

znak wiązania kowalencyjnego
absolutnie czyste związki jonowo związane nie istnieją, ponieważ dodatnio naładowany jon polaryzuje obłok elektronów jonu ujemnego.Jest to szczególnie zauważalne w przypadku małych, silnie naładowanych jonów metali, takich jak Al3+, chociaż efekt polaryzacyjny występuje w pewnym stopniu we wszystkich związkach jonowych.Polaryzacja jest efektywnie kierunkowym efektem dzielenia elektronów, stąd wprowadza niewielką ilość kowalencji w związkach jonowych.
proporcja zachowania jonowego/kowalencyjnego w wiązaniu może być bardzo z grubsza oceniona za pomocą skali Paulinga elektroujemności.Linus Pauling oszacował, że różnica elektroujemności 1,7 między pierwiastkami prowadzi do wiązania, które jest 50 procent jonowe.
wartości poniżej 1 odpowiadają dominującemu wiązaniu kowalencyjnemu, a wartości powyżej 2 dominującemu wiązaniu jonowemu.
Electronegativity of Selected Elements (Pauling Scale)
| Element | Electronegativity |
|---|---|
| hydrogen | 2.20 |
| lithium | 0.98 |
| sodium | 0.93 |
| aluminum | 1.61 |
| carbon | 2.55 |
| oxygen | 3.44 |
| chlorine | 3.16 |
| iodine | 2.66 |
Wiązanie C-H z różnicą 0,35 będzie kowalencyjne, podczas gdy Wiązanie NaCl przy 2,23 będzie jonowe.Wiązanie HCl w 0,96 będzie kowalencyjne polarne, a wiązanie LiI w 1,68 będzie 50/50 jonowe / kowalencyjne.
największa różnica elektroujemności wynosi 3,19, między cezem (0,79) a fluorem (3,98). Powstałe Wiązanie ma około 95 procent charakteru jonowego.
