właściwości związków kowalencyjnych
kiedy mówiliśmy o stałych związkach jonowych w związkach jonowych, odkryliśmy, że ich właściwości często wynikają z silnego przyciągania przeciwnych ładunków elektrycznych. Nie powinno dziwić stwierdzenie, że właściwości związków kowalencyjnych są w dużej mierze spowodowane naturą wiązań kowalencyjnych.
jedną z najważniejszych rzeczy do zapamiętania o związkach kowalencyjnych jest to, że nie są jonowe. Wydaje się to oczywiste, ale różnica jest subtelniejsza, niż można sobie wyobrazić. Aby zilustrować tę koncepcję, spójrz na poniższy rysunek:
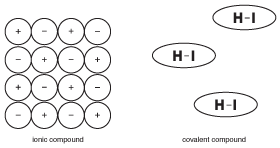
rysunek 9.5 właściwości stałych związków jonowych opierają się na fakcie, że wiele jonów jest sztywno utrzymywanych w miejscu za pomocą sił elektrycznych. Cząsteczki w związkach kowalencyjnych działają jednak ze względną niezależnością od sąsiednich cząsteczek.
w przeciwieństwie do związków jonowych, gdzie wszystkie jony w dużym krysztale pomagają utrzymać się razem, cząsteczki w związku kowalencyjnym są utrzymywane razem przez siły zwane „siłami międzycząsteczkowymi”, które są znacznie słabsze niż wiązania chemiczne (więcej o siłach międzycząsteczkowych w ciałach stałych). W rezultacie cząsteczki w związku kowalencyjnym nie są przyciągane do siebie tak bardzo, jak jony w związkach jonowych. Ta różnica w strukturze jest ważna w zrozumieniu właściwości związków kowalencyjnych.
związki kowalencyjne mają niską temperaturę topnienia i wrzenia
jak wspomniano w związkach jonowych, duża ilość energii jest potrzebna do stopienia związku jonowego z powodu silnych oddziaływań między kationami i anionami w krysztale jonowym. Jednak w związkach kowalencyjnych wszystkie cząsteczki są związane tylko słabo z sąsiednimi cząsteczkami; dlatego potrzeba bardzo mało energii, aby oddzielić cząsteczki kowalencyjne od siebie.
Wielu początkujących studentów chemii fałszywie wierzy, że gdy cząsteczka kowalencyjna topi się, wiązania kowalencyjne zostają zerwane. To nieprawda. Kiedy związki jonowe topią się, przyciąganie jonowe zawodzi. Kiedy związki kowalencyjne topią się, cząsteczki po prostu odrywają się od siebie, pozostawiając wiązania nienaruszone.
związki kowalencyjne są słabymi przewodnikami
związki jonowe są wielkimi przewodnikami elektryczności po rozpuszczeniu lub stopieniu. Jak wspomniano w związkach jonowych, dzieje się tak dlatego, że związki jonowe mają ruchome jony, które są w stanie przenosić ładunek elektryczny z jednego miejsca do drugiego. Przewodzą również ciepło bardzo dobrze, ponieważ jony są tuż obok siebie, co umożliwia wydajne przenoszenie energii z jednego miejsca do drugiego.
związki kowalencyjne, z drugiej strony, są prawie zawsze dobrymi izolatorami zarówno energii elektrycznej, jak i ciepła. Energia elektryczna nie jest w stanie sprawnie przewodzić przez związki kowalencyjne, ponieważ nie ma jonów, które poruszałyby ładunek elektryczny. Doskonałym przykładem jest to we własnym domu, gdzie metal w przedłużaczach jest pokryty tworzywem sztucznym, aby uniknąć porażenia prądem kota. Ciepło również nie przemieszcza się dobrze przez związki kowalencyjne, ponieważ cząsteczki nie są tak mocno trzymane ze sobą, jak jony w związku jonowym, co czyni transfer ciepła mniej wydajnym. Dlatego używasz rękawic kuchennych, aby wyjąć ciasteczka z piekarnika, a nie pokrywać ręce solą.
związki kowalencyjne czasami spalają
związki organiczne są związkami kowalencyjnymi, które zawierają węgiel. Zwykle zawierają również Wodór. i może zawierać mniejsze ilości innych pierwiastków, takich jak azot, siarka, fosfor, tlen lub którykolwiek z halogenów.
wiele związków kowalencyjnych jest łatwopalnych i łatwo się pali z dodatkiem ciepła. Główną grupę związków kowalencyjnych, które są łatwopalne, nazywa się związkami organicznymi. Związki organiczne spalają się, ponieważ zawierają węgiel i wodór, z których oba ładnie łączą się z tlenem w wysokich temperaturach.
należy pamiętać, że nie wszystkie związki kowalencyjne spalają się?na przykład woda jest związkiem kowalencyjnym i bardzo trudno będzie rozpalić nim ogień. Jednak o wiele bardziej kowalencyjne niż związki jonowe są łatwopalne.
Palność jest ogólną właściwością związków kowalencyjnych, ponieważ znaczna większość znanych związków kowalencyjnych jest organiczna. Ponieważ większość związków organicznych pali się, możemy bezpiecznie wymienić to jako własność związków kowalencyjnych, mimo że istnieje wiele związków kowalencyjnych, które się nie palą.
fragment z kompletnego przewodnika po chemii 2003 autorstwa Iana Gucha. Wszelkie prawa zastrzeżone, w tym prawo do powielania w całości lub w części w dowolnej formie. Używany przez Alpha Books, członka Penguin Group (USA) Inc.
aby zamówić tę książkę bezpośrednio u wydawcy, odwiedź stronę internetową Penguin USA lub zadzwoń pod numer 1-800-253-6476. Możesz również kupić tę książkę w Amazon.com i Barnes &