Periodic trends and solvent effects in nucleophilicity
istnieją przewidywalne okresowe trendy w nukleofilowości. Przechodząc poziomo przez drugi rząd tabeli, trend nukleofilowości jest równoległy do trendu zasadowości:
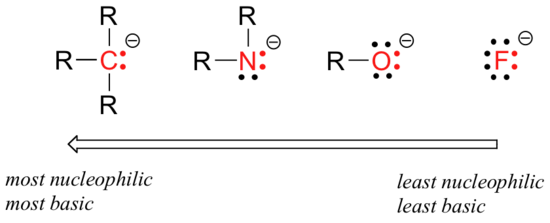
rozumowanie trendu poziomej nukleofilowości jest takie samo jak rozumowanie trendu zasadowości: więcej pierwiastków elektronowych mocniej trzyma swoje elektrony i jest mniej zdolnych do oddania ich do utworzenia nowego wiązania.
ten horyzontalny trend mówi nam również, że aminy są bardziej nukleofilowe niż alkohole, chociaż obie grupy zwykle działają jako nukleofilowe zarówno w reakcjach laboratoryjnych, jak i biochemicznych.
Przypomnijmy, że zasadowość atomów maleje, gdy poruszamy się pionowo w dół kolumny w układzie okresowym: na przykład jony tiolanowe są mniej zasadowe niż jony alkoksydowe, a jony bromkowe są mniej zasadowe niż jony chlorkowe, które z kolei są mniej zasadowe niż jony fluorkowe. Przypomnijmy również, że trend ten można wyjaśnić, biorąc pod uwagę rosnący rozmiar „chmury elektronowej” wokół większych jonów: gęstość elektronów nieodłącznie związana z ładunkiem ujemnym jest rozłożona wokół większego obszaru, co ma tendencję do zwiększania stabilności (a tym samym zmniejszania zasadowości).
pionowy trend okresowy dla nukleofilowości jest nieco bardziej skomplikowany niż dla zasadowości: w zależności od rozpuszczalnika, w którym zachodzi reakcja, trend nukleofilowości może przebiegać w dowolnym kierunku. Weźmy prosty przykład reakcji SN2 poniżej:
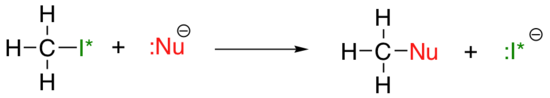
. . .gdzie Nu-jest jednym z jonów halogenkowych: fluorku, chlorku, bromku lub jodku, a grupa opuszczająca I* jest radioaktywnym izotopem jodu (co pozwala odróżnić grupę opuszczającą od nukleofilu w tym przypadku, gdy oba są jodkami). Jeśli ta reakcja zachodzi w protowym rozpuszczalniku (to znaczy rozpuszczalniku, który ma Wodór związany z tlenem lub azotem – najważniejszymi przykładami są woda, metanol i Etanol), reakcja będzie najszybsza, gdy jodek jest nukleofilem, a najwolniejsza, gdy fluor jest nukleofilem, odzwierciedlając względną siłę nukleofilu.

względna nukleofilowość w rozpuszczalniku protonowym
To oczywiście jest odwrotne do pionowego trendu okresowego zasadowości, gdzie jodek jest najmniej zasadowy. Co tu się dzieje? Czy silniejsza zasada, z jej bardziej reaktywnymi niezwiązanymi elektronami walencyjnymi, nie powinna być również silniejszym nukleofilem?
jak wspomniano powyżej, wszystko ma związek z rozpuszczalnikiem. Pamiętajcie, mówimy teraz o reakcji przebiegającej w protonowym rozpuszczalniku, takim jak etanol. Protonowe cząsteczki rozpuszczalnika tworzą bardzo silne interakcje jonowo-dipolowe z ujemnie naładowanym nukleofilem, zasadniczo tworząc’ klatkę rozpuszczalnika ’ wokół nukleofilu:

aby nukleofil mógł zaatakować elektrofil, musi uwolnić się, przynajmniej częściowo, ze swojej klatki rozpuszczalnika. Samotne elektrony pary na większym, mniej zasadowym Jonie jodkowym oddziałują mniej ściśle z protonami na protonowych cząsteczkach rozpuszczalnika – w ten sposób nukleofil jodkowy jest lepiej zdolny do uwolnienia się z klatki rozpuszczalnika w porównaniu z mniejszym, bardziej zasadowym Jonem fluorkowym, którego elektrony pary samotnej są ściślej związane z protonami klatki.
obraz zmienia się, jeśli przełączymy się na polarny rozpuszczalnik aprotowy, taki jak aceton, w którym znajduje się dipol molekularny, ale nie ma wodorów związanych z tlenem lub azotem. Fluor jest najlepszym nukleofilem, a jodek najsłabszym.
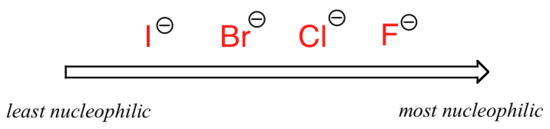
względna nukleofilowość w polarnym rozpuszczalniku aprotycznym
powodem odwrócenia jest to, że w przypadku rozpuszczalnika aprotycznego interakcje jon-dipol między rozpuszczalnik i nukleofil są znacznie słabsze: dodatni koniec dipola rozpuszczalnika jest ukryty we wnętrzu cząsteczki, a tym samym jest ekranowany przed Ujemnym ładunkiem nukleofila.
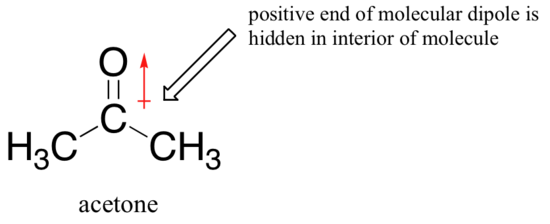
słabsza interakcja rozpuszczalnik-nukleofil oznacza słabszą klatkę rozpuszczalnika dla nukleofila, więc efekt rozpuszczalnika jest znacznie mniej ważny, a im bardziej zasadowy jon fluorkowy jest również lepszym nukleofilem.
dlaczego nie użyć całkowicie niepolarnego rozpuszczalnika, takiego jak heksan, do tej reakcji, tak aby klatka rozpuszczalnika została całkowicie wyeliminowana? Odpowiedź na to pytanie jest prosta – nukleofil musi być w roztworze, aby zareagować z zauważalną szybkością z elektrofilem, a rozpuszczalnik taki jak heksan w ogóle nie będzie solwatował naładowanego (lub wysoce polarnego) nukleofila. Dlatego chemicy używają polarnych rozpuszczalników aprotowych do reakcji substytucji nukleofilowej w laboratorium: są one wystarczająco polarne, aby solwatować nukleofil, ale nie tak polarne, aby zablokować go w nieprzenikalnej klatce rozpuszczalnika. Oprócz acetonu, trzy inne powszechnie stosowane polarne rozpuszczalniki aprotowe to acetonitryl, dimetyloformamid (DMF) i dimetylosulfotlenek (DMSO).
w chemii biologicznej, gdzie rozpuszczalnik jest protowy (woda), najważniejszą implikacją okresowych trendów nukleofilowości jest to, że tiole są silniejszymi nukleofilami niż alkohole. Grupa tiolowa w aminokwasie cysteiny, na przykład, jest silnym nukleofilem i często działa jako nukleofil w reakcjach enzymatycznych, a oczywiście ujemnie naładowane tiolany (RS-) są jeszcze bardziej nukleofilowe. Nie oznacza to, że grupy hydroksylowe na serynie, treoninie i tyrozynie również nie działają jako nukleofile – działają.