cele
- znane i nieznane roztwory jonów metali \(\ce{Ag^{+}}\), \(\ce{Fe^{3+}}\), \(\ce{Co^{2+}}\), \(\ce {Cu^{2+}}\) i \(\ce {Hg^{2+}}\) będą analizowane przy użyciu chromatografii papierowej.
- nieznany roztwór zawierający niektóre z tych kationów zostanie zidentyfikowany przez porównanie z wartościami Rf i kolorami plamek znanych roztworów.
Większość chemików i wielu innych naukowców musi rutynowo rozdzielać mieszaniny i identyfikować ich składniki. Zdolność do jakościowej identyfikacji substancji znalezionych w próbce może mieć kluczowe znaczenie. Na przykład chemik środowiskowy badający próbki zanieczyszczonej wody gruntowej będzie chciał wiedzieć, które toksyczne jony mogą być obecne w próbce.
chromatografia jest jednym z pierwszych narzędzi stosowanych w takich sytuacjach. W tej technice wiele rodzajów mieszanin można podzielić na składniki czyste substancje; w porównaniu ze standardową próbką każda substancja składowa może być wstępnie zidentyfikowana.
istnieje wiele odmian chromatografii, z których każda ma na celu oddzielenie określonych rodzajów mieszanin. Wspólną cechą każdego rodzaju chromatografii jest to, że faza ruchoma (ciecz lub gaz) jest przepychana przez fazę stacjonarną (ciało stałe). Tabela 1 wymienia kilka odmian chromatografii i typowych tożsamości faz. W tym eksperymencie zostanie wykorzystana chromatografia papierowa.
|
Type of Chromatography |
Mobile Phase |
Stationary Phase |
|---|---|---|
|
Gas (GC) |
inert gas (helium) |
waxy liquid or silicone inside narrow tubing |
|
Liquid |
solvent/solvent Mixture (organic or aqueous) |
solid packing (silica, alumina) |
|
Paper |
solvent/solvent Mixture (organic or aqueous) |
paper |
|
Thin-Layer (TLC) |
solvent/solvent Mixture (organic or aqueous) |
silica/alumina coated glass, plastic or metal |
przykład chromatografii kolumnowej (Rysunek 1) pokazuje typowe cechy tej techniki analitycznej. Diagram przedstawia eksperyment, w którym dwuskładnikowa mieszanina poddawana jest chromatografii kolumnowej. Kolumna jest wypełniona stałym materiałem zwanym fazą stacjonarną. Płynny rozpuszczalnik lub roztwór eluujący wlewa się do kolumny i całkowicie zwilża stały materiał opakowaniowy. Następnie mieszaninę ładuje się na górną część mokrej kolumny i dodaje się więcej eluentu. Grawitacja ciągnie fazę ruchomą w dół przez fazę stacjonarną, a składniki w mieszaninie zaczynają poruszać się przez kolumnę w różnym tempie. Na diagramie składnik a porusza się szybciej niż składnik B; tak więc składnik B jest zatrzymywany na kolumnie przez dłuższy czas niż składnik A. zwykle wynika to Z różnicy w rozpuszczalności dwóch związków w rozpuszczalniku i/lub różnicy w przyciąganiu do stałego materiału opakowaniowego. W miarę dodawania większej ilości eluentu do górnej części kolumny, komponenty ostatecznie opuszczą kolumnę osobno. Czas potrzebny do wyjścia z kolumny, zwany czasem retencji, będzie powtarzalny dla każdego elementu w określonych warunkach-ruchomych i stacjonarnych tożsamości fazowych, temperatury i szerokości kolumny. Po wyjściu składników z kolumny rozpuszczalnik można usunąć przez odparowanie, a czyste składniki można dalej analizować lub identyfikować.
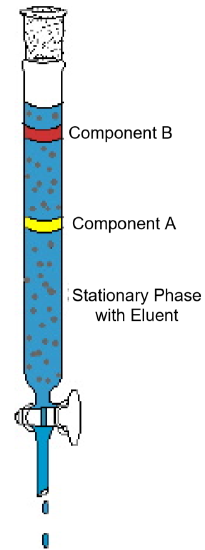
Rysunek 1: typowy eksperyment chromatografii kolumnowej pokazuje oddzielenie dwuskładnikowej mieszaniny.
wstępną identyfikację składników można uzyskać, porównując nieznaną mieszaninę z starannie przygotowaną znaną mieszaniną: jeśli znany składnik ma taki sam czas retencji jak Nieznany składnik w tych samych warunkach, jest prawdopodobne—ale nie rozstrzygające—że oba składniki są takie same. Dalsze analizy mogą być potrzebne do potwierdzenia tej hipotezy. Jeśli znane i nieznane mają różne czasy retencji, to nie jest prawdopodobne, że te dwa składniki są identyczne.
inne odmiany chromatografii wykorzystują działanie kapilarne—przyciąganie cieczy do stałej powierzchni—w celu przeciągnięcia rozpuszczalnika przez Stały materiał. Nieformalną wersję chromatografii papierowej można zaobserwować, gdy strona pisana atramentem ma kontakt z wodą lub innymi cieczami. Atrament działa i kilka kolorów jest oddzielonych w pasmie atramentu.
poniższy diagram (Rysunek 2) przedstawia wynik eksperymentu z chromatografii cienkowarstwowej. Dwie czarne plamy atramentu na powierzchni ciała stałego przeszły przez nie rozpuszczalnik. Rozpuszczalnikiem jest woda lub inna ciecz, która jest ciągnięta przez fazę stacjonarną przez działanie kapilarne. W tym przykładzie jako fazę stacjonarną stosuje się kawałek tworzywa sztucznego pokryty sproszkowaną substancją stałą. Alternatywnie jako fazę stacjonarną można użyć kawałka papieru filtracyjnego. Eksperyment pokazuje, że czarny atrament jest mieszaniną zawierającą kilka różnych barwnych substancji. Każdy składnik ma nieco inną rozpuszczalność w fazie ruchomej, więc gdy ciecz jest ciągnięta przez fazę stacjonarną, każdy składnik porusza się z inną szybkością, oddzielając atrament na plamy o różnych kolorach.

Rysunek 2: chromatografia cienkowarstwowa czarnego atramentu po opracowaniu. Ten obraz pokazuje wspólny problem, w którym plamy rozszerzają się, gdy poruszają się po płycie, ostatecznie łącząc się w górnej części płyty.
w tym eksperymencie podobne zasady stosuje się do oddzielania kilku kationów metali za pomocą procedury chromatografii papierowej. Jony metali – \(\ce{Ag^{+}}\), \(\ce{Fe^{3+}}\),\(\ce{Co^{2+}}\), \(\ce {cu^{2+}}\) i \(\ce{Hg^{2+}}\) – mają różną rozpuszczalność w fazie mobilnej-wodnej \(\ce{HCl}\) z alkoholem etylowym i butylowym – i poruszają się w różnym tempie w górę papieru. Różne rozpuszczalności jonów metali są prawdopodobnie spowodowane tworzeniem się różnych związków z Jonem chlorkowym i ich różną zdolnością do rozpuszczania się w rozpuszczalniku organicznym.
poniżej znajduje się schemat przedstawiający sposób przygotowania pracy. Roztwory standardowe zawierające każdy z tych jonów zostaną zauważone na papierze za pomocą rurki kapilarnej, wraz z roztworem standardowym zawierającym wszystkie pięć jonów. Nieznany zostanie również zauważony na papierze. Po przygotowaniu papieru zostanie on opracowany przez umieszczenie papieru w eluencie. Po 75-90 minutach papier jest wizualizowany przez zwilżenie go wodnym roztworem zawierającym jodek potasu, \(\ce{KI}\) i żelazocyjanek potasu, \(\ce{K4}\). Unikalny kolor obserwowany dla każdego jonu jest wytwarzany w reakcji chemicznej z roztworem wizualizacji. Jest to jeden z użytecznych sposobów identyfikacji, które jony są obecne w nieznanej mieszaninie.
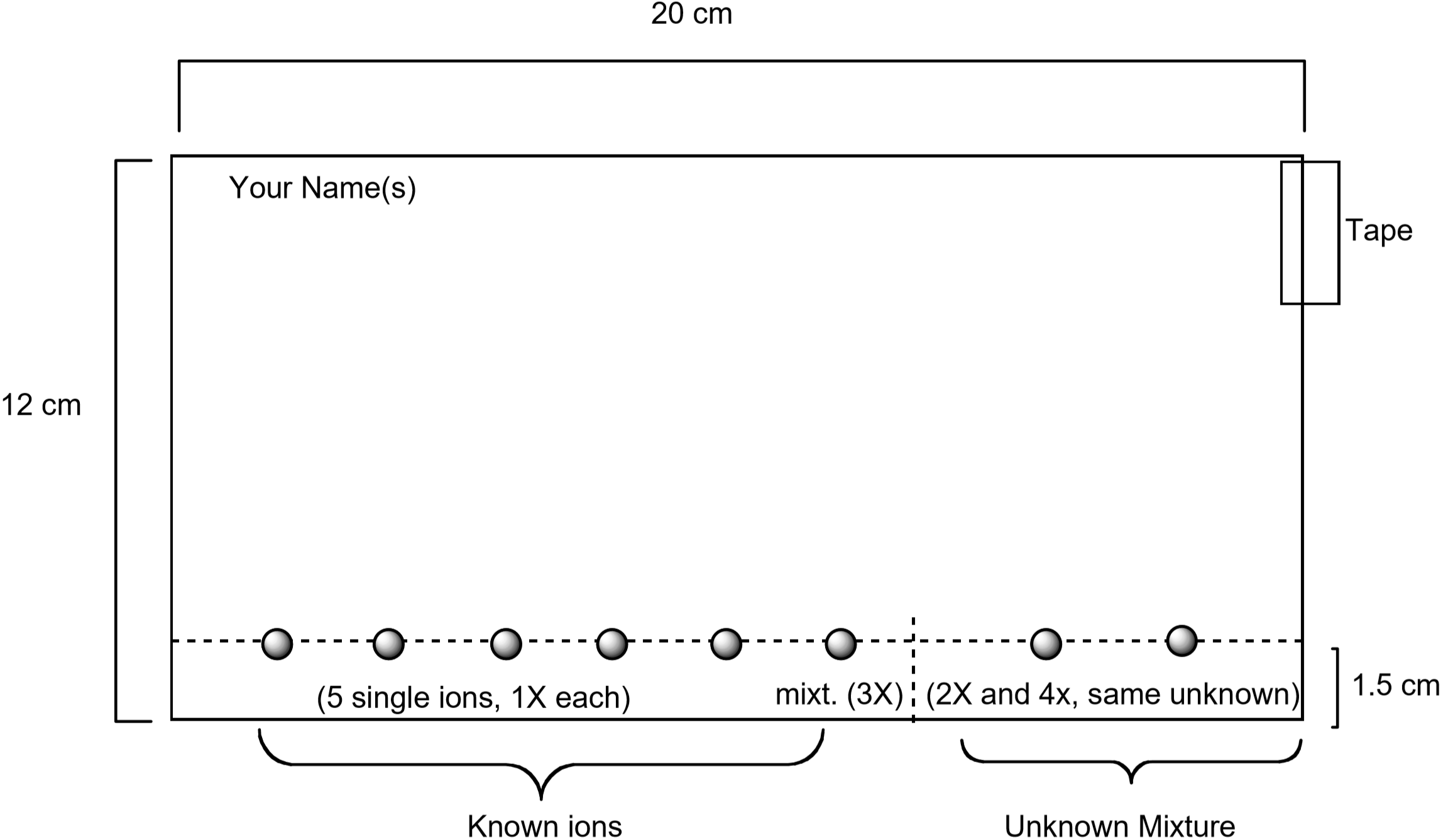
Rysunek 3: Diagram przedstawiający sposób przygotowania papieru do eksperymentu chromatograficznego
odległość, jaką jon porusza się w górę papieru, może być również wykorzystana do identyfikacji jonu. Ponieważ jednak uczniowie będą rozwijać swoje eksperymenty chromatograficzne przez różne ilości czasu i w nieco innych warunkach, każdy uczeń będzie miał nieco inną zmierzoną odległość dla danego jonu. Stosunek odległości poruszanej przez Jon (\(D\)) do odległości poruszanej przez rozpuszczalnik (\(F\), przód rozpuszczalnika) jest charakterystyczny i powinien być prawie taki sam dla wszystkich uczniów. Współczynnik ten nazywany jest Rf, lub „współczynnik retencji.”
\
procedura
materiały i sprzęt
chemikalia: 0.1 m roztworów wodnych \(\ce{AgNO3}\), \(\ce{Hg(NO3)2}\), \(\ce{Fe(NO3)3}\), \(\ce{co(NO3)2}\) i \(\ce{cu(NO3)2}\), każdy z dedykowanymi rurkami kapilarnymi; roztwór eluujący (wodny \(\ce{HCl}\) z alkoholem etylowym i butylowym); roztwór wizualizujący (wodny roztwór \(\ce{KI}\) i \(\CE{K4}\)).
wyposażenie: czysty kawałek papieru chromatograficznego; jednorazowe rękawice lateksowe (rękawice nitrylowe są dostępne w magazynie dla osób z alergią na Lateks); zlewka 600 mL; folia; kleszcze lub szczypce do zlewek; linijka*
* przedmioty uzyskane z magazynu
bezpieczeństwo
unikaj kontaktu z roztworami jonów metali, rozpuszczalnikiem eluującym i roztworem wizualizującym. Noś jednorazowe rękawiczki, aby dotknąć chromatogramu po wystąpieniu wymywania i przez resztę eksperymentu. Nie wdychać oparów eluującego się rozpuszczalnika ani roztworu wizualizującego. Umieścić mokry chromatogram na ręczniku papierowym, a nie bezpośrednio na stole laboratoryjnym. Używaj rozwiązania wizualizacyjnego tylko w przestrzeni zapewnionej przez instruktora. Rękawice i chromatogram należy wyrzucić do określonego pojemnika na odpady po zakończeniu eksperymentu. Dokładnie umyć ręce po kontakcie ze wszystkimi roztworami w tym laboratorium.
przygotowanie papieru do chromatografii
- Każda para uczniów powinna otrzymać kawałek papieru filtracyjnego o wymiarach pokazanych na rysunku 3. Upewnij się, że papier jest czysty i bez łez i fałd. Użyj ołówka-nie pióra-i linijki, aby narysować linię na papierze w odległości jednego cm od długiej krawędzi papieru. Zauważysz roztwory jonów metali na tej linii. Wpisz swoje imię ołówkiem w lewym górnym rogu papieru.
- Ćwicz plamienie roztworów wody i / lub jonów na pasku bibuły filtracyjnej, aby wiedzieć, jak tworzyć plamy o odpowiedniej wielkości. Użyj szklanych rurek kapilarnych, aby dostrzec jony na papierze. Roztwór nanosi się przez lekkie i szybkie dotknięcie rurki kapilarnej zawierającej roztwór do linii narysowanej na papierze. Plamy powinny mieć średnicę 5-8 mm. Plamy większe niż ta będą nadmiernie rozprzestrzeniać się podczas eksperymentu i utrudniać analizę.
- znane 0.1 m roztworów wodnych \(\ce{AgNO3}\), \(\ce{Hg(NO3) 2}\), \(\ce{Fe(NO3) 3}\), \(\ce{co(NO3) 2}\) i \(\ce{cu(NO3) 2}\) są dostarczane w probówkach, z których każda zawiera dwie lub trzy probówki kapilarne. Zaczynając od lewej strony, zaznacz ołówkiem tożsamość jonu pod każdym punktem, a następnie dokładnie umieść każdy znany jon na linii. Należy uważać, aby nie zanieczyścić rurki kapilarnej innymi jonami i wymienić rurki kapilarne z powrotem do właściwej probówki. Probówka zawierająca znaną mieszaninę wszystkich pięciu jonów jest również wyposażona w zestaw rurek kapilarnych. Spot tej mieszanki na linii, jak również. Ponieważ ten roztwór jest bardziej rozcieńczony niż znane roztwory jednojonowe, zastosuj znaną mieszaninę trzy razy, pozwalając plamce wyschnąć między każdym zastosowaniem. Lampa grzewcza pomoże szybciej wysuszyć miejsce.
- kilka niewiadomych znajduje się również w probówkach, wraz z probówkami kapilarnymi. Instruktor powie Ci, który nieznany powinien być użyty. Niewiadome zawierają od jednego do czterech kationów i są bardziej rozcieńczone niż znane roztwory jednojonowe. Nieznany będzie również musiał być stosowany dwa i cztery razy w dwóch próbach, pozwalając na wyschnięcie plamki między każdym zastosowaniem. W przypadku błędu, należy zauważyć nieznane w dwóch miejscach wzdłuż linii tak, że dwa badania są dostępne do analizy.
rozwijając papier do chromatografii
- umieść kawałek taśmy wzdłuż prawej górnej krawędzi, jak pokazano na fig.3. Następnie uformuj cylinder, łącząc dwie krótkie krawędzie papieru z taśmą. Upewnij się, że krawędzie nie dotykają się. Papier powinien wyglądać podobnie do rysunku 4.
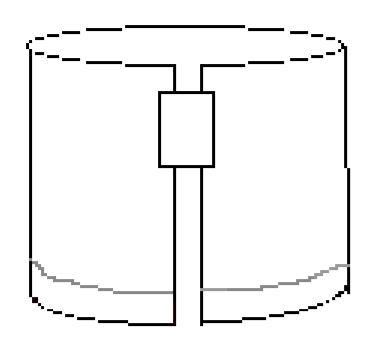
Rysunek 4: złożony papier powinien wyglądać tak przed opracowaniem eksperymentu.
- uzyskać 15 mL roztworu eluującego. Ostrożnie wlać część tego rozpuszczalnika do zlewki o pojemności 600 mL i ostrożnie obracać przez sekundę lub dwie. Uwaga: nie wdychać oparów z tego roztworu! Upewnij się, że poziom cieczy będzie poniżej linii punktowej na papierze po umieszczeniu papieru w komorze rozwijającej.
- Umieść papierowy cylinder w zlewce z zaznaczoną krawędzią w dół. Plamy powinny znajdować się powyżej poziomu rozpuszczalnika. Papier nie powinien dotykać boków zlewki. Starannie przykryj zlewkę folią i umieść ją w kapturze na 75-90 minut. Rozpuszczalnik powinien zacząć przesuwać się w górę papieru. Gdy zlewka jest zakryta, upewnij się, że jest na poziomie i nie przeszkadzaj jej w okresie rozwoju. Twój instruktor może mieć zadanie do pracy podczas oczekiwania.
Wizualizacja i analiza papieru
- po zakończeniu okresu rozwoju załóż jednorazowe rękawiczki i wyjmij papier z zlewki. Rękawice lateksowe są dostępne w laboratorium i rękawice nitrylowe są dostępne w magazynie dla osób z alergią na Lateks. Niech rozpuszczalnik kapie z powrotem do zlewki, a następnie wyjąć taśmę. Połóż papier do chromatografii na ręczniku papierowym i natychmiast zaznacz przód rozpuszczalnika ołówkiem. Wlać zużyty rozpuszczalnik eluujący do dostarczonego pojemnika na odpady. Wysuszyć papier pod lampą cieplną w masce. Uwaga: Nie wdychaj oparów! Uważaj, aby nie spalić papieru pod lampą.
- gdy papier wyschnie, zanieś go do stacji wizualizacji na ręczniku papierowym. Krótko zanurz papier w roztworze wizualizacyjnym znajdującym się w płytkim naczyniu w dygestorium. Natychmiast wyjmij papier z roztworu i pozwól, aby nadmiar kapał na stacji. Umieść mokry papier na suchym ręczniku papierowym i osusz go natychmiast pod lampą cieplną, a następnie zanieś do ławki w celu analizy.
- Znajdź najpierw każdy znany pojedynczy Jon i zapisz kolory, które obserwujesz. Niektóre plamy mogą z czasem blaknąć, więc zapisz Kolory, gdy papier jest jeszcze mokry. Zmierz odległość każdego poruszającego się miejsca, D, za pomocą linijki. Środek do środka każdego miejsca. Zapisz swoje dane w tabeli danych.
- Zmierz odległość od przodu rozpuszczalnika, F. wartość F powinna być w przybliżeniu taka sama na całym papierze. Użyj tych wartości do obliczenia Rf dla każdego jonu. Dokonać pomiarów w sposób pokazany na rysunku 5. Każdy obserwowany punkt ma własną wartość Rf. Zapisz wyniki w tabeli danych.
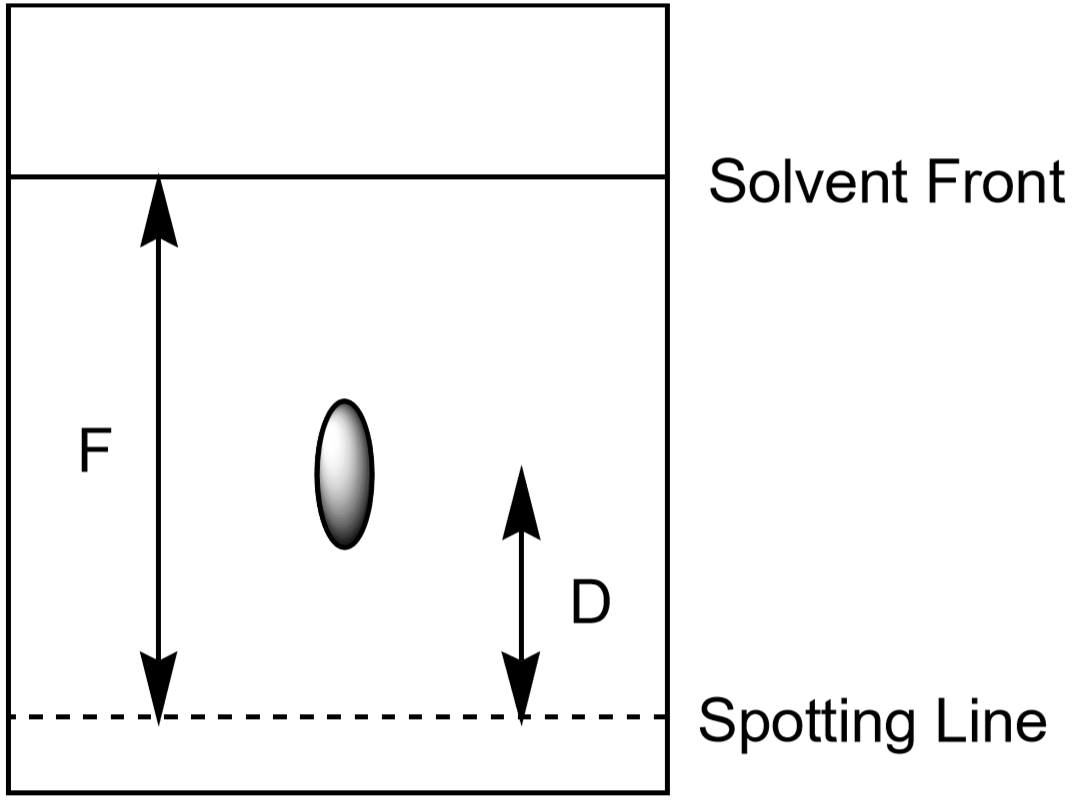
Rysunek 5: Pomiar odległości stosowanych do obliczania Rf dla punktu.
- w pasie zawierającym mieszaninę znajdź każdy Jon i zapisz odległość poruszaną przez każdy jon. Oblicz Rf dla każdego jonu w tym pasie. Wartości te powinny być ściśle zgodne z wartościami obserwowanymi u jednojonów.
- w pasie zawierającym niewiadome, zlokalizuj środek każdego obserwowanego punktu i zapisz jego odległość oraz Oblicz wartości Rf. Użyj pasa, który ma najczystsze miejsca. Wartości koloru i Rf dla nieznanych plam powinny ściśle pasować do niektórych znanych jonów. Powinieneś teraz być w stanie określić, które jony lub jony znajdują się w nieznanym. Zapisz swoje dane w odpowiedniej tabeli.
- zrób szkic swojego chromatogramu w miejscu podanym w formularzu raportu laboratoryjnego, pamiętając o położeniu oraz przybliżonym rozmiarze i kształcie każdego miejsca na papierze. Papier należy wyrzucić do wyznaczonego pojemnika na odpady.
Oczyszczanie
Umieść papier do chromatografii i zużyte rękawice w dostarczonym pojemniku na odpady. Zużyty roztwór eluujący powinien już być umieszczony w innym pojemniku na odpady. Należy pamiętać, że dwa różne pojemniki na odpady są przewidziane dla tego eksperymentu, więc należy przeczytać etykiety, dzięki czemu można użyć właściwego! Przed opuszczeniem laboratorium należy dokładnie umyć ręce.
zadanie przed laboratorium: chromatografia papierowa
- mieszaninę dwuskładnikową analizuje się metodą chromatografii papierowej. Składnik A jest bardziej rozpuszczalny w fazie ruchomej niż składnik B. otrzymuje się następujący wynik. Oblicz Rf dla każdego komponentu i oznacz tożsamość każdego miejsca.
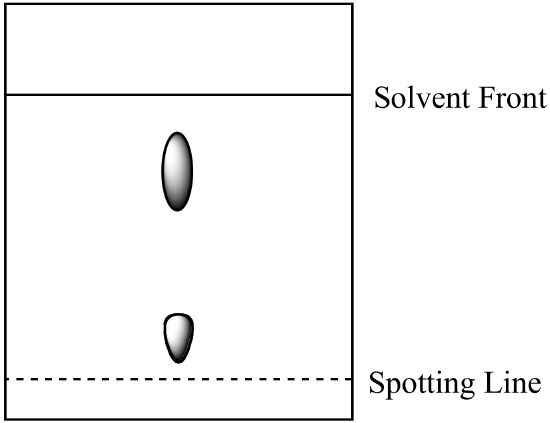
- mieszaninę z pytania 1 (powyżej) analizuje się metodą chromatografii kolumnowej przy użyciu tej samej fazy ruchomej i fazy stacjonarnej żelu krzemionkowego. Który komponent ma krótszy czas retencji? Wyjaśnij swoją odpowiedź. (Załóżmy, że ten sam rodzaj sił wiążących między składnikami a fazą stacjonarną jest obecny zarówno w chromatografii papierowej, jak i chromatografii kolumnowej.)
- nieznaną próbkę cieczy analizuje się przy użyciu chromatografii papierowej z użyciem rozpuszczalnika X jako fazy ruchomej. Po rozwinięciu i wizualizacji płytki obserwuje się jeden punkt. Ta sama nieznana substancja jest ponownie analizowana przy użyciu rozpuszczalnika Y jako fazy ruchomej. Tym razem po rozwinięciu i wizualizacji płytki obserwuje się trzy plamy.
- czy nieznana próbka to czysta substancja czy mieszanina? Wyjaśnij swoją odpowiedź, w tym możliwy powód różnych obserwacji w dwóch eksperymentach.
Lab Report for Paper Chromatography
Data, Observations, Calculations and Analysis Known Ions
Known Ions
|
Ion |
Spot Color (Stained) |
D (Single- Ion) |
F (Single- Ion) |
Rf |
D (Ion Mixt.) |
F (Ion Mixt.) |
Rf |
|---|---|---|---|---|---|---|---|
|
\(\ce{Ag^{+}}\) |
|||||||
|
\(\ce{Co^{2+}}\) |
|||||||
|
\(\ce{Cu^{2+}}\) |
|||||||
|
\(\ce{Fe^{3+}}\) |
|||||||
|
\(\ce{Hg^{2+}}\) |
Unknown ID Code _________________
Unknowns
|
Spot Number (from lowest Rr) |
Spot Color (Stained) |
D (Unknown) |
F (Unknown) |
Rf |
Identity of Spot |
|---|---|---|---|---|---|
- Sketch of Chromatogram:
Summary:
| nieznany kod identyfikacyjny | zidentyfikowane jony |
|---|---|
pytania i wnioski
- jakie kryteria zostały zastosowane do identyfikacji jonów znalezionych w nieznanym? Wyjaśnij swoją odpowiedź w co najmniej trzech zdaniach. Obejmują wszelkie trudności w identyfikacji jakichkolwiek jonów.
- gdyby eksperyment trwał tylko 30 minut, jaki byłby prawdopodobny wynik? Czy pojawią się problemy z identyfikacją nieznanego?
- gdyby plamy \(\ce{Co^{2+}}\) i \(\ce{Cu^{2+}}\) były tego samego koloru, czy identyfikacja nieznanego byłaby trudniejsza? Wyjaśnij swoją odpowiedź.