Video \(\PageIndex{1}\): Krótkie wprowadzenie do geniuszu Mendelejewa.
gdy pierwsi chemicy pracowali nad oczyszczaniem rud i odkryli więcej pierwiastków, zdali sobie sprawę, że różne pierwiastki można grupować według podobnych zachowań chemicznych. Jedna z takich grup obejmuje lit (Li), sód (Na) i potas (K): Wszystkie te pierwiastki są błyszczące, dobrze przewodzą ciepło i elektryczność i mają podobne właściwości chemiczne. Druga grupa obejmuje wapń (Ca), stront (Sr) i bar (Ba), które również są błyszczącymi, dobrymi przewodnikami ciepła i elektryczności i mają wspólne właściwości chemiczne. Jednak szczególne właściwości tych dwóch grup są wyraźnie różne od siebie. Na przykład: Li, na I K są znacznie bardziej reaktywne niż Ca, SR i Ba; Li, Na I K tworzą związki z tlenem w stosunku dwóch ich atomów do jednego atomu tlenu, podczas gdy Ca, SR i Ba tworzą związki z jednym z ich atomów do jednego atomu tlenu. Fluor (F), chlor (Cl), brom (Br) i jod (I) również wykazują podobne właściwości do siebie, ale te właściwości są drastycznie różne od właściwości któregokolwiek z powyższych pierwiastków.
Dimitri Mendelejew w Rosji (1869) i Lothar Meyer w Niemczech (1870) niezależnie uznali, że istnieje okresowa zależność między właściwościami znanych w tym czasie pierwiastków. Obie opublikowane tabele z pierwiastkami ułożonymi według rosnącej masy atomowej. Ale Mendelejew poszedł o krok dalej niż Meyer: użył swojej tabeli, aby przewidzieć istnienie pierwiastków, które miałyby właściwości podobne do aluminium i krzemu, ale były jeszcze nieznane. Odkrycie galu (1875) i germanu (1886) zapewniło wielkie wsparcie dla prac Mendelejewa. Chociaż Mendelejew i Meyer mieli długi spór o pierwszeństwo, wkład Mendelejewa w rozwój układu okresowego jest teraz bardziej znany (rysunek \(\PageIndex{1}\)).
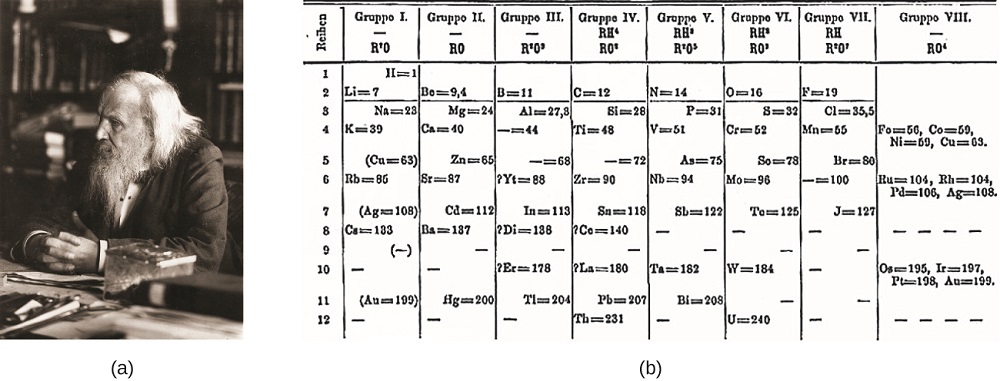
Figure \(\PageIndex{1}\): (a) Dimitri Mendelejew jest powszechnie uznawany za stworzenie (b) pierwszy układ okresowy pierwiastków. (źródło a: modyfikacja pracy Serge ’ a Lachinova; źródło B: modyfikacja pracy autorstwa „Den fjättrade ankan”/Wikimedia Commons)
Video \(\PageIndex{2}\): Wprowadzenie do organizacji układu okresowego na okresy i grupy. Ta organizacja będzie ważna, ponieważ nadal będziemy opierać się na zasadach chemii.
w XX wieku stało się jasne, że relacje okresowe dotyczą liczb atomowych, a nie mas atomowych. Współczesne twierdzenie o tej relacji, prawo okresowości, jest następujące: własności pierwiastków są okresowymi funkcjami ich liczb atomowych. Nowoczesny układ okresowy układa pierwiastki w rosnącej kolejności ich liczby atomowej i grupuje Atomy o podobnych właściwościach w tej samej pionowej kolumnie (rysunek \(\PageIndex{2}\)). Każde pole reprezentuje element i zawiera jego liczbę atomową, symbol, średnią masę atomową i (czasami) nazwę. Elementy są rozmieszczone w siedmiu poziomych rzędach, zwanych okresami lub szeregami, i 18 pionowych kolumnach, zwanych grupami. Grupy są oznaczone u góry każdej kolumny. W Stanach Zjednoczonych etykiety tradycyjnie były cyframi z dużymi literami. Jednak IUPAC zaleca stosowanie numerów od 1 do 18, a etykiety te są bardziej powszechne. Aby tabela zmieściła się na jednej stronie, części dwóch wierszy, w sumie 14 kolumn, są zwykle pisane poniżej głównej części tabeli.

rysunek \(\PageIndex{2}\): pierwiastki w układzie okresowym są uporządkowane według ich właściwości.
wiele pierwiastków różni się znacznie w swoich właściwościach chemicznych i fizycznych, ale niektóre pierwiastki są podobne w swoich zachowaniach. Na przykład, wiele elementów wydaje się błyszczące, są ciągliwe (mogą być zdeformowane bez zerwania) i sferoidalne (mogą być wciągane do drutów) oraz dobrze przewodzą ciepło i elektryczność. Inne elementy nie są błyszczące, ciągliwe lub sferoidalne i są słabymi przewodnikami ciepła i elektryczności. Możemy posortować elementy na duże klasy o wspólnych właściwościach: metale (elementy, które są błyszczące, ciągliwe, dobre Przewodniki ciepła i elektryczności-cieniowane na Żółto); niemetale (elementy, które wydają się matowe, słabe Przewodniki ciepła i elektryczności-cieniowane na Zielono); i metaloidy (pierwiastki, które przewodzą ciepło i elektryczność umiarkowanie dobrze i posiadają pewne właściwości metali, a niektóre właściwości niemetali-cieniowany fioletowy).
elementy można również podzielić na elementy grupy głównej (lub elementy reprezentatywne) w kolumnach oznaczonych 1, 2 i 13-18; metale przejściowe w kolumnach oznaczonych 3-12; i metale przejściowe wewnętrzne w dwóch rzędach na dole tabeli (elementy górnego rzędu nazywane są lantanowcami, a elementy dolnego rzędu to aktynowce; rysunek \(\PageIndex{3}\)). Pierwiastki można podzielić dalej przez bardziej specyficzne właściwości, takie jak skład związków, które tworzą. Na przykład pierwiastki z grupy 1 (Pierwsza kolumna) tworzą związki, które składają się z jednego atomu pierwiastka i jednego atomu wodoru. Te pierwiastki (z wyjątkiem wodoru) są znane jako metale alkaliczne i wszystkie mają podobne właściwości chemiczne. Pierwiastki z grupy 2 (Druga kolumna) tworzą związki składające się z jednego atomu pierwiastka i dwóch atomów wodoru: są to tzw. metale ziem alkalicznych, o podobnych właściwościach wśród członków tej grupy. Inne grupy o specyficznych nazwach to pnictogeny (Grupa 15), chalkogeny (Grupa 16), halogeny (Grupa 17) i gazy szlachetne (Grupa 18, znana również jako gazy obojętne). Grupy mogą być również określane przez pierwszy element grupy: na przykład chalkogeny można nazwać grupą tlenu lub rodziną tlenu. Wodór jest unikalnym, niemetalicznym pierwiastkiem o właściwościach podobnych zarówno do pierwiastków grupy 1, jak i grupy 17. Z tego powodu wodór może być pokazany na szczycie obu grup lub sam w sobie.
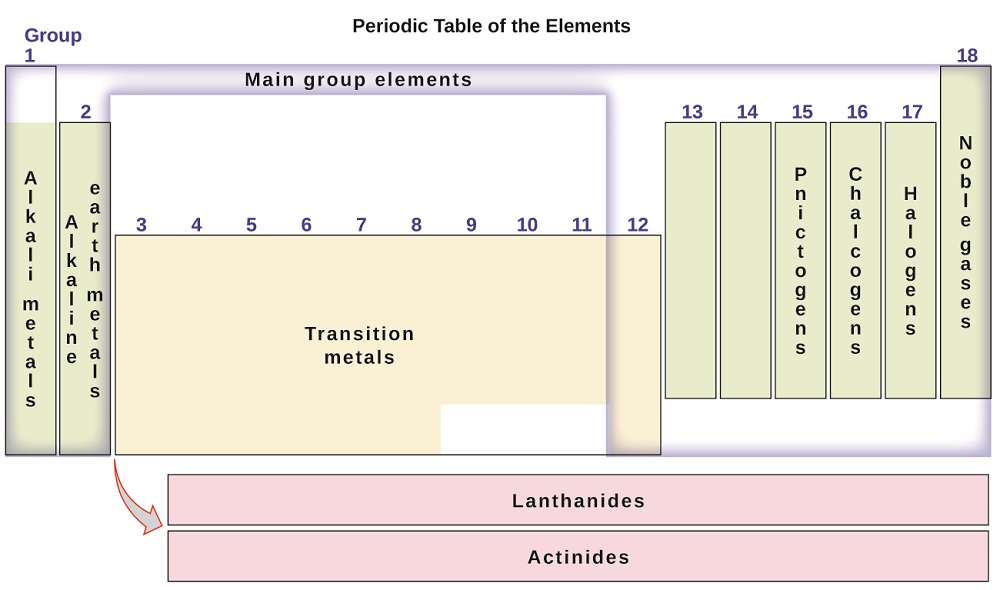
rysunek \(\PageIndex{3}\): układ okresowy porządkuje pierwiastki o podobnych właściwościach w grupy.
przykład \(\PageIndex{1}\): Nazywanie grup elementów
Atomy każdego z poniższych elementów są niezbędne do życia. Podaj nazwę grupy dla następujących elementów:
- chlorine
- calcium
- sodium
- sulfur
Solution
The family names are as follows:
- halogen
- alkaline earth metal
- alkali metal
- chalcogen
Exercise \(\PageIndex{1}\)
Give the group name for each of the following elements:
- krypton
- selen
- bar
- lit
odpowiedź a
gaz szlachetny
odpowiedź B
chalkogen
odpowiedź c
Metal ziem alkalicznych
odpowiedź d
metal alkaliczny
badając układ okresowy, mogłeś zauważyć coś o masach atomowych niektórych pierwiastków. Pierwiastek 43 (TechNet), pierwiastek 61 (promet) i większość pierwiastków o liczbie atomowej 84 (polon) i wyższej mają masę atomową podaną w nawiasach kwadratowych. Odbywa się to dla pierwiastków, które składają się w całości z niestabilnych, radioaktywnych izotopów (dowiesz się więcej o radioaktywności w rozdziale Chemia jądrowa). Średnia masa atomowa nie może być ustalona dla tych pierwiastków, ponieważ ich radioizotopy mogą się znacznie różnić względną obfitością, w zależności od źródła, lub mogą nawet nie istnieć w przyrodzie. Liczba w nawiasach kwadratowych jest liczbą mas atomowych (i przybliżoną masą atomową) najbardziej stabilnego izotopu tego pierwiastka.
podsumowanie
Video \(\PageIndex{3}\): podsumowanie odkryć i właściwości układu okresowego.
odkrycie okresowego powtarzania się podobnych właściwości wśród pierwiastków doprowadziło do sformułowania układu okresowego, w którym pierwiastki są ułożone w kolejności rosnącej liczby atomowej w rzędach znanych jako okresy i kolumny znane jako grupy. Pierwiastki z tej samej grupy układu okresowego mają podobne właściwości chemiczne. Elementy mogą być klasyfikowane jako metale, metaloidy i niemetale lub jako elementy głównej grupy, metale przejściowe i metale przejściowe wewnętrzne. Grupy są ponumerowane od 1 do 18 od lewej do prawej. Pierwiastki z grupy 1 są znane jako metale alkaliczne; te z grupy 2 to metale ziem alkalicznych; te z 15 to pnictogeny; te z 16 to chalkogeny; te z 17 to halogeny; a te z 18 to gazy szlachetne.