cele nauki
pod koniec tej sekcji będziesz w stanie:
- wyjaśnić zależności między wielkościami mikroskopowymi i makroskopowymi w gazie
- rozwiązywać problemy związane z mieszaninami gazów
- rozwiązywać problemy związane z odległością i czasem pomiędzy zderzeniami cząsteczek gazu
/li >
zbadaliśmy ciśnienie i temperaturę w oparciu o ich makroskopowe definicje. Ciśnienie jest siłą podzieloną przez obszar, na który wywierana jest siła, a temperaturę mierzy się termometrem. Możemy lepiej zrozumieć ciśnienie i temperaturę dzięki kinetycznej teorii gazów, teorii, która odnosi właściwości makroskopowe gazów do ruchu cząsteczek, z których się składają. Po pierwsze, robimy dwa założenia o cząsteczkach w gazie idealnym.
- istnieje bardzo duża liczba n cząsteczek, wszystkie identyczne i każda o masie m.
- cząsteczki są zgodne z prawami Newtona i są w ciągłym ruchu, który jest przypadkowy i izotropowy, czyli taki sam we wszystkich kierunkach.
aby uzyskać prawo gazu idealnego i związek między mikroskopijnymi wielkościami, takimi jak energia typowej cząsteczki, a wielkościami makroskopowymi, takimi jak temperatura, analizujemy próbkę gazu idealnego w sztywnym pojemniku, o którym Zakładamy dwa dalsze założenia:
- cząsteczki są znacznie mniejsze niż średnia odległość między nimi, więc ich całkowita objętość jest znacznie mniejsza niż ich pojemnik (który ma objętość V). Innymi słowy, bierzemy stałą Van der Waalsa b, objętość mola cząsteczek gazu, jest nieistotna w porównaniu z objętością mola gazu w zbiorniku.
- cząsteczki tworzą idealnie elastyczne zderzenia ze ściankami pojemnika i ze sobą. Inne siły na nich, w tym grawitacja i przyciąganie reprezentowane przez stałą Van der Waalsa a, są znikome (co jest konieczne do założenia Izotropii).
zderzenia między cząsteczkami nie występują w pochodnej prawa gazu idealnego. Nie przeszkadzają one również w wyprowadzaniu, ponieważ zderzenia między cząsteczkami poruszającymi się z losowymi prędkościami dają nowe losowe prędkości. Ponadto, jeśli prędkości cząsteczek gazu w pojemniku początkowo nie są przypadkowe i izotropowe, zderzenia molekularne są tym, co czyni je przypadkowymi i izotropowymi.
podejmujemy kolejne założenia, które upraszczają obliczenia, ale nie wpływają na wynik. Po pierwsze, pozwalamy, aby pojemnik był prostokątnym pudełkiem. Po drugie, zaczynamy od rozważenia gazów jednoatomowych, tych, których cząsteczki składają się z pojedynczych atomów, takich jak hel. Następnie możemy założyć, że atomy nie mają energii poza translacyjną energią kinetyczną; na przykład nie mają energii obrotowej ani wibracyjnej. (Później omawiamy zasadność tego założenia dla rzeczywistych gazów jednoatomowych i rezygnujemy z niego, aby rozważyć gazy dwuatomowe i wielatomowe.)
rysunek \(\PageIndex{1}\) pokazuje zderzenie cząsteczki gazu ze ścianą pojemnika, tak że wywiera ona na ścianę siłę (zgodnie z trzecim prawem Newtona). Kolizje te są źródłem ciśnienia w gazie. Wraz ze wzrostem liczby cząsteczek wzrasta liczba zderzeń, a tym samym ciśnienie. Podobnie, jeśli średnia prędkość cząsteczek jest wyższa, ciśnienie gazu jest wyższe.
w próbce gazu w pojemniku przypadkowość ruchu molekularnego powoduje wahania liczby zderzeń cząsteczek z dowolną częścią ściany w danym czasie. Ponieważ jednak ogromna liczba cząsteczek zderza się ze ścianą w krótkim czasie, liczba zderzeń w skalach czasu i przestrzeni, którą mierzymy, waha się tylko o niewielką, Zwykle niezauważalną część od średniej. Możemy porównać tę sytuację Do Kasyna, w którym wyniki zakładów są losowe, a stawki kasyna zmieniają się w zależności od minuty i godziny. Jednak w dłuższych okresach, takich jak rok, transakcje w kasynie są bardzo zbliżone do średnich oczekiwanych z kursów. Zbiornik z gazem ma znacznie więcej cząsteczek niż kasyno ma graczy w ciągu roku, a cząsteczki powodują znacznie więcej kolizji w ciągu sekundy niż kasyno ma zakłady.
obliczenie średniej siły wywieranej przez cząsteczki na ścianki pudełka prowadzi nas do prawa gazu idealnego i do związku między temperaturą a molekularną energią kinetyczną. (W rzeczywistości weźmiemy dwie średnie: jedną w czasie, aby uzyskać średnią siłę wywieraną przez jedną cząsteczkę o określonej prędkości, a następnie kolejną średnią dla cząsteczek o różnych prędkościach.) Podejście to zostało opracowane przez Daniela Bernoulliego (1700-1782), który jest najbardziej znany w fizyce ze swoich prac nad przepływem płynów (hydrodynamika). Co ciekawe, Bernoulli wykonał tę pracę, zanim Dalton ustalił pogląd na materię jako składającą się z atomów.
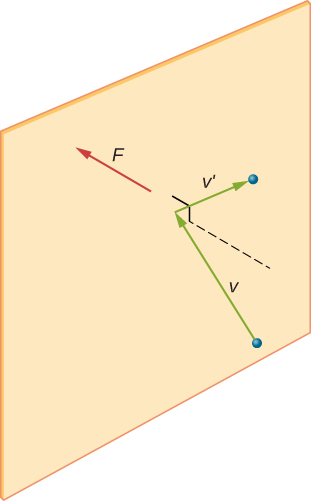
rysunek \(\PageIndex{2}\) pokazuje pojemnik pełen gazu i rozszerzony widok sprężystego zderzenia cząsteczki gazu ze ścianą pojemnika, podzieloną na części składowe. Założyliśmy, że cząsteczka jest mała w porównaniu z separacją cząsteczek w gazie i że jej oddziaływanie z innymi cząsteczkami można zignorować. W tych warunkach eksperymentalnie obowiązuje prawo gazu idealnego. Ponieważ założyliśmy również, że ściana jest sztywna, a cząstki są punktami, zderzenie jest sprężyste(zachowując energię-nie ma miejsca na energię kinetyczną cząstki). Dlatego energia kinetyczna cząsteczki pozostaje stała, a zatem jej prędkość i wielkość jej pędu również pozostają stałe. Założenie to nie zawsze jest prawidłowe, ale wyniki w pozostałej części tego modułu są również uzyskiwane w modelach, które pozwalają cząsteczkom wymieniać energię i pęd ze ścianą.
Jeśli prędkość cząsteczki zmienia się w kierunku x, jej pęd zmienia się z \(- m_x\) na \(+mv_x\). Tak więc jego zmiana pędu wynosi \(\Delta MV = + mv_x – (- mv_x) = 2mv_x\). Zgodnie z twierdzeniem impuls-momentum podanym w rozdziale o pędzie liniowym i zderzeniach, siła wywierana na i cząsteczkę, gdzie oznaczam cząsteczki od 1 do N, jest dana przez \
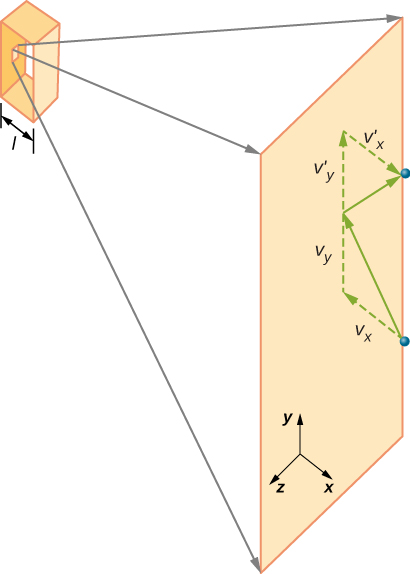
(w tym równaniu p oznacza pęd, a nie Ciśnienie.) Nie ma siły między ścianą a cząsteczką, chyba że cząsteczka dotyka ściany. W krótkim czasie zderzenia siła między cząsteczką a ścianą jest stosunkowo duża, ale nie takiej siły szukamy. Szukamy średniej siły, więc bierzemy \(\Delta T\) jako średni czas pomiędzy zderzeniami danej cząsteczki z tą ścianą, czyli czas, w którym spodziewamy się znaleźć jedno zderzenie. Niech l oznacza długość pola w kierunku X. Następnie \(\Delta T\) to czas, jaki zajęłaby cząsteczka, aby przejść przez pole i z powrotem, odległość 2l, z prędkością \(v_x\). Tak więc \(\delta T = 2L / v_x\), a wyrażenie dla siły staje się
\
siła ta wynika z jednej cząsteczki. Aby znaleźć całkowitą siłę na ścianie, F, musimy dodać wkład wszystkich cząsteczek N:
\
teraz używamy definicji średniej, którą oznaczamy słupkiem, aby znaleźć siłę:
\
chcemy siły w kategoriach prędkości v, a nie x-składowej prędkości. Zauważ, że całkowita prędkość do kwadratu jest sumą kwadratów jej składników, więc
\
przy założeniu Izotropii trzy średnie po prawej stronie są równe, więc
\
podstawiając to do wyrażenia dla F daje
\
ciśnienie wynosi F/a, więc otrzymujemy
\ gdzie użyliśmy \(v = Al\) dla objętości. To daje ważny wynik
\
łącząc to równanie z \(pV = Nk_BT\) daje
\
możemy otrzymać średnią energię kinetyczną cząsteczki, \(\frac{1}{2}m\overline{v}^2\), z lewej strony równania dzieląc N i mnożąc przez 3/2.
Średnia energia kinetyczna na cząsteczkę
średnia energia kinetyczna cząsteczki jest wprost proporcjonalna do jej temperatury bezwzględnej:
\
równanie \(\overline{K} = \frac{3}{2} k_BT\) jest średnią energią kinetyczną na cząsteczkę. Zauważ w szczególności, że nic w tym równaniu nie zależy od masy cząsteczkowej (lub jakiejkolwiek innej własności) gazu, ciśnienia lub czegokolwiek poza temperaturą. Jeśli próbki helu i ksenonu, o bardzo różnych masach cząsteczkowych, są w tej samej temperaturze, cząsteczki mają taką samą średnią energię kinetyczną.
energia wewnętrzna układu termodynamicznego jest sumą energii mechanicznych wszystkich cząsteczek w nim zawartych. Możemy teraz podać równanie dla energii wewnętrznej jednoatomowego gazu idealnego. W takim gazie jedyną energią cząsteczek jest ich translacyjna energia kinetyczna. Dlatego oznaczając energię wewnętrzną za pomocą \(e_{int}\) mamy po prostu \(e_{int} = n\overline{K}\) lub
\
często chcielibyśmy użyć tego równania w kategoriach moli:
\
możemy rozwiązać \(\overline{K} = \frac{1}{2}m\overline{v}^2 = \frac{3}{2}k_BT\) dla typowej prędkości cząsteczki w Gazie idealnym pod względem temperatury, aby określić, co jest znane jako root-mean-square (RMS) prędkość cząsteczki.
RMS prędkość cząsteczki
root-mean-square (RMS) prędkość cząsteczki, lub pierwiastek kwadratowy średniej kwadratu prędkości \(\overline{V}^2\), jest
\
prędkość rms nie jest średnią ani najbardziej prawdopodobną prędkością cząsteczek, jak zobaczymy w rozkładzie prędkości cząsteczkowych, ale zapewnia łatwo obliczone oszacowanie prędkości cząsteczek, które jest związane z ich energią kinetyczną. Ponownie możemy zapisać to równanie w kategoriach stałej gazowej R i masy molowej M W kg / mol:
\
dygresujemy przez chwilę, aby odpowiedzieć na pytanie, które mogło ci się przydarzyć: kiedy zastosujemy model do atomów zamiast teoretycznych cząstek punktowych, czy obrotowa energia kinetyczna zmienia nasze wyniki? Aby odpowiedzieć na to pytanie, musimy odwołać się do mechaniki kwantowej. W mechanice kwantowej obrotowa energia kinetyczna nie może przyjmować żadnej wartości; jest ograniczona do dyskretnego zbioru wartości, a najmniejsza wartość jest odwrotnie proporcjonalna do bezwładności obrotowej. Bezwładność obrotowa atomu jest niewielka, ponieważ prawie cała jego masa znajduje się w jądrze, które zwykle ma promień mniejszy niż \(10^{-14} m\). Tak więc minimalna energia obrotowa atomu jest znacznie większa niż \(\frac{1}{2}k_BT\) dla dowolnej osiągalnej temperatury, a dostępna energia nie wystarczy, aby ATOM się obracał. Wrócimy do tego punktu, omawiając dwuatomowe i wielatomowe gazy w następnej sekcji.
przykład \(\PageIndex{1}\): Obliczanie energii kinetycznej i prędkości cząsteczki gazu
- jaka jest średnia energia kinetyczna cząsteczki gazu w \(20.0^oC\) (temperatura pokojowa)?
- Znajdź prędkość rms cząsteczki azotu (\(N_2\)) w tej temperaturze.
strategia
(a) znaną w równaniu dla średniej energii kinetycznej jest temperatura:
\
zanim podstawimy wartości do tego równania, musimy zamienić podaną temperaturę na kelwiny: \(t = (20.0 + 273) \, K = 293 \, k\). Możemy znaleźć prędkość rms cząsteczki azotu za pomocą równania
\
ale najpierw musimy znaleźć masę cząsteczki azotu. Otrzymując masę molową azotu \(N_2\) z układu okresowego, znajdujemy
\
roztwór
- sama temperatura jest wystarczająca do znalezienia średniej translacyjnej energii kinetycznej. Podstawienie temperatury do translacyjnego równania energii kinetycznej daje \
- Podstawienie tej masy i wartości dla \(k_B\) do równania dla \(v_{RMS}\) daje \
Znaczenie
zauważ, że średnia energia kinetyczna cząsteczki jest niezależna od rodzaju cząsteczki. Średnia translacyjna energia kinetyczna zależy tylko od temperatury bezwzględnej. Energia kinetyczna jest bardzo mała w porównaniu z energiami makroskopowymi, dzięki czemu nie czujemy, kiedy cząsteczka powietrza uderza w naszą skórę. Z drugiej strony, jest ona znacznie większa niż typowa różnica w grawitacyjnej energii potencjalnej, gdy cząsteczka przemieszcza się z, powiedzmy, góry na dół pomieszczenia, więc nasze zaniedbanie grawitacji jest uzasadnione w typowych sytuacjach rzeczywistych. Prędkość rms cząsteczki azotu jest zaskakująco duża. Te duże prędkości cząsteczkowe nie dają makroskopowego ruchu powietrza, ponieważ cząsteczki poruszają się we wszystkich kierunkach z równym prawdopodobieństwem. Średnia wolna ścieżka (odległość, jaką cząsteczka porusza się średnio między zderzeniami, omówiona nieco później w tym rozdziale) cząsteczek w powietrzu jest bardzo mała, więc cząsteczki poruszają się szybko, ale nie oddalają się zbytnio w sekundę. Wysoka wartość prędkości rms znajduje odzwierciedlenie w prędkości dźwięku, która wynosi około 340 m / s w temperaturze pokojowej. Im wyższa prędkość rms cząsteczek powietrza, tym szybsze wibracje dźwiękowe mogą być przenoszone przez powietrze. Prędkość dźwięku wzrasta wraz z temperaturą i jest większa w gazach o małych masach cząsteczkowych, takich jak hel (patrz rysunek \(\PageIndex{3}\)).
przykład \(\PageIndex{2}\): Obliczanie temperatury: prędkość ucieczki atomów Helu
aby uciec grawitacji Ziemi, obiekt w pobliżu szczytu atmosfery (na wysokości 100 km) musi oddalić się od Ziemi z prędkością 11,1 km / s. prędkość ta nazywa się prędkością ucieczki. W jakiej temperaturze atomy helu mają prędkość rms równą prędkości ucieczki?
strategia
Zidentyfikuj znane i nieznane równania i określ, których równań użyć do rozwiązania problemu.
rozwiązanie
- Zidentyfikuj znane: v to prędkość ucieczki, 11,1 km/S.
- Zidentyfikuj nieznane: musimy rozwiązać dla temperatury, T. musimy również rozwiązać dla masy m atomu helu.
- określ, które równania są potrzebne.
- aby uzyskać masę m atomu helu, możemy użyć informacji z układu okresowego: \
- aby rozwiązać dla temperatury T, możemy zmienić\, aby uzyskać \
- zastąpić znane wartości równaniami i rozwiązać dla niewiadomych, \ i \
Znaczenie
Ta temperatura jest znacznie wyższa niż temperatura atmosferyczna, która wynosi około 250 K (\(-25^oC\) lub \(-10^z\)) na dużej wysokości. Bardzo niewiele atomów helu pozostaje w atmosferze, ale wiele z nich było obecnych podczas formowania się atmosfery, a więcej zawsze powstaje w wyniku rozpadu promieniotwórczego (patrz rozdział o fizyce jądrowej). Powodem utraty atomów helu jest to, że niewielka liczba atomów helu ma prędkości wyższe niż prędkość ucieczki Ziemi nawet w normalnych temperaturach. Prędkość atomu helu zmienia się z jednego zderzenia na drugie, tak że w każdej chwili istnieje mała, ale niezerowa szansa, że prędkość atomu jest większa niż prędkość ucieczki. Szansa jest na tyle duża, że w ciągu życia Ziemi prawie wszystkie atomy helu znajdujące się w atmosferze osiągnęły prędkość ucieczki na dużych wysokościach i uciekły przed przyciąganiem grawitacyjnym Ziemi. Cięższe cząsteczki, takie jak tlen, azot i woda, mają mniejsze prędkości rms, więc jest znacznie mniej prawdopodobne, że któreś z nich będzie miało prędkości większe niż prędkość ucieczki. W rzeczywistości prawdopodobieństwo jest tak małe, że miliardy lat są wymagane do utraty znacznych ilości cięższych cząsteczek z atmosfery. Rysunek \(\PageIndex{4}\) pokazuje efekt braku atmosfery na Księżycu. Ponieważ przyciąganie grawitacyjne Księżyca jest znacznie słabsze, stracił on niemal całą swoją atmosferę. Atmosfery Ziemi i innych ciał są porównywane w ćwiczeniach tego rozdziału.

ćwiczenie \(\PageIndex{2}\)
jeśli weźmiemy pod uwagę bardzo mały obiekt, taki jak ziarno pyłku, w gazie, to liczba cząsteczek uderzających w jego powierzchnię będzie również stosunkowo niewielka. Czy można oczekiwać, że ziarno pyłku doświadczy jakichkolwiek wahań ciśnienia z powodu statystycznych wahań liczby cząsteczek gazu uderzających go w danym czasie?
Odpowiedz
Tak. Takie fluktuacje rzeczywiście występują dla ciała o dowolnej wielkości w gazie, ale ponieważ liczba cząsteczek jest ogromna dla ciał makroskopowych, fluktuacje stanowią niewielki procent liczby zderzeń, a średnie mówione w tym rozdziale różnią się niepostrzeżenie. Z grubsza mówiąc, fluktuacje są odwrotnie proporcjonalne do pierwiastka kwadratowego z liczby zderzeń, więc dla małych ciał mogą stać się znaczące. Zaobserwowano to w XIX wieku dla ziaren pyłku w wodzie i jest znane jako ruch Browna.
ciśnienie pary, ciśnienie cząstkowe i prawo Daltona
ciśnienie, które wytworzyłby Gaz, gdyby zajmował całkowitą dostępną objętość, nazywa się ciśnieniem cząstkowym gazu. Jeśli dwa lub więcej gazów zostanie zmieszanych, dojdzie do równowagi termicznej w wyniku zderzeń między cząsteczkami; proces ten jest analogiczny do przewodzenia ciepła opisanego w rozdziale dotyczącym temperatury i ciepła. Jak widzieliśmy z teorii kinetycznej, kiedy gazy mają taką samą temperaturę, ich cząsteczki mają taką samą średnią energię kinetyczną. Tak więc, każdy Gaz spełnia prawo gazu idealnego oddzielnie i wywiera takie samo ciśnienie na ścianki pojemnika, że byłby, gdyby był sam. Dlatego w mieszaninie gazów całkowite ciśnienie jest sumą ciśnień cząstkowych gazów składowych, przy założeniu idealnego zachowania gazu i braku reakcji chemicznych między składnikami. Prawo to jest znane jako prawo Daltona presji częściowej, po angielskim naukowcu John Dalton (1766-1844), który go zaproponował. Prawo Daltona jest zgodne z faktem, że presja dodawana jest zgodnie z zasadą Pascala.
w mieszaninie gazów idealnych w równowadze termicznej liczba cząsteczek każdego gazu jest proporcjonalna do jego ciśnienia cząstkowego. Wynik ten wynika z zastosowania prawa gazu idealnego do każdego w postaci \(p / n = RT / v\). Ponieważ prawa strona jest taka sama dla każdego gazu w danej temperaturze w pojemniku o danej objętości, lewa strona jest taka sama.
- ciśnienie cząstkowe to ciśnienie, które wytworzyłby Gaz, gdyby istniał sam.
- prawo Daltona mówi, że ciśnienie całkowite jest sumą ciśnień cząstkowych wszystkich obecnych gazów.
- dla dowolnych dwóch gazów (oznaczonych jako 1 i 2) w równowadze w pojemniku, \(\frac{p_1}{n_1} = \frac{p_2}{n_2}.
ważnym zastosowaniem ciśnienia cząstkowego jest to, że w chemii działa jako stężenie gazu w określaniu szybkości reakcji. Tutaj wspominamy tylko, że częściowe ciśnienie tlenu w płucach człowieka ma kluczowe znaczenie dla życia i zdrowia. Oddychanie powietrzem o parcjalnym ciśnieniu tlenu poniżej 0,16 atm może zaburzać koordynację i osąd, szczególnie u osób nie zaaklimatyzowanych na wysokim wzniesieniu. Niższe ciśnienie cząstkowe \(O_2\) ma poważniejsze skutki; ciśnienie cząstkowe poniżej 0,06 atm może być szybko śmiertelne, a trwałe uszkodzenie jest prawdopodobne, nawet jeśli osoba zostanie uratowana. Jednak uczucie konieczności oddychania, jak podczas wstrzymywania oddechu, jest znacznie bardziej spowodowane przez wysokie stężenia dwutlenku węgla we krwi niż przez niskie stężenia tlenu. Tak więc, jeśli mały pokój lub szafa jest wypełniona powietrzem o niskim stężeniu tlenu, być może dlatego, że przechowywany jest tam nieszczelny cylinder sprężonego gazu, osoba nie odczuje żadnego „zadławienia” i może wpaść w drgawki lub stracić przytomność, nie zauważając niczego złego. Inżynierowie bezpieczeństwa poświęcają wiele uwagi temu niebezpieczeństwu.
innym ważnym zastosowaniem ciśnienia cząstkowego jest ciśnienie pary, które jest ciśnieniem cząstkowym pary, przy której znajduje się ona w równowadze z fazą ciekłą (lub stałą, w przypadku sublimacji) tej samej substancji. W każdej temperaturze ciśnienie cząstkowe wody w powietrzu nie może przekraczać ciśnienia pary wody w tej temperaturze, ponieważ gdy ciśnienie cząstkowe osiągnie ciśnienie pary, woda skrapla się z powietrza. Przykładem takiej kondensacji jest rosa. Temperatura, w której zachodzi kondensacja dla próbki powietrza, nazywana jest punktem rosy. Można go łatwo zmierzyć przez powolne chłodzenie metalowej kuli; punkt rosy to temperatura, w której po raz pierwszy pojawia się kondensacja na kuli.
ciśnienie pary wody w niektórych temperaturach interesujących dla meteorologii podano w tabeli\(\PageIndex{1}\).
| T(\(^oC\)) | ciśnienie pary (Pa) |
|---|---|
| 0 | 610,5 |
| 3 | 757,9 |
| 5 | 872.3 |
| 8 | 1073 |
| 10 | 1228 |
| 13 | 1497 |
| 15 | 1705 |
| 18 | 2063 |
| 20 | 2338 |
| 23 | 2809 |
| 25 | 3167 |
| 30 | 4243 |
| 35 | 5623 |
| 40 | 7376 |
The relative humidity (R.H.) w temperaturze t jest zdefiniowana przez
\
wilgotność względna \(100\%\) oznacza, że ciśnienie cząstkowe wody jest równe ciśnieniu pary; innymi słowy, powietrze jest nasycone wodą.
przykład \(\PageIndex{3}\): Obliczanie Wilgotności Względnej
Jaka jest wilgotność względna, gdy temperatura powietrza wynosi \(25^oC\), a punkt rosy \(15^oC\)?
strategia
Po prostu sprawdzamy ciśnienie pary w danej temperaturze, a to w punkcie rosy i znajdujemy stosunek.
rozwiązanie
\
Znaczenie
R. H. jest ważne dla naszego komfortu. Wartość \(53.8\%\) mieści się w zakresie od \(40\%\) do \(60\%\) zalecanego dla komfortu w pomieszczeniach.
jak wspomniano w rozdziale dotyczącym temperatury i ciepła, temperatura rzadko spada poniżej punktu rosy, ponieważ gdy osiągnie punkt rosy lub punkt mrozu, woda skrapla się i uwalnia stosunkowo dużą ilość utajonego ciepła parowania.
Średnia wolna ścieżka i średni wolny czas
obecnie jawnie rozważamy kolizje. Zwykle pierwszym krokiem (który jest wszystkim, co zrobimy) jest obliczenie średniej wolnej ścieżki, \(\lambda\), średniej odległości, jaką cząsteczka przemierza między zderzeniami z innymi cząsteczkami, oraz średniego czasu wolnego \(\tau\), średniego czasu między zderzeniami cząsteczki. Jeśli założymy, że wszystkie cząsteczki są sferami o promieniu \(r\), cząsteczka zderzy się z inną, jeśli jej centra znajdują się w odległości 2r od siebie. Dla danej cząstki mówimy, że pole okręgu o tym promieniu, \(4 \ pi R^2\), jest „przekrojem” dla zderzeń. Gdy cząstka porusza się, śledzi cylinder o tym przekroju. Średnia swobodna ścieżka jest długością \(\lambda\) tak, że oczekiwana liczba innych cząsteczek w cylindrze o długości \(\lambda\) i przekroju \(4 \ pi R^2\) wynosi 1. Jeśli chwilowo zignorujemy ruch cząsteczek innych niż ta, na którą patrzymy, oczekiwaną liczbą jest gęstość liczb cząsteczek, n / v, razy objętość, a objętość wynosi \(4\pi R^2 \lambda\), więc mamy \(((n/V)4\pi R^2 \lambda = 1\), lub
\
biorąc pod uwagę ruch wszystkich cząsteczek, obliczenia są znacznie trudniejsze, ale jedyną zmianą jest czynnik \(\sqrt{2}\). Rezultatem jest
\
w gazie idealnym możemy zastąpić \(V/n = k_BT/p\) aby otrzymać
\
średni czas wolny \(\tau\) jest po prostu średnią ścieżką swobodną podzieloną przez typową prędkość, a zwykłym wyborem jest prędkość rms. Następnie
\
Obliczanie średniego czasu wolnego
Znajdź średni czas wolny dla atomów argonu (\(m = 39,9 \, g/mol\)) w temperaturze \(0^oC\) i ciśnieniu 1,00 atm. Przyjmij promień atomu argonu jako \(1.70 \razy 10^{-10}\space m\).
rozwiązanie
- Zidentyfikuj znane i przekonwertuj na jednostki SI. Wiemy, że Masa molowa wynosi 0.0399 kg / mol, temperatura wynosi 273 K, ciśnienie wynosi \(1,01 \ razy 10^5\, Pa\), a promień wynosi \(1,70 \ razy 10^{-10}\, m\).
- Znajdź prędkość rms: \(v_{RMS} = \sqrt {\frac{3RT}{M}} = 413 \, m/s\).
- Zastąp w równaniu średni czas wolny: \
Znaczenie
trudno porównać ten wynik z naszą intuicją na temat cząsteczek gazu, ale daje nam to obraz cząsteczek zderzających się z bardzo wysoką częstotliwością.
ćwiczenie \(\PageIndex{4}\)
które ma dłuższą średnią wolną ścieżkę, ciekłą wodę lub parę wodną w powietrzu?
odpowiedź
w cieczy cząsteczki są bardzo blisko siebie, stale zderzając się ze sobą. Aby gaz był prawie idealny, ponieważ powietrze jest w zwykłych warunkach, cząsteczki muszą być bardzo daleko od siebie. Dlatego średnia wolna ścieżka jest znacznie dłuższa w powietrzu.
autorzy i Atrybucje
-
Samuel J. Ling (Truman State University), Jeff Sanny (Loyola Marymount University) i Bill Moebs z wieloma współautorami. Ta praca jest licencjonowana przez OpenStax University Physics na licencji Creative Commons Attribution License (by 4.0).