orbitale molekularne Karbokacji Allylowej
stabilność karbokacji propenu wynika ze sprzężonego układu elektronowego π. „Podwójne wiązanie” tak naprawdę nie istnieje. Zamiast tego jest to grupa 3 sąsiadujących, nakładających się, niezhybrydyzowanych orbitali p, które nazywamy sprzężonym układem elektronowym π. Wyraźnie widać interakcje pomiędzy wszystkimi trzema orbitalami p z trzech atomów węgla, co daje naprawdę stabilny kation. Wszystko sprowadza się do miejsca, w którym znajduje się węgiel z niedoborem elektronów.
opisy orbitali molekularnych mogą wyjaśnić stabilność allylową w jeszcze inny sposób przy użyciu 2-propenylu. Fig.6
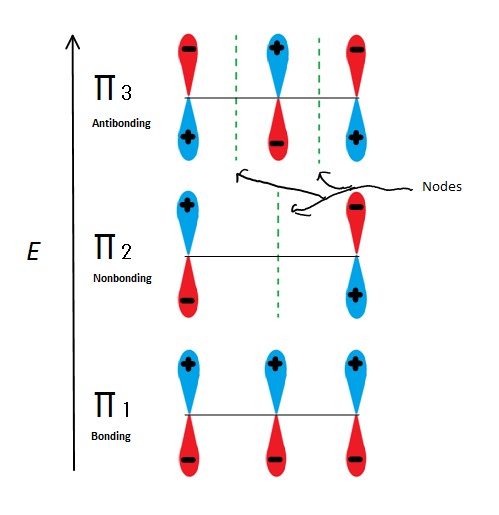
rys.6 pokazuje 3 możliwe orbitale cząsteczkowe 2-propenylu
jeśli weźmiemy tylko Orbital π molekularny, a nie dowolny z s, otrzymamy trzy z nich. π1 jest wiązaniem bez węzłów, π2 jest niezbondowaniem (innymi słowy, taką samą energią jak regularny orbital p) z węzłem, a π3 jest antybondowaniem z 2 węzłami (żaden z orbitali nie oddziałuje). Pierwsze dwa elektrony wejdą w Orbital cząsteczkowy π1, niezależnie od tego, czy jest to kation, Rodnik, czy anion. Jeśli jest rodnikiem lub anionem, następny elektron przechodzi w Orbital cząsteczkowy π2. Ostatni anionowy elektron przechodzi również w orbital nieciągły. Bez względu na to, jakie centrum węgla istnieje, żaden elektron nigdy nie wejdzie w orbital antybondujący.
orbitale wiązania są orbitalami o najniższej energii i są korzystne, dlatego są najpierw wypełnione. Mimo, że niezbondujące orbitale mogą być wypełnione, całkowita energia układu jest nadal niższa i bardziej stabilna dzięki wypełnionym wiążącym orbitalom molekularnym.
ta liczba pokazuje również, że π2 jest jedynym orbitalem molekularnym, w którym elektrion się różni, a także tam, gdzie pojedynczy węzeł przechodzi przez środek. Z tego powodu ładunki cząsteczki znajdują się głównie na dwóch końcowych węglach, a nie na środkowym węglu.
Ten molekularny opis orbitali może również zilustrować stabilność allylowych centrów węgla na fig.7.
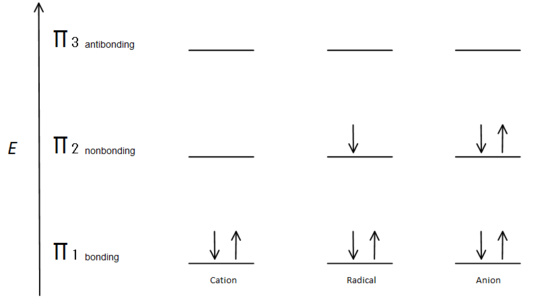
rys.7 diagram pokazujący, jak elektrony wypełniają się w oparciu o zasadę Aufbau.
Orbital wiązania π ma mniejszą energię niż Orbital wiązania P. Ponieważ każde pokazane centrum węgla ma dwa elektrony w niższej energii, wiążąc orbitale π, energia każdego układu jest ogólnie obniżona (a zatem bardziej stabilna), niezależnie od kationu, rodnika lub anionu.