A Microbial Biorealm page on the genus Enterococcus faecalis
Classification
Higher order taxa
Bacteria; Firmicutes; Bacilli; Lactobacillales; Enterococcaceae; 엔테로
종
엔테로 칼리스
설명하고 의미
장구균 있는 그램 양성 cocci 살아남을 수 있는 가혹한 조건에서는 자연이다. 그들은 토양,물 및 식물에서 찾아 낼 수있다. 일부 변종의 제조에 사용되는 음식에는 반면 다른 사람의 원인이 심각한 인간 및 동물 감염(예를들면 그들은 알려진 식민지로 위장하고 성기의 책자간). 그들은 지역 사회와 병원에서 획득 한 감염 모두와 관련이 있습니다. Enterococci 는 10~42°C 의 온도 범위와 광범위한 pH 값을 가진 환경에서 자랄 수 있습니다. 일부는 운동성이있는 것으로 알려져 있습니다. 장구균 속에는 15 종 이상이 있지만 임상 분리 물의 80-90%는 E.faecalis(8)입니다. 장구균은 전형적으로 짧은 사슬을 형성하거나 쌍으로 배열된다. 그러나,특정 성장 조건 하에서,그들은 길어지고 코코 바실러스로 나타납니다. 일반적으로 장구균은 알파 용혈성입니다. 일부는 그룹 D Lancefield 항원을 보유하고 있으며 단일 클론 항체 기반 응집 검사를 사용하여 검출 할 수 있습니다.장구균은 일반적으로 카탈라아제 음성이며 혐기성입니다. 그들은 성장할 수 있 6.5%NaCl,can hydrolyze esculin 에서 존재의 40%담즙과 소금은 pyrrolidonyl arylamidase 및 신 arylamidase 긍정적인(8). 장구균을 입증했 현재 치료에 도전하기 때문에 그들의 저항하는 많은 항균성 약물을 포함하여”세포 벽 active agents;aminoglycosides,페니실린 및 암피실린,및 반코마이신”(1). 의 장구균이 있는 능력을 습득한 다양한 항생제 내성 요소는 현재에 심각한 문제를 환자의 관리 enterococcal 염(8). 일반적으로 반코마이신에 대한 감수성이 저하 된 장구균 분리 물은 vanA,vanB 및 vanC 로 분류 할 수 있습니다. vanA 와 vanB 는 가장 저항력이 있고 저항성 유전자가 플라스미드에서 운반되기 때문에 가장 큰 위협이됩니다. 이후 저항,유전자의 수행에 플라스미드 그들은 쉽게 양도,E. 칼리스 전송할 수 있습니다 이러한 플라스미드에 의해 결합(2). E. faecalis 는 또한 teicoplanin 에 내성이 있습니다. Enterococcal 긴장되는 반코마이신을 따라 발견되었다,그러나 희귀하고 보다 일반적 반코마이신 내성 균주로 인(이하”반코마이신 내성 장구균”또는”VRE”)(1)입니다.
게놈 구조

때문에 많은 공중 보건 위험,게놈 서열 데이터에서는 변형의 엔테로이 필요했다. 게놈 DNA 시퀀싱을 위해 선택된 균주는 미국에서 최초의 반코마이신 내성 분리 물인 E.faecalis V583 이었다. 균주 v583 의 게놈은 게놈 연구 연구소(Tigr)에 의해 서열화되었다. 장구균 게놈은 E.faecalis 가 대사 적으로 다양하며 광범위한 규제 시스템을 포함하고 있음을 보여줍니다. 스트레인 V583 은 4 개의 DNA 분자를 포함합니다: 주요 3,218,030 염기쌍 박테리아 염색체 및 3 개의 원형 플라스미드. 염색체는 약 3,500 개의 개방 판독 프레임(ORFs)을 포함하며,이들 ORFs 의 약 1/3 에는 할당 가능한 기능이 없습니다(8). 3 개의 플라스미드는 플라스미드 -1,플라스미드 -2 및 플라스미드-3 으로 확인 된 원형 DNA 분자이다. 플라스미드-1 은 66,320bp 를 함유하고,플라스미드-2 는 17,963bp 를 함유하고,플라스미드-3 은 57,660bp 를 함유한다. 플라스미드는 트랜스 포사 제,다 약제 내성 단백질 및 ppGpp 조절 성장 억제제(8)를 포함한 다수의 유전자를 암호화합니다. E.faecalis 염색체의 평균 G+C 구성은 37.38%입니다. DNA 분자가 너무 크기 때문에 평균과의 지역적 편차가 발생합니다. 이 위치들 중 하나는”2.22Mb 근처에 위치하는 반코마이신 저항성 유전자 클러스터”와 관련된 큰 세그먼트이며,퍼센트 G+C 함량(8)의 큰 증가를 나타낸다. 이러한 차이는 관련된 항생제 내성 또는 독성을 제안된 인수의 유전자 소재에서 외국인 종를 통해 가로 전송합니다. 전송이 DNA 메이크업의 변화에 대한 책임이 있는지 여부는 아직 알려지지 않았습니다. E 의 게놈에 포함 된 정보. faecalis V583 은 유기체가 다재다능한 인간 병원균이되도록 어떻게 적응했는지에 대한 이해를 크게 도울 것입니다. 를 사용하여 비교 유전체학의 역할이 서로 다른 규제 요소를 더 잘 이해서는 그들이 어떻게 반응하는 다양한 환경적 스트레스와의 표현에 잠재적인 독성 요소(8). 이와 같은 더 많은 연구는 장구균에 의한 세균 감염에 새로운 의약품을 제안 할 것입니다.게놈은 또한 E.faecalis 균주 OG1RF 의 생물막 생산에 중요한 3 개의 Ebp(심내막염 생물막 관련 pili 에 대한 인코딩)오페론을 포함합니다. 이 균주는 이러한 오페론을 사용하여 표면 필리를 생성합니다. . 표면 필리는”숙주 표면에의 부착에 사용되며 심내막염 동안 인간에서 항원 성이다”(9).
TIGR 은 E.faecalis 염색체에 대한 유전자의 전체 목록을 포함합니다.
세포 구조 및 대사
세포 물질 대사를
장구균 가혹한 환경에 살고,같은 장내 책자의 인간과 동물입니다. 이러한 적대적인 조건 하에서 성장은 E.faecalis 가 유연한 신진 대사를 가질 것을 요구합니다. E. 칼리스 할 수 있지만 발효하는 생산 락트산지만 또한”수도 이화시킬 스펙트럼의 에너지 소스에서 탄수화물,글리세린,젖산염,malate,구연산,diamino 산 및 manya 이야-keto 산”(3).그것을 보여왔는에서 선택한 성장 조건 E. 칼리스 향상시킬 수 있는 성장을 통해 산화 인 산화 사용하는 양성자 동기 힘에 의해 설립 된 전자 전송. 의 결과로”초기의 호흡은 생산의 강력한 산화제”(예를 들어 초과 및 과산화 수소),산화적 스트레스를 E. 칼리스를 허용할 수 있습니다(3). 의 포용력이 스트레스와 결합,다른 심각한 성장 조건,수 E. 칼리스에서 성장 10~45°C,담즙,소금에서 매우 낮은 높은 pHs. 또한 E.faecalis 는 아지드,세제,중금속 및 에탄올에 저항 할 수 있습니다. E.faecalis 는 다양한 설탕 공급원을 이용할 수 있기 때문에 다양한 환경,특히 영양소가 제한된 장에서 살 수 있습니다(2). 소장에서 E.faecalis 는 흡수되지 않은 당의 발효에서 대부분의 에너지를 유도합니다. E. faecalis 는 또한 장 잔 세포(2)에 의해 심하게 당화되고 생성되는 탄수화물 인 mucins 를 분해하여 에너지를 얻을 수 있습니다.E.faecalis 는”phosphoenolypyruvate phosphotransferase system(PTS)을 사용하여 세포 외부의 당을 감지하고 인산화와 함께 당을 흡수합니다”(2). 그렇게함으로써 pts 가 아닌 시스템에 의해 설탕이 축적되는 방식에 비해 적은 에너지(ATP)가 낭비됩니다. E.faecalis 에 의해 대사되는 당은 다음과 같습니다:D-포도당,D-과당,유당,말토오스(모든 PTS 기질). Enterococci 에서 PTS 는 또한 글리세롤 대사,유도제 퇴학 및 catabolite 억압을 조절합니다(8). E. 칼리스의 하나 몇 저 G+C 콘텐츠는 그램 양성 박테리아는 설탕을 추방하는 동안 성장에 포도당,알려진 현상으로 유도 퇴학(8). E.faecalis 는 호기성 및 microaerophillic 조건 하에서 글리세롤을 발효시킬 수 있습니다. E. 칼리스도 성장할 수 있습에서 글리세롤 혐기성 조건에서 때문에 그것이”라는 표현에 대 한 유전자 NAD 연결된 혐기성 글리세롤 효소 활동”(8). 글리세롤은 글리세롤 확산 촉진제(GlpF)라고 불리는 단백질을 사용하여 세포막을 가로 질러 갈 수 있습니다. GlpF 는 세포 내부와 외부의 글리세롤 농도를 동일하게 만들고,단백질은 당분 해에의해 억제됩니다. E.faecalis 는 극한의 알칼리성 pH 와 높은 소금 농도로 살 수 있습니다. 이러한 형질은 항상성에 필수적인 일정한 세포 성 이온 조성을 유지하기 위해 양이온 수송을 필요로한다. 모든 세포는 항상성을 선호하는 범위에서 세포 성 농도를 유지하기 위해 과량의 나트륨을 배출해야합니다. E. faecalis 는 Na+/H+antiporter 와 vacuolar-type ATPase(2)를 모두 발현합니다. 칼륨은 주요 세포 내 양이온입니다. 칼륨 농도에서 E. 칼리스의 0.4 0.6M 을 위해 필수적입 정상적인 세포 물질 대사는,그것이”중화하고 세포내 음이온,활성화한 다양한 효소 및 조절 cytosolic pH”(8). E.faecalis 는 k+압출(8)에 대한 Kep 시스템과 함께 규제,KtrI 및 KtrII 를 수행하기 위해 적어도 두 개의 칼륨 전달자를 발현합니다. KtrI 와 KtrII 가 K+흡수 시스템(그들은 K+/H+symphorter)인 것으로 알려져 있지만,단백질은 거의 알려져 있지 않습니다.
세포 구조
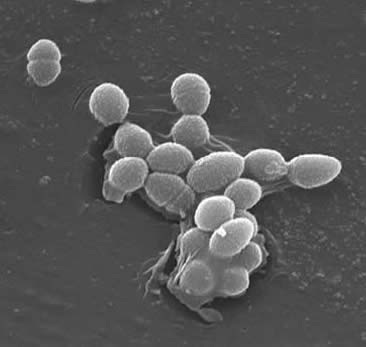
장구균 있는 그램 양성 cocci 는 일반적으로 형태로 짧은 사슬 또는 배치에서 쌍(3). 특정 성장 조건 하에서 그들은 신장하고 구균이 나타날 수 있습니다. E.faecalis 의 세포벽은 건조 세포 중량의 20~38%입니다(지수 및 고정 상 세포에서). 어 E. 칼리스는 그램 양성 박테리아 거기에 세 가지 주요 구성 요소는 세포벽: 펩티도 글리 칸,테이 초산 및 다당류. 40%세포의 벽은 peptidoglycan,나머지는 세포의 벽은”의 함유 다당류와 ribitol-을 포함하는 teichoic 산”(3). 이 peptidioglycan 기능(으로 대부분에서는 그램 양성 세포)저항하는 파열에 의해 유도 높은 세포질 삼투압 있습니다. E.faecalis 는 일반적으로”검출 가능한 mucoid 표현형의 부족”(3)에 의해 나타나는 비 캡슐화 된 유기체로 간주됩니다. 그러나,E.faecalis 분리 물의 서브 세트는 캡슐 다당류를 보유한다. E. faecalis 는 작은 펩타이드 페로몬(2)에 의해 유도 된 접합 과정에 의해 유전 물질(플라스미드)을 교환 할 수 있습니다. 표면 단백질”수신자 세포에서 특정 리간드를 인식하는 응집 물질”은 접합(2)에 대한 성공적인 연결을 보장합니다.E.faecalis 는 또한 생물막의 형성으로 이어질 수있는 표면 필리를 만드는 능력을 가지고 있습니다. 심내막염을 일으키는 E.faecalis 균주에는 다량의 이들 pili 가 포함되어 있습니다. 필리는 호스트 표면(예:심장 조직)에 부착 할 수 있습니다. E 의 균주. 심내막염을 일으키는 faecalis 는”비 심내막염 분리 물보다 훨씬 더 자주 그리고 더 큰 정도로 생물막을 생성합니다”(9).
생태학
E.faecalis 는 매우 다양한 장구균 종입니다. 그것은 다른 많은 유기체와 상호 작용하고 환경에 영향을 미칩니다. 장구균은 인간의 대장에 서식하는 박테리아 공동체의 구성원입니다. 그들은 또한 대부분의 다른 포유 동물과 조류(8)에서 장내 식물상의 자연적인 부분입니다. 장구균은 토양,식물 및 물에서도 발견됩니다. 그들은 물 속에서 발견 될 때 그것은 물 배설물로 오염 했다 때문에 일반적으로. 지만 E. 칼리스 나타나지 않는 너무 자주에서는 식물,기타의 긴장 장구균이 발견 된 중에서 식물은 대부분 수행하여 오염된 물원(8).환경에서의 항생제 내성 및 바이러스 성 유전자 전달의 생태학은 여전히 잘 이해되지 않고있다. 곤충과 같은 완료되었(HF),개발에서 부패 유기 물질을 전달할 수 있는 항생제 내성균에서 비료 동물과는 다른 부패 유기는 기질을 주거 설정(7)입니다. HF 는 그들이 발달하는 서식지(예:대변)에 존재하는 살아있는 미생물 군집 때문에 완벽한 송신기입니다. 좋은 전송 자질에 추가하는 것은 HF 가 그들의 젊은(역류)및 인간 음식에 그들의 매력을 먹이는 방법이다. 이후 HF 비행 할 수있는 긴 거리,이 벌레는 아주 좋은 확산을 위한 대변이 박테리아를 포함,인간 및 동물,병원균과 가능성의 항생제 내성 장구균(7)입니다. Kanasas 의 패스트 푸드 레스토랑에서 Hf 에서 Enterococci 의 항생제 내성 및 바이러스 성 유전자를 선별 한 최근의 연구. 이 연구는”완료되었는 음식에서 처리와 시설을 제공할 수 있습을 수행 항생제 내성과 잠재적으로 악성 장구균이 있는 수용량을 위한 수평한 전송의 항생제 내성 유전자 기타 박테리아”(7)입니다.효과 그 이자형. faecalis 는 환경에 더 부정적인 경향이 있습니다. 그들은 일반적으로 감염된 식물뿐만 아니라 사람들의 감염으로 이어질 수있는 물 공급을 오염시킵니다(8). 항생제 인자는 또한 다양한 곤충(예:집 파리)과 동물에 의해 운반되어 악성 E.faecalis 의 수가 증가 할 수 있습니다.
병리학
장구균으로 떠오르고 있는 주요 원인의 병원내염,그리고 이 그룹 내에서 엔테로 원인 칼리스의 대부분은 인간의 enterococcal 감염. 이러한 감염은 국소 적이거나 체계적 일 수 있으며 요로 및 복부 감염,상처 감염,균혈증 및 심내막염(2)을 포함합니다. 이후 E. 칼리스는 생존 할 수있는 수많은 환경 문제에(같은 극한의 온도와의 존재를 담염)와 그들이 할 수 있기 때문에 획득하는 저항하는 항생제를 여러,이러한 박테리아의 주요 건강 문제입니다. Nnis(National Nosocomial Infection Surveillance)시스템은 1989 년 이후 반코마이신 내성 장구균(VRE)으로 인한 감염 발생률의 증가를보고했습니다(1). 이 의미할 수 있습니다 심각한 건강상의 문제를 포함하는의 부족을 사용할 수 있는 항생제에 대한 치료 VRE 감염이기 때문에,대부분의 VRE 종자 하버 저항하는 항생제를 여러 외에 반코마이신(예:aminoglyscoides 및 암피실린). Vre 에서 다른 그람 양성 병원체로의 vanocmycin 내성 유전자의 전달은 심각한 공중 보건 관심사입니다. 가장 일반적인 방법으로는 E. 칼리스 감염의 원인에서 발생하는 병원/장기 보호 시설은의 전송 E. 칼리스 사이에 환자(8). 장구균은 건강 관리 종사자의 손에 들고 한 환자에서 다른 환자로 운반(이전)될 수 있습니다. 손에 VRE 가 최대 60 분 동안 지속될 수 있음이 입증되었습니다(8). 의료 종사자의 손에서 환자로의 전달은 환자의 정맥 내 또는 요로 카테터와의 접촉시 일어날 수 있습니다. 사용 후 제대로 청소되지 않은 직장 온도계는 VRE 를 환자뿐만 아니라 환자에게 전달할 수 있습니다. 때로는 전염으로 인해 획득 된 변형으로 환자의 위장관이 식민지화 될 수 있습니다. 그런 다음 새로운 균주는 환자의 내인성 식물상(8)의 일부가됩니다. 항생제 내성 유전자를 운반하는 획득 된 균주는 위장관에서 살 수 있습니다. 감염은 이러한 새로 획득 된 E.faecalis 균주로부터 발생합니다.E.faecalis 는 인체 내에서 많은 감염을 일으킬 수 있습니다. 장구균에 의한 가장 흔한 감염은 요로의 감염입니다. E.faecalis 는 방광염,전립선 염 및 부고환염(8)과 같은 하부 요로 감염(UTI)을 유발할 수 있습니다. E.faecalis 는 복부 내,골반 및 연조직 감염에서도 발견됩니다. 이자형. faecalis 는 병원균 혈증을 일으킬 수 있습니다. 균혈증의 근원은 대부분 감염된 정맥 카테터에서 발생하는 요로입니다. 심내막염은 심장 판막의 염증을 유발하기 때문에 가장 심각한 장구균 감염입니다. 심내막염의 많은 경우 항생제 치료가 실패하고 감염된 밸브를 제거하는 수술이 필요합니다(8). E.faecalis 에 의한 덜 흔한 감염은 수막염,혈행 성,골수염,패혈증 성 관절염 및(매우 드물게)폐렴을 포함합니다. 많은 항생제에 대한 장구균의 저항성으로 인해 이러한 감염의 치료가 어렵습니다.
응용 프로그램을 생명 공학
장구균에 대해 연구되어왔다로 사용 가능한 프로바이오틱(식이 보조제를 포함하는 거 아닌 치명적인 미생물 세포는 섭취하면 생각하는 군인에 영향을 미칠 장내 미생물의 구성). E.faecalis 균주의 투여는 설사를 감소시키는 것으로 나타났다. E.faecalis probiotics 는 동물의 설사를 낮추기 위해 닭/돼지/가축 사료에 사용됩니다(8).
때문에 높은 질병을 일으키는 속성의 칼리스,더 많은 연구가 수행하는 방법에 정의 독성 E. 칼리스보다 유용하게 사용하는 방법 E. 칼리스.
현재 연구
1.)바랍에 대한 감염에 의해 발생 엔테로 칼리스(4)
알려져 있는 반코마이신 내성 박테리아(예:E. 칼리스)포 많은 문제가 사회의 원인,세균 감염은 인간 취급하기 어렵습니다. 장구균 감염은 유기체가 저항성 유전자를 신속하게 획득하고 보급 할 수있는 능력을 가지고 있기 때문에 도전적입니다. Ceftobiprole(BPR)은 그람 양성 구균에 대한 조사적인 세 팔로 스포린으로 사용되었습니다. BPR 은 그람 양성 및 그람 음성 페니실린 결합 단백질에서 높은 친화력을 가진 광범위한 스펙트럼의 비경 구 세 팔로 스포린입니다. 또한 β-락타 마제에 의한 가수 분해에 대한 안정성을 나타낸다.이 연구 조사 활동의 BRP 에 대한의 큰 컬렉션 E. 칼리스,보고 BPR 살균 활동에 대한 반코마이신 내성 분리된다. 이 연구는 susceptibly 을 BPR E. 칼리스에 의해 영향을 받지 않습의 존재를 반코마이신 저항 또는 의 β-락타 마 생산입니다. 반코마이신 내성(VanA 및 VanB 표현형)또는 ampiciliin 저항성을 나타내는 E.faecalis 의 균주에서 BPR 은 살균성이었다. 연구진은 BPR 이 750mg 의 용량으로 E.faecalis 에 대해 살균 활성을 나타내어 E.faecalis 활성의 100%를 억제 함을 보여 주었다. 지만 존재하는 효소의 β-락타 마은에서 드문 E. 칼리스,존재를 타협 사용 가장 효과적인 방지 enterococcal β-락탐(예를 들어 암피실린). BPR 은 β-락타 마제 효소에 대한 열악한 기질로 β-락타 마제 생성 E.faecalis 에 대한 우수한 활성을 설명합니다.이 연구는 Bpr 이 E.faecalis 의 매우 큰 수집에 대해 강력한 활성을 가지고 있음을 입증했습니다. BPR 의 활성은 반코마이신 내성 또는 β-락타 마제의 생산에 영향을받지 않았다. 따라서,BPR 은 희망이 있는 에이전트에 대한 치료에 사용 β-락타 마 생산 및 반코마이신 내성 E. 칼리스에 있는 감염은 인간이 아니다.2.)방법을 조사하 엔테로 칼리스에 저항력이 될 약물 linezolid(5)
경우 항생제 사용되는 치료에 세균이 감염,그들에 영향을 줄 수 있는 장 식물로 장식되어 있습니다. 저항성 박테리아는 장구균과 같은 치료 중에 선택 될 수 있으며 잠재적으로 병원성이 있습니다. 저항의 출현은 항생제의 유용성을 위험에 빠뜨릴 수 있기 때문에 새로운 항생제에 대한 문제입니다.이 연구는 E.faecalis 에 의한 항생제에 대한 내성의 출현을 조사했다. 더 구체적으로,연구진 보면서 저항 linezolid(최초의 새로운 클래스의 항생제으로 알려진”oxazolidinones”). Linezolid 는 vre 를 포함한 다중 약물 내성 그람 양성 구균에 대해 사용할 수 있습니다. 그것을 억제 세균 단백질 합성에 바인딩하여 특별히 도메인에서 50S ribosomal 소 단위에 의해 영향을 받지 않습 저항성 메커니즘에 영향을 주는 기타 항생제입니다. 이 연구는 gnotobiotic 마우스의 소화관에서 linezolid-resistant E.faecalis 돌연변이 체의 출현 속도를 살펴 보았다. 이지의 linezolid 먹에 물과 함께 복용량이 다양한에서 0.5,0.005 0.005g/L. 돌연변이 모두에 의존 linezolid,주어진 저항의 수준으로 증가 기간의 노출이 있습니다. 리네 졸리 드가없는 상태에서 돌연변이 체가 분리되지 않았으며,리네 졸리 드에 대한 드 노보 내성이 장구균에서 드물다는 것을 시사한다.이 연구는 단일 23S rRNA 유전자의 돌연변이가 리네 졸리 드 저항성의 출현에 중요한 단계라는 것을 발견했다. 단일 돌연변이 돌연변이를 갖는 일차 식민지화는 마우스에서 치료 개시 후 5 일 일찍 관찰되었다.생쥐를 포함하는 이러한 실험은 임상 분리 물에서 관찰 된 리네 졸리 드에 대한 내성의 출현 패턴을 설명하는 데 도움이됩니다. 연구팀은 선량이 저항의 역학에 중요하다는 것을 보여 주었다. 이러한 연구 결과 정의 하는 데 도움이 됩니다 최고의 치료 전략을 최소화하는 출현을 저항의 임상에서 설정을 가능하게 저장 많은 생명을 구했습니다.3.)A Ser/Thr kinase 엔테로 칼리스 발견을 중재한 항생제 내성(6)
엔테로 원인 칼리스의 많은 항생제 내성 감염의 병원에서 그 결과 고유의 저항하는 특정 항생제와 생존 할 수있는 능력 확산에서 장관입니다.E 에서 볼 수있는 저항의 유전 적 기초. faecalis 는 잘 알려져 있지 않습니다.이 연구는 저항의 원인을 확인하려고 시도합니다. 연구자들은 나타났 PrkC,하나 구성 요소는 신호 단백질을 포함하는 진핵 유형 Ser/Thr kinase domain,허용되는 고유한 항생제 내성과 장의 지속성을 E. 칼리스. 그들이 발견 E. 칼리스 돌연변이 부족 PrkC 성에서 야생형율의 부재에서 항균 스트레스만을 보이 향상된 감도 셀-봉투-활성 화합물을 포함하여,항생제를 대상으로 휴 벽 속 담즙 세제를 사용하는 것을 금합니다.PrkC 는 병원 병원체로서의 성공의 열쇠 인 E.faecalis 의 생리 학적 과정을 조절합니다. 연구팀은’예측된 구조의 PrkC 었 세포 키나제 도메인으로 구분하여 transmembrane 세그먼트를 생각하는 바인딩 비가 교 연결 peptidoglycan. 이것은 PrkC 가 E.faecalis 세포벽의 완전성을 모니터하고 그 상호 작용을 유지하기 위해 적응 반응을 매개하는 막 횡단 수용체라고 제안했다. PrKC 는 E 에게 중요합니다. 칼리스의 원인 병원 내 감염을 제안하고,신호 단백질은 대상에 대한 치료법의 개발에 감염을 방지하기 위하여 항생제 내성 장구균.1.)I.T.Paulsen,L Banerjei,G.S.A.Myers,K.E. 넬슨,R.Seshadri,D.T. 읽기,D.E.Fouts,J.A.Eisen,S.R. 길,J.F. 하이델베르크,H.Tettelin,R.J. 혹은,L.Umayam,L.Brinkac,M.Beanan,S.Daugherty,R.T.DeBoy,S.Durkin,J.Kolonay,R.Madupu,W. 넬슨,J.Vamathevan,B.Tran,J.Upton,T.Hansen,J.Shetty,H.Khouri,T.Utterback,D.Radune, K.A. 케첨 B.A. 도,C.M. 프레이저. “반코마이신 내성 장구균 faecalis 의 진화에서 모바일 DNA 의 역할.”과학. 3 월 2003. 권. 299 호,5615 호. 피.2071-20742.)Murrary 수. 더 1998. “다제 내성 장구균 중 다양성.”신흥 전염병. 권. 4,1 호. 피.46-65.3.)De la Maza,Luis M.,Marie T.Pezzlo 및 Janet T.Shigei. 의료 세균학의 컬러 아틀라스. 워싱턴 DC:미국 미생물학 협회,2004.4.)Arias C.,Singh K.,Panesso D.,Murray BE. “시간을 죽이고 성분의 연구 Ceftobiprole 에 대한 엔테로 칼리스 포함,β-락타 마 생산 및 반코마이신 내성 분리된다.”항균제와 화학 요법. 유월 2007. 권. 51 호 6 호 피.2043-2047.5.)부르주아-Nicolaos N.,Massias L.,Couson B.,부텔 MJ,Andremont A.,Doucet-Populaire 프”용량의존의 출현의 저항에 Linezolid 엔테로 칼리스 In Vivo.”전염병 저널. 2007. 권. 195. 피.1480-1488.6.)Kristich C.,Wells C.,Dunny G. “Enterococcus faecalis 의 진핵 생물 형 Ser/Thr 키나아제는 항균 저항성과 장 지속성을 매개한다.”미국 국립 과학원 논문집. 2 월 2007. 권. 104 호 9 호 피.3508-3513.7.)Macovei,L.,Zurek,L.”항생제 내성 유전자의 생태학:음식 설정에서 수집 된 집파리에서 장구균의 특성.”응용 및 환경 미생물학. 유월 2006. 권. 72 호 6 호 피.4028-4035.8.)길모어,마이클. 장구균:병원성,분자 생물학 및 항생제 내성. 워싱턴 DC:미국 미생물학 협회,2002.9.)Nallapareddy SR,Singh KV,Sillanpää J,Garsin DA,Höök M,Erlandsen SL,Murray BE.. “Enterococcus faecalis 의 심내막염 및 생물막 관련 pili.”임상 조사 저널. 10 월 2006. 116 호. 피.2799-2807.
Rachel Larsen 의 학생 인 Uc San Diego 의 Richard A.Martinez 가 편집했습니다.