분자 궤도의 Allylic Carbocation
의 안정성 carbocation 의 프로필렌으로 인해 활용 π 전자는 시스템입니다. “이중 결합”은 실제로 존재하지 않습니다. 대신,그것은 우리가 접합 된 γ 전자 시스템이라고 부르는 3 개의 인접한,겹치는,비 하이브리드 화 된 p 오비탈의 그룹이다. 당신은 분명히 정말 안정한 양이온의 결과로 세 개의 탄소에서 p 오비탈의 세 사이의 상호 작용을 볼 수 있습니다. 그것은 모두 전자가 부족한 탄소의 위치가있는 곳으로 내려옵니다.
분자 궤도 설명할 수 있는지 설명 allylic 안정성에 또 다른 방법을 사용하는 2-프로 페닐. 도.6
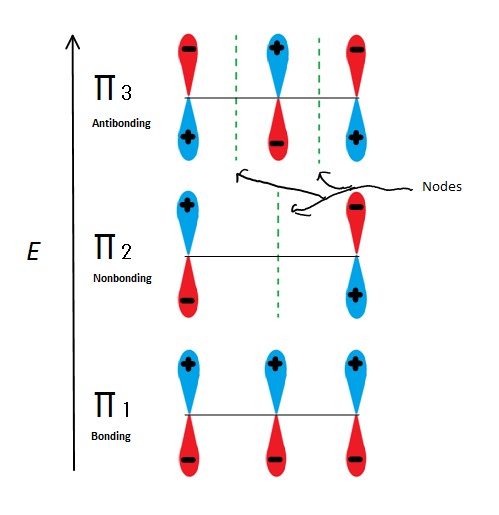
경우가 π 분자 궤도지의 s,우리는니다. π1 는 접합 없이 함께 노드,π2 은 nonbonding(즉,같은 에너지로 일반 p 궤도)의 노드 π3 은 antibonding2 노드(없음의 궤도는 상호작용). 처음 두 전자는 그것이 양이온,라디칼 또는 음이온인지 여부에 관계없이 π1 분자 궤도로 갈 것입니다. 라디칼 또는 음이온 인 경우 다음 전자는 γ2 분자 궤도로 들어갑니다. 마지막 음이온 전자는 또한 비 본딩 궤도로 들어갑니다. 그래서 어떤 종류의 탄소 센터가 존재하지 않 전자 적으로 이동 antibonding 궤도.
결합 오비탈은 가장 낮은 에너지 오비탈이며 유리하므로 먼저 채워지는 이유입니다. 도 nonbonding 궤도 채워질 수 있는,전반적인 에너지 시스템은 여전히 낮고 안정적으로 채워진 접합 분자 궤도.
이 그림도 보여줍니다 π2 은 분자 궤도는 electrion 다릅니다,그것은 또한 단일 노드를 통해 전달합니다. 이 때문에 분자의 전하는 주로 중간 탄소가 아닌 두 개의 말단 탄소에 있습니다.
이 분자 궤도 설명은 또한 그림 7 에서 알릴 탄소 중심의 안정성을 설명 할 수 있습니다.
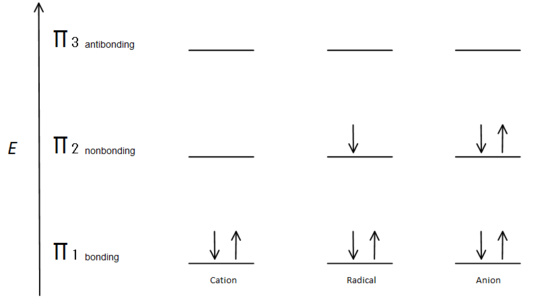
γ 결합 궤도는 nonbonding p 궤도보다 에너지가 낮습니다. 이후 매 탄소 센터는 다음과 같은 두 개의 전자에서 더 낮은 에너지,접착 π orbitals,에너지는 각 시스템의 낮은 전반적으로(따라서 더 많은 안정적인)관계없이,양이온,급진적이,또는 음이온.