Chemguide:핵심 화학 14-16
이중 및 삼중 공유 결합
이 페이지의 가능성을 내포하고 여러(더블룸 또는 트리플)공유 결합 원자 사이를 사용하여 산소,질소,이산화탄소 및 ethene 로 예입니다. 이들은 모두 14-16 세의 영국 강의 계획서에 일반적으로 지정되어 있기 때문에 선택됩니다.
나이 있다고 가정하면 페이지를 읽을 소개 공유 접합 및 액세스를 주기적으로 테이블과 같은 중 하나에서 다운로드할 수 있습니다.
더블 접합에서의 산소
을 보면 산소를 주기율표에,당신은 그것을 찾을 수 있습니다 있는 원자의 숫자 8-그리고 중립 atom8 8 양자와 전자들. 이것들은 배열 될 것입니다 2,6.
그래서 당신은 두 개의 원자는 다음과 같다:
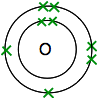
각각 두 짝이 없는 전자. 최대 정력적인 안정성을 얻으려면 이들 모두를 짝을 지어야합니다.
그래서 oxygens 는 두 쌍의 전자를 공유합니다:
이것은 훨씬 쉽게 사용을 참조하십시오 라인을 나타내의 쌍을 공유하는 전자
![]()
트리플에 결합 질소
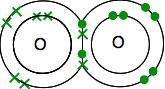
경우 질소에서 주기적으로 테이블 당신은 운동할 수 있는 전자구조이 2,5. 그것을 산소와 비교하면,따라서 한 쌍의 전자와 그 외부 레벨에 3 개의 짝이없는 전자를 가지고있다.
가능한 한 정력적으로 안정하게 만들려면 공유 결합에서 이들 모두를 쌍으로 만들어야합니다. 두 가지 질소 원자이므로 결합에 이 방법:
다시,이것은 훨씬 쉽게 사용을 참조하십시오 라인을 나타내의 쌍을 공유하는 전자:
![]()
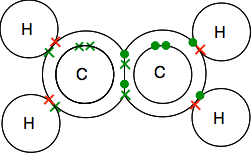
더블 접합에서는 이산화탄소
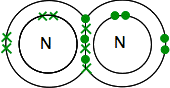
탄소의 전자구조이 2,4 4 짝이 없는 전자는 외부에 있는 수준입니다.
산소의 전자가 2 쌍이고 외부 레벨에 2 개의 짝이없는 전자가있는 2,6 입니다.
당신은 쌍을 이루는 모든 전자로 끝날 필요가 있습니다-그리고 그것을하는 한 가지 방법 만 있습니다.
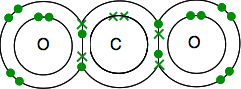
이전으로,접합을 사용하여 라인 결자의 쌍.
![]()
이 있는 경우 두 결합 쌍 전자의 사이에 두 개의 원자,그것은이라고,의외로,이중 결합. 그래서 각 산소는 이중 결합에 의해 중간에있는 탄소 원자에 결합됩니다.
더블의 접착 ethene,C2H4
Ethene 및 기타 유사한 화합물과 함께 더블 채권 사이의 탄소원자들은 중요한 물질 화학입니다. 나중에 코스에서 더 자세히 만날 것입니다.
점과 십자가 다이어그램을주의 깊게 살펴보고 모두 함께 맞는 방법을 이해해야합니다. 이 방법으로 탄소와 수소원 모두의 모든 단일 전자가 결합 쌍으로 짝을 이루도록해야합니다.
에서 오는 경우 다이어그램을 보여주는 결합 쌍으로 라인,당신은 중 하나를 찾을 수 있습니다 두 가지 버전이 있습니다.
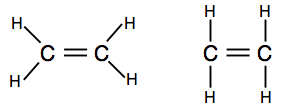
첫 번째 하나 보여줍니다 실제 모양 분자의 더 나은,그러나 두 번째는 또한 완벽하게 허용에서 이 수준입니다.
지금 어디로 가고 싶습니까?
공유 결합에 대한이 섹션의 다음 페이지로. . .
원자 구조 및 결합 메뉴로. . .
화학 14-16 메뉴로. . .
에 Chemguide 메인 메뉴. . .