루이스 다이어그램의 많은 분자,그러나,일정하지 않으로 관찰의 특성을 분자입니다.
실시예 1: 질산이온
질산이온,에 따라 루이스 다이어그램은 두 종류의 질소-산소 채권,더블 채권 개 및 싱글 채권,제안하는 하나의 질소-산소 채권에 질산이온이 짧고 각각의 다른 두. 또한,루이스 구조의 의미와 관련하여 공식적인 책임이 있다는 것을,두 가지 형태의 산소 원자에 질산이온,중 하나는 공식적으로 중립적이고 각각의 다른 두 개의 베어링 형식의 책임-1 입니다. 실험적으로,그러나,이 세 가지 질소-산소 채권에 질산이온 같은 유대의 길이와 같은 채권은 에너지와 세 개의 산소 원자를 구분할 수 없습니다. 루이스 다이어그램은 질산염 이온의 구조와 결합을 만족스럽게 설명하지 못합니다.
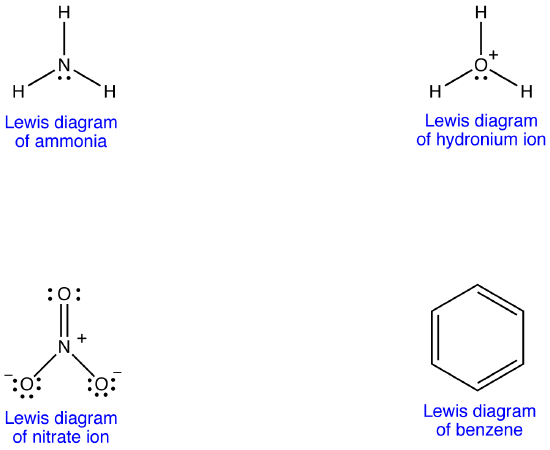
질산염 이온에 대해 두 개의 추가 루이스 다이어그램을 그릴 수 있습니다.
그러나,그들 중 아무도 없는 일관성과 관찰의 특성을 질산이온 그리고,따라서,올바르게 지정되지 않을 묘사 하는 질산이온.
실시예 2: 벤젠
벤젠,에 따라 루이스 다이어그램이 두 가지 유형의 탄소-탄소 결합,세 번 채권 및 세 싱글 채권,제안하는 각각의 세 가지 탄소-탄소 결합 벤젠에 짧고 각각의 다른 세 가지입니다. 그러나 실험적으로 벤젠에서 6 개의 탄소-탄소 결합은 동일한 결합 길이와 동일한 결합 에너지를 갖는다. 루이스 다이어그램은 벤젠의 구조와 결합을 만족스럽게 설명하지 못합니다.
의 특성을 분자는 고전적인 루이스 다이어그램이 일정하지 않으로 관찰 특성을 다른 유효한 루이스 다이어그램을 생성할 수 있습니다. 벤젠에 대해 하나의 추가 루이스 다이어그램을 그릴 수 있습니다.

그러나,그들 중 아무도 없는 일관성과 함께 관찰되는 속성의 벤젠하고,따라서가 올바르게 묘사하는 벤젠.
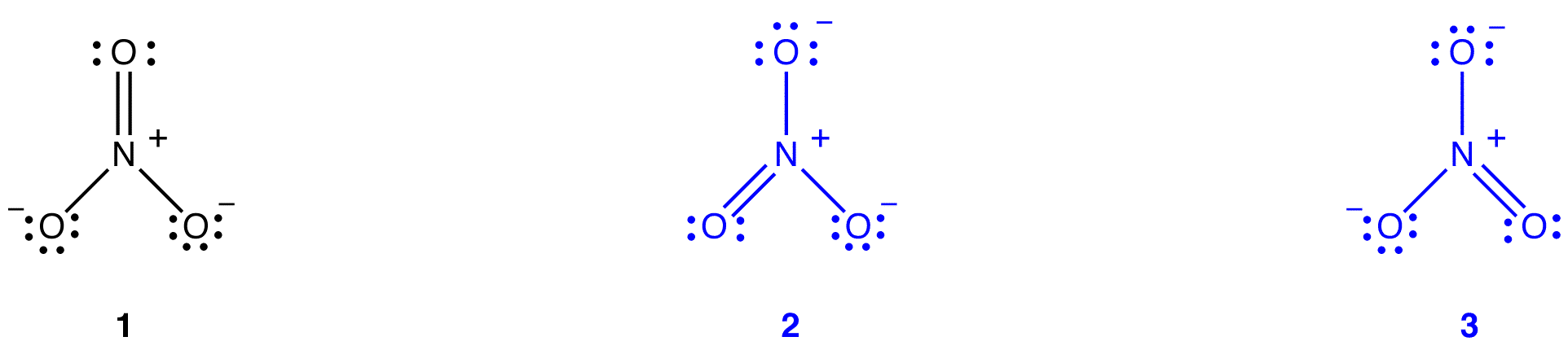
공명 이론을 설명하려고 합의 구조는 종과 같은 질산이온 또는 벤젠,아 루이스 다이어그램의 일관성과 관찰의 특성을 종합니다. 주요 이점을 공진 이론이 있지만,그에 따라 엄격한 수학적 분석,공진 이론이 적용될 수 있는 성공적으로 호출 거 또는 수학이다. 공명 이론은 질산염 이온을 예로 사용하여 아래에서 설명합니다.
공명 이론에 따르면,질산염 이온의 구조는 1 도 2 도 3 이 아니라 안정성에 의해 가중되는 이들 세 가지 모두의 평균이다. 루이스 다이어그램 1,2 및 3 은 질산염 이온의 공명 형태,공명 구조 또는 공명 기여자라고합니다. 질산염 이온의 구조는 공명 하이브리드 또는 간단히 공명 형태 1,2,3 의 하이브리드라고 알려져 있습니다. 질산염 이온의 구조를 보여줄 필요가있을 때마다 양두 화살표로 연결된 공명 형태 1,2 및 3 이 그려집니다.
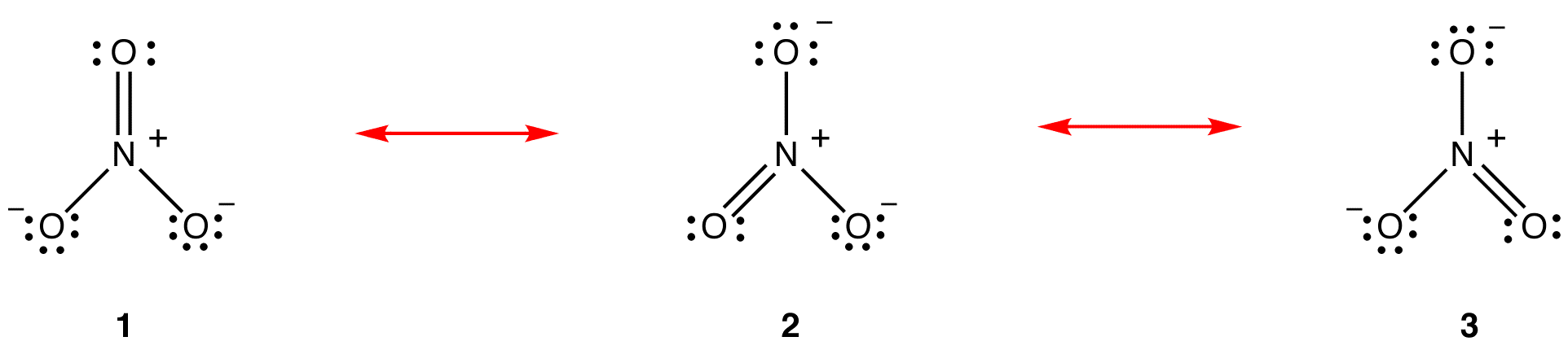
세 가지 공명 양식의 질산이온,1,2,3,동일한,그래서 그들은 같은 안정성 그리고,따라서 동일하게 참여하는 하이브리드입니다. 때문에 정확한 정도는 각 공명 양식의 질산이온에 기여하는 하이브리드 알려져,결합해 각각의 질소-산소 채권 뿐 아니라 형식적인전에서 각각의 산소 원자 하는 하이브리드에 쉽게 결정될 수 있는:
에 따르면 공명이론,각 채권에 질산이온은 하나의 세 번째의 채권과 일치하는,관찰하는 세 가지는 채권에 질산이온 같은 유대의 길이와 같은 유대 에너지입니다.
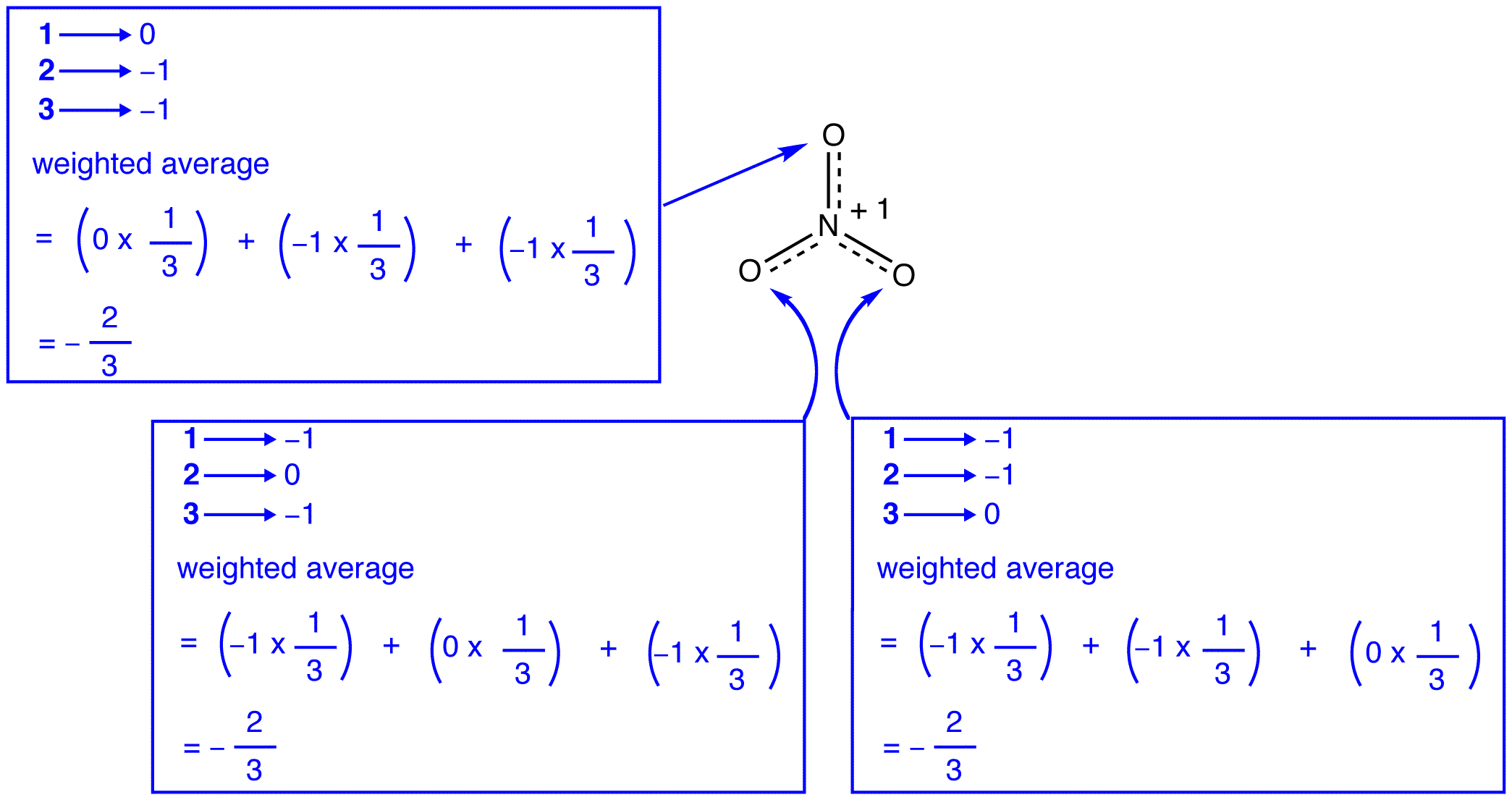
에 따르면 공명이론,각각의 산소 원자에 질산이온이 공식적인 담당 -2/3 는,함께 사는 질소-산소 채권은 동일한,은 관찰과 일치하는 세 가지는 산소 원자에 질산이온이 명확히 구분되지 않습니다.
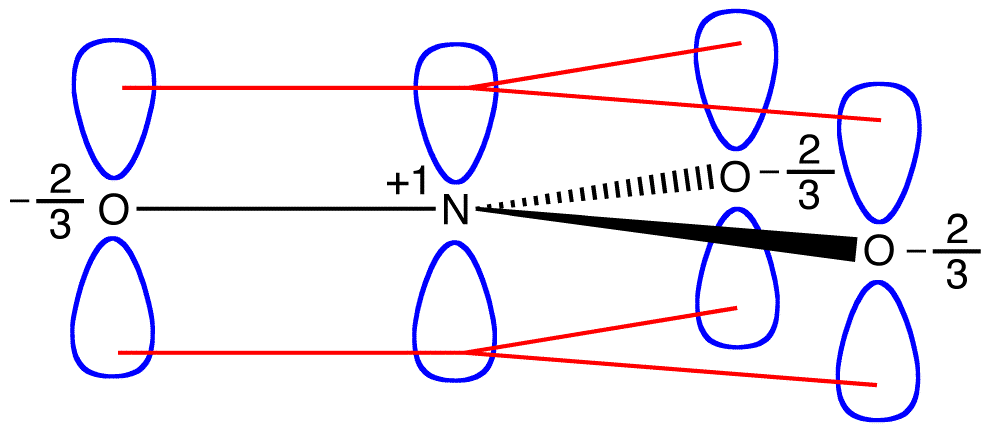
질산염 이온의 각 공명 형태에는 두 개의 pi 전자가 있으며 두 개의 원자에 의해서만 공유됩니다. 두 원자에 의해서만 공유되는 전자는 국부 화되어 있다고합니다. 따라서,질산염 이온의 각 공명 형태에서 2 개의 파이 전자가 국지화된다. 질산이온에 의해 대표되는 것과 같이 하이브리드,두 개의 pi 전자
#전자에 하나의 파이 채권=2
#전자에서는 하나의 세 번째는 파이 채권=2/3
#에서 전자 세=3x(2/3) =2
두 pi 전자에 질산이온이 공유의 원자,하나의 질소 원자와 세 개의 산소 원자를 함유하고 있습니다. 두 개 이상의 원자에 의해 공유되는 전자는 딜로크 화된다고합니다. 따라서,질산염 이온 내의 2 개의 파이 전자는 딜로 칼라이즈된다. 질산염 이온에있는 pi 전자의 Delocalization 는 4 개의 원자가 그들에 p orbitals 의 옆 겹침을 허용하는 동일한 평면에있을 것을 요구한다.
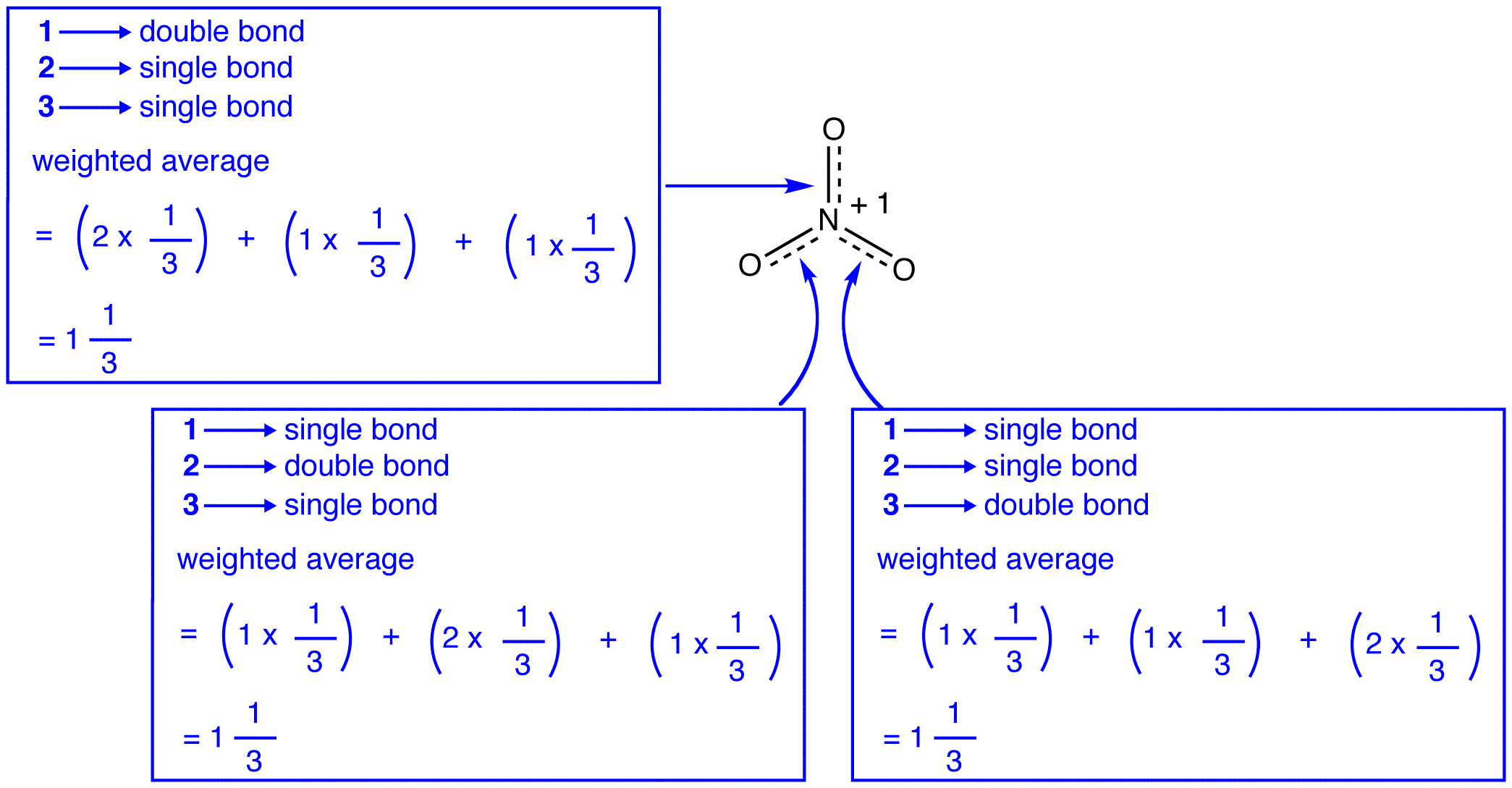
경우의 에너지 질산이온들의 가중 평균한 에너지의 그것의 세 공진 형태로 구조물의 질산이온이 가중평균의 구조물의 세 공명 형태로,그와 같아야 에너지 하나의 세 개의 동일한 공명 양식:
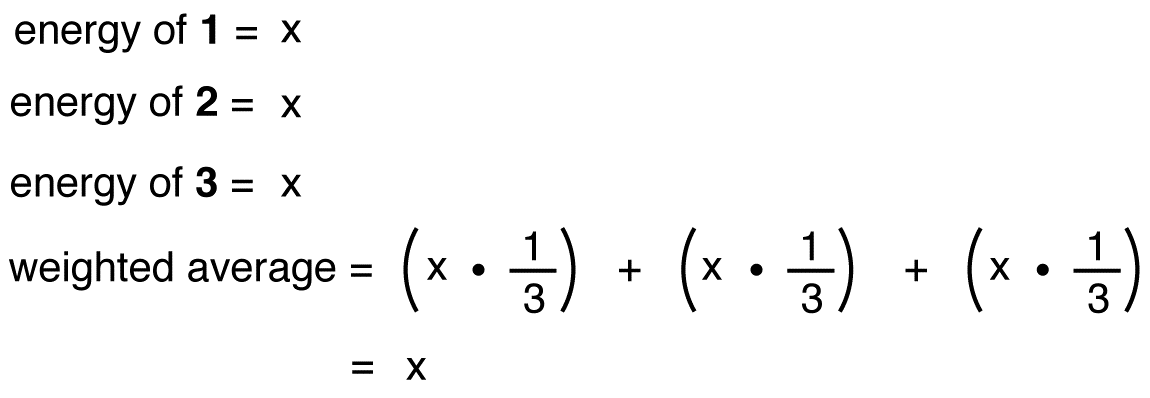
경우의 에너지 하이브리드 동등하는 공명 양식,주어진 모든 화학체(초등학교 입자,원자,분자,등등.)자연스럽게 될 경향이 가장 낮은 가능한 에너지 상태,없을 것이 장점에 대한 질산이온으로 존재하는 하이브리드;그것은 단순히 수로 존재한 공명 양식입니다. 때문에 질산이온으로 존재하는 하이브리드로,공명 양식을 유추할 수 있는 에너지 하이브리드의 그것 보다는 더 낮의 모든 공명 양식입니다.
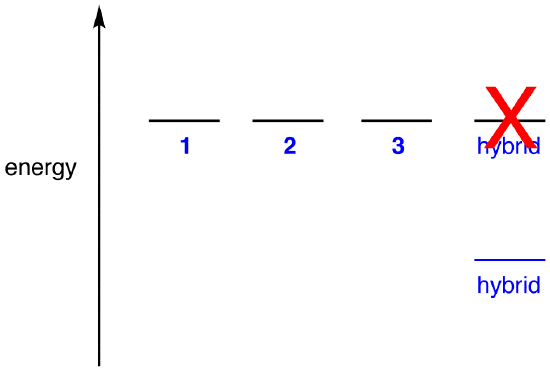
에 따르면 공명이론,다음의 에너지 분자가 보다 낮은 가장 낮은 에너지 공명 양식입니다. 때문에 질산이온이 낮은 에너지를 그리고,따라서,더 안정적보다는 그 공명 양식 질산이온다 공명이 안정된다.
공명이라는 단어의 문자 적 해석으로 인해 초창기 학생들 사이에 공명 이론에 대한 두 가지 오해가 있습니다. 이들은 질산염 이온을 예로 사용하여 아래에 설명되어 있습니다.
오해 1: 질산염 이온은 잠시 동안 공명 형태 1 로 존재하고 공명 형태 2 또는 공명 형태 3 으로 변경되어 상호 전환되거나 1 로 되돌아갑니다.
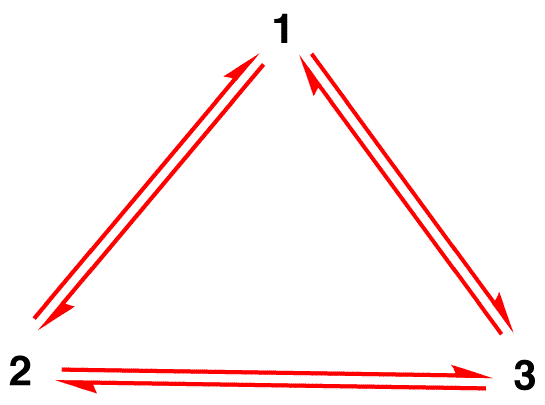
의 구조물 질산이온이지 1 나 2 개 또는 3 지만 하이브리드와 시간이 변경되지 않는 한를 겪고 반응입니다.
오해 2:에서의 샘플 질산이온,에서 주어진 순간의 이온으로 존재 공명 양식 1,또 다른 하나-세 번째로 공명 양식 2,나머지 하나 제대로 공명 양식 3.
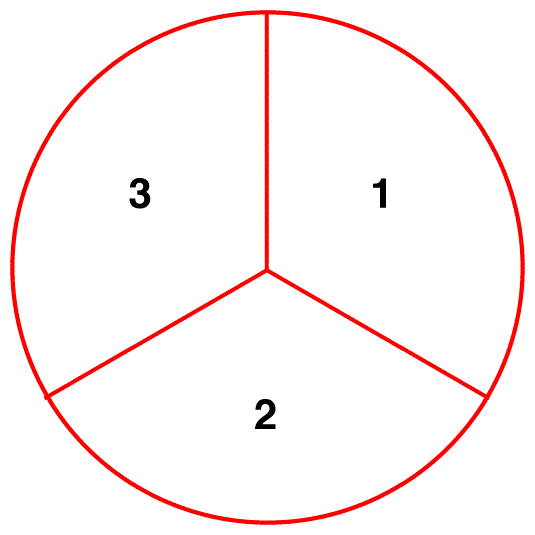
에서의 샘플 질산이온,주어진 순간에,모든 이온들이 동일한 구조는 하이브리드입니다.
이 두 가지 오해를 명확히하기 위해 사용 된 고전적인 비유는 노새(Morrison,R.T.;Boyd,R.n.Organic Chemistry,fifth edition;Allyn and Bacon:Boston,1987,pg. 373). 생물학적으로 노새는 말과 당나귀의 잡종입니다. 이것은 노새가 잠시 동안 말과 닮았다가 당나귀와 비슷하게 변한다는 것을 의미하지는 않습니다. 노새의 모습은 말의 것과 당나귀의 것의 조합이며 시간에 따라 변하지 않습니다. 무리에서 어떤 노새는 말과 다른 노새는 당나귀와 비슷하다는 의미도 아닙니다. 무리에서,모든 노새는 말과 당나귀의 조합 인 같은 모양을 가지고 있습니다. 의 약점 이 비유는 말과 당나귀가 존재하는 반면 공명 양식은 엄격하게 보았다. 모리슨과 보이드에서 인용 된 더 나은 비유는 코뿔소입니다. 코뿔소를 보았을 때,존재하지 않는 두 생물 인 용과 유니콘의 잡종으로 묘사 할 수 있습니다.
공명 형태를 그리는 규칙
1. 공명 형태는 원자가 결합 이론에 기초한 루이스 다이어그램입니다.따라서 그들은 원자가 결합 이론의 기본 규칙을 준수해야합니다. 따라서,수소 가질 수 없습니다 두 개 이상의 원자의 전자;기간-두 요소를 가질 수 없습니다 더 많은 여덟 원자의 전자;에 있는 요소 기간은 세 가지고 아래에 있는 여덟 개 이상의 원자의 전자. 예:질산염 이온의 각 공명 형태에는 마침표 인 질소와 산소의 두 가지 요소가 있습니다. 질산염 이온의 공명 형태 중 어느 것도 원자 중 어느 것에도 8 개 이상의 원자가 전자가 없다. 2. 모든 공명 양식이 동일해야 합 sigma-채권 프레임워크에 다른 위치 파이의 전자와 c 로 원자의 전자. 예를 들어 모든 공명 양식의 질산이온이 동일한 sigma-채권 framework:
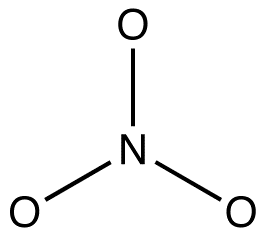
그들은 다른 하나에서 다른 위치에서만이 전자와 고독한 쌍이다.
유기 화학자들은 반응성 중간체의 구조를 공명 안정화 종으로 설명하기 위해이 규칙을 점점 더 위반하고 있습니다. 예를 들어:oxymercuration
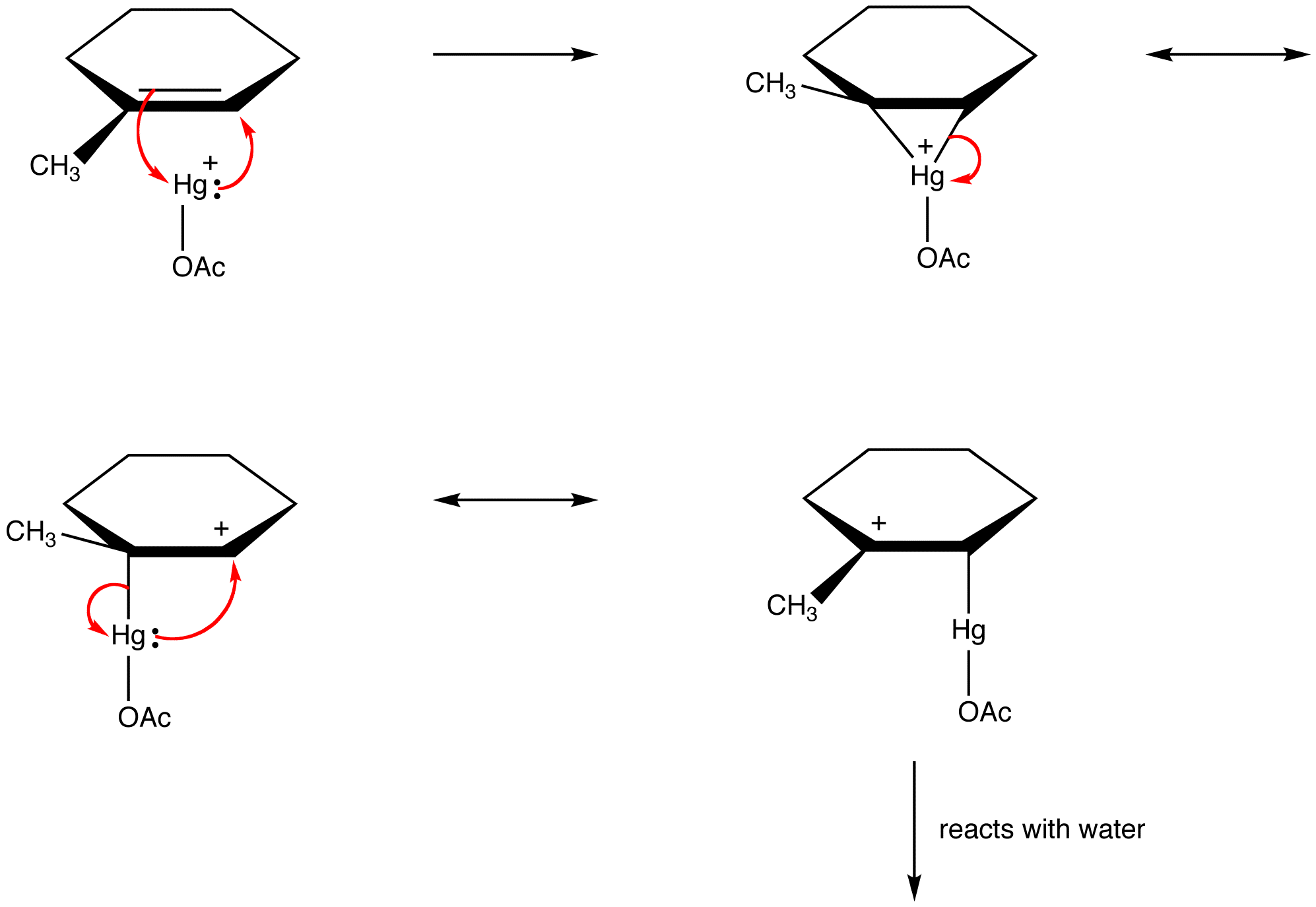
결정하여 공명 양식 하이브리드
세 가지 형태의 질산이온이 동일하고,따라서 동 안정성이 있습니다. 결과적으로,그들은 하이브리드에 동등하게 기여합니다. 대부분의 공명 안정화 분자의 공명 형태는 서로 다르므로 하이브리드에 동등하게 기여하지 않습니다. 공명 형태가 안정할수록 하이브리드에 더 많이 기여합니다. 따라서,결정의 상대적 공헌 또는 공명 양식을 필요로 하이브리드의 결정은 그들의 상대적 안정성이 있습니다. 공명 형태의 상대적 안정성을 결정하기 위해 다음 규칙을 사용하십시오.
1
공명 양식에서는 모든 원자가의 진수 원자의 전자보다 더욱 중 하나에서는 적어도 하나의 원자하지 않습니다. 예를 들면:
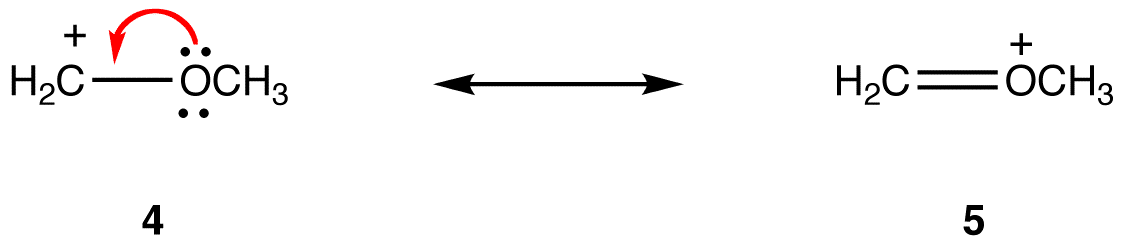
에서 공명 양식 5,모든 원자가의 진수 원자의 전자서 4 중 하나,원자,탄소 원자 베어링 형식의 요금+1,하지 않습니다. 따라서,공명 형태 5 는 공명 형태 4 보다 안정하다.
규칙 2:
그 밖의 모든 사항이 동일한 경우 공명 양식을 하는 형식적인 부정적인 요금에 더 많은 음 아날로그 전자기구,디지털 전자기 더 보다는 안정되어 있는 공식에 부정적인 요금을 덜 음 atom. 예를 들면:
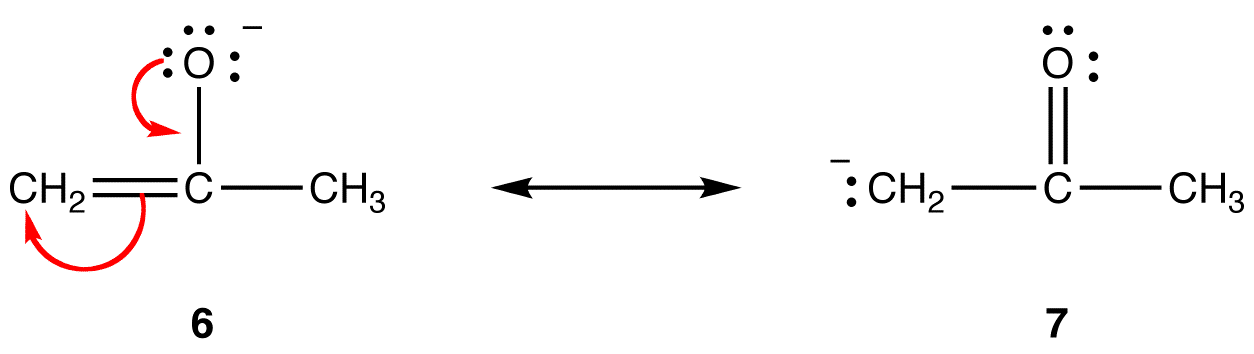
에서 공명 양식을 6,공식적인 부정적인 요금에는 산소 원자;7,그것은 탄소 atom. 산소는 탄소보다 전기 음성도입니다. 따라서,공명 형태(6)는 공명 형태(7)보다 안정하다.공식적인 양전하와 관련하여 추세는 반대입니다. 는 그 밖의 모든 사항이 동일한 경우 공명 양식을 하는 형식적인에 긍정적 인 요금이 적은 부위의 원자보다 더욱 중 하나는 공식적인 긍정적인 책임에서 더 많은 음 atom. 예를 들면:
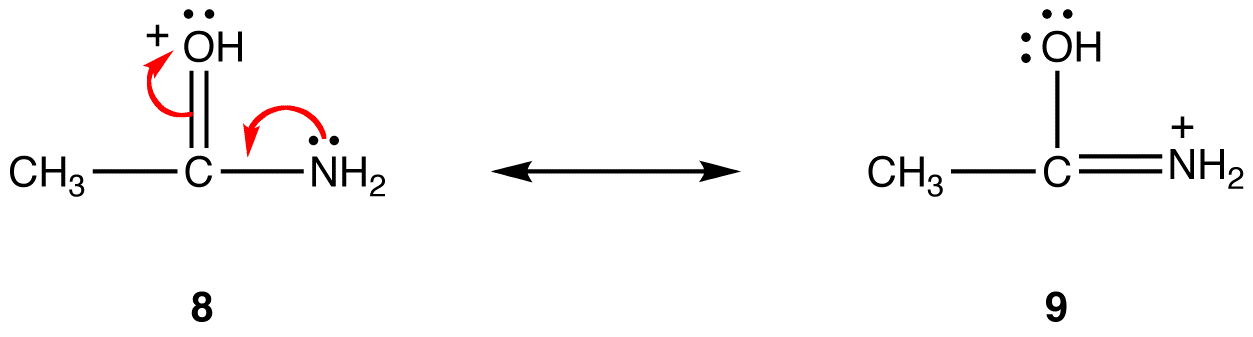
에서 공명 양식을 8,공식적인 긍정적인 책임에서 산소 원자;에서 9 일,그것은에 질소 원자입니다. 질소는 산소보다 전기 음성도가 적기 때문에 공명 형태 9 는 공명 형태 8 보다 안정하다.
규칙 3:
그 밖의 모든 사항이 동일한 경우 공명 양식을 가지지 않는 전하 분리라는 배위 공명 양식을,더 안정적인 것보다는 하나 않습니다. 예를 들어:
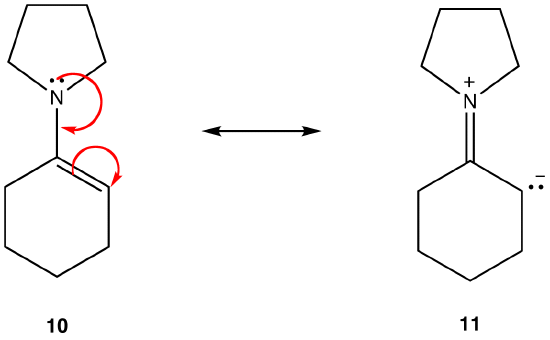
공명 양식 11 은 배위 공명 양식;10 하지 않습니다. 따라서 10 은 11 보다 안정적입니다. 이 규칙은 반대 요금이 유치하는에 따라 Coloumb 의 법칙의 벡터 형태의 결과이다. 이 결과는 것을 반대 전하 분리,에너지가 필요하는 것을 의미,11 는 더 높은 에너지 보다는 10 이므로 10 이상 보다는 안정되어 있 11.
규칙 4:
에서 배위 공진 형태의 모든 사람이 동등하게되고,더 큰 사이의 거리가 비용을 분리,더 안정적인 공진 형태입니다. 예:
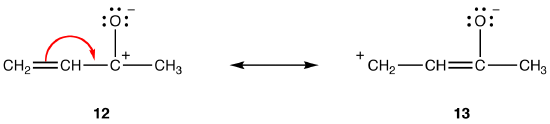
둘 다 공명 형태 12 와 13 은 쌍극자 공명 형태이다. 분리 된 전하 사이의 거리는 12(1 개의 결합)보다 13(3 개의 결합)에서 더 크므로 13 은 12 보다 안정적입니다. 이 규칙의 결과 스칼라의 양식 Coloumb 의 법국는 매력적인 힘 사이의 반대가 요금이곱에 반비례하여 그들 사이의 거리. 따라서,에너지를 유지하는 데 필요한 요금 반대 구분에서 12 보다 높다는 13 의미하는 12 는 더 높은 에너지 보다는 13 일,그래서 13 일이 더욱 안정적인 것보다 12.
위의 규칙을 적용되지 않을 수도 있습을 공명을 포함하는 요소의 기간은 세 가지고 아래 자신의 능력으로 인해 수용 여덟 개 이상의 전자가에서 원자 쉘입니다. 예를 들어:
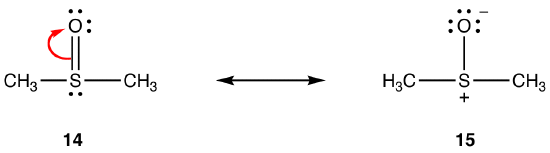
더블 채권에서 14 일로 구성되어 있 sigma 채권과 채권에 의해 형성이 겹치의 2p 궤도,방위에 두 개의 전자,산소 원자와 빈 3d 궤도상에서 황 atom. 이 두 궤도는 매우 다른 에너지,크기 및 모양을 가지므로 pn–dn 상호 작용으로 알려진 이들 사이의 중첩은 약합니다. 결과적으로,하이브리드의 황-산소 결합에는 이중 결합 특성이 거의 없으며,즉 15 는 주요 공명 형태이다.
참여자 및 귀속
- Ochempal 사이트(유타 밸리 대학교)의 Gamini Gunawardena