A Microbial Biorealm page on the genus Enterococcus faecalis
Classification
Higher order taxa
Bacteria; Firmicutes; Bacilli; Lactobacillales; Enterococcaceae; エンテロコッカス
種
エンテロコッカスfaecalis
説明と意義
エンテロコッカスは、自然の中で過酷な条件を生き残ることができるグラム 彼らは土壌、水、植物で見つけることができます。 ある緊張は食糧の製造で他が深刻な人間および動物の伝染の原因である一方使用されます(例えば人間の胃腸および生殖管を植民地化すると知 彼らは、コミュニティと病院後天性感染症の両方に関連しています。 Enterococciは10から42°Cの温度較差と広い水素イオン濃度指数の環境で育つことができます。 いくつかは運動性であることが知られています。 エンテロコッカス属の15種以上がありますが、臨床分離株の80-90%がE.faecalis(8)です。 腸球菌は、典型的には短鎖を形成するか、または対に配置される。 しかし、特定の成長条件下では、それらは伸長し、cocobacillaryように見える。 一般に、腸球菌はα溶血性である。 いくつかはグループD Lancefieldの抗原を所有し、monoclonal抗体ベースの膠着テストを使用して検出することができます。腸球菌は典型的にはカタラーゼ陰性であり、嫌気性である。 それらは6.5%NaCl中で成長することができ、40%胆汁塩の存在下でエスクリンを加水分解することができ、ピロリドニルアリールアミダーゼおよびロイシンアリールアミダーゼ陽性である(8)。 腸球菌は、”細胞壁活性剤;アミノグリコシド、ペニシリンおよびアンピシリン、およびバンコマイシンを含む”多くの抗菌薬に対する耐性のために治療上の課題を提示することが証明されている(1)。 腸球菌は、腸球菌感染症(患者の管理に深刻な問題を提示する抗菌耐性因子の多種多様を取得する能力を持っている8)。 一般に、バンコマイシンに対する感受性が低下した腸球菌分離株は、vanA、vanB、およびvanCとして分類することができる。 vanAおよびvanBは最も抵抗力があり、抵抗の遺伝子がプラスミドで運ばれるので最も大きい脅威を提起する。 耐性遺伝子はプラスミド上に運ばれるので、それらは容易に転写可能であり、E.faecalisは共役によってこれらのプラスミドを転写することができる(2)。 E. フェカリスはテイコプラニンにも耐性がある。 バンコマイシン依存性の腸球菌株が発見されているが、バンコマイシン耐性株(”バンコマイシン耐性腸球菌”または”VRE”と呼ばれる)よりもまれであり、一般的ではない(1)。
ゲノム構造

細胞構造と代謝
細胞代謝
腸球菌は、人間や動物の腸管のような過酷な環境に生息しています。 これらの敵対的な条件下での成長には、E.faecalisが柔軟な代謝を有することが必要である。 E. faecalisは乳酸を作り出すために発酵だけでなく、”炭水化物、グリセロール、乳酸塩、リンゴ酸、クエン酸塩、ジアミノ酸およびmanya-keto酸からのエネルギー源のスペクトルを異化させることができる”(3)ことができる。 「新生呼吸の結果は、強力な酸化剤の産生である」(例えば、スーパーオキシドおよび過酸化水素)、e.faecalisが許容することができる酸化ストレス(3)。 他の厳しい成長条件と結合されるこの圧力の許容はE.faecalisが胆汁の塩で、そして極端に低く、高いpHsで10から45°Cで育つようにする。 さらに、E.faecalisはアジド、洗剤、重金属およびエタノールに抵抗できます。 E.faecalisは様々な砂糖源を利用することができるので、特に栄養素が限られている腸内で、多様な環境に生息することができます(2)。 腸内では、E.faecalisは吸収されていない糖の発酵からエネルギーの大部分を得ます。 E. 糞便はまた、ムチン、重くグリコシル化され、腸の杯細胞(によって産生される炭水化物を分解することによってエネルギーを得ることができます2)。E.faecalisは、”ホスホエノリピルビン酸ホスホトランスフェラーゼ系(PTS)を使用して、細胞外の糖を感知し、糖の取り込みをリン酸化と結合させる”(2)。 そうすることで、非PTSシステムによって砂糖がどのように蓄積されるかに比べて、より少ないエネルギー(ATP)が無駄になります。 E.faecalisによって代謝される糖には、D-グルコース、D-フルクトース、ラクトース、マルトース(すべてのPTS基質)が含まれる。 腸球菌では、PTSはまた、グリセロール代謝、誘導排除、および異化抑制を調節します(8)。 E.faecalisは、グルコースの成長中に糖を排出するいくつかの低G+C含有量のグラム陽性細菌の1つであり、誘因排除(として知られている現象8)。 E.faecalisは好気性およびmicroaerophillic条件の下でグリセロールを発酵できます。 E.faecalisはまた、「NAD+結合嫌気性グリセロール脱水素酵素活性の遺伝子を発現する」ため、嫌気条件下でグリセロール上で増殖することができる(8)。 グリセロールは、グリセロール拡散促進剤(GlpF)と呼ばれるタンパク質を使用して細胞膜を横断することができます。 GlpFはグリセロールの集中を細胞の中のそしての外の同輩に、蛋白質解糖によって禁じられますさせます。 E.faecalisは極度なアルカリpHおよび高い塩の集中に住めます。 これらの形質は、恒常性のために不可欠な一定の細胞質イオン組成を維持するために陽イオン輸送を必要とする。 すべての細胞は、恒常性を支持する範囲内の細胞質濃度を維持するために過剰なナトリウムを排出しなければならない。 E. faecalisは、Na+/H+アンチポーターと空胞型ATPase(2)の両方を発現しています。 カリウムは主要な細胞内陽イオンである。 0.4から0.6MのE.faecalis内のカリウム濃度は、正常な細胞代謝に不可欠であり、”細胞内アニオンを中和し、多様な酵素を活性化し、細胞質phを調節する”(8)。 E.faecalisは、K+押出(8)のためのKepシステムと一緒に調節、KtrIとKtrIIを実行するために、少なくとも二つのカリウム輸送体を発現しています。 KtrIおよびKtrIIはK+取り込み系(それらはK+/H+輸送体である)であることが知られているが、タンパク質はほとんど知られていない。腸球菌はグラム陽性球菌であり、典型的には短鎖を形成するか、または対に配置されている(3)。
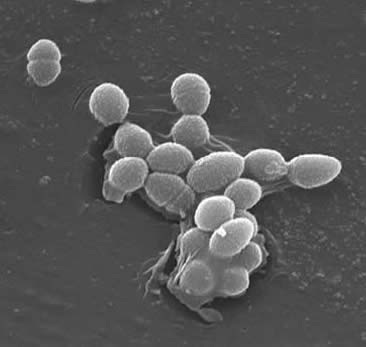
腸球菌はグラム陽性球菌である。
腸球菌はグラム陽性球菌である。
腸球菌はグラム陽性球菌である。 特定の成長条件下では、それらは伸長し、coccobacillaryに見えることがあります。 E.faecalisの細胞壁は、乾燥細胞重量の2 0〜3 8%である(指数期および定常期の細胞において)。 E.faecalisがグラム陽性細菌であることを考えると、その細胞壁を構成する三つの主要なコンポーネントがあります: ペプチドグリカン、teichoic酸および多糖類。 細胞壁の40%はペプチドグリカンで構成され、残りの細胞壁は”ラムノース含有多糖類とリビトール含有テイコイン酸”で構成されています(3)。 ペプチドグリカンは、高い細胞質浸透圧によって誘導される破裂に抵抗するために(ほとんどのグラム陽性細胞のように)機能する。 E.faecalisは、一般的に「検出可能なムコイド表現型の欠如」によって示される非封入生物と考えられている(3)。 しかし、E.faecalis分離株のサブセットは、莢膜多糖類を有しています。 E. faecalisは、小さなペプチドフェロモンによって誘導される抱合プロセスによって遺伝物質(プラスミド)を交換することができます(2)。 表面タンパク質”受容体細胞上の特定のリガンドを認識する凝集物質”は、抱合のための成功した接続を確保する(2)。E.faecalisにまたbiofilmの形成をもたらすことができる表面のpiliを作る機能があります。 心内膜炎を引き起こすE.faecalis株は、これらの線毛を大量に含んでいます。 線毛は、宿主表面(例えば、心臓組織)への付着を可能にする。 Eの株。 心内膜炎の原因となる糞便は、「バイオフィルムは、非心内膜炎分離株よりも有意に頻繁に、また、より大きな程度に」(9)を産生する。
生態学
E.faecalisは腸球菌の非常に多様な種です。 それは他の多くの生物と相互作用し、環境に影響を与えます。 Enterococciは人間の大きい腸に生息する細菌のコミュニティのメンバーです。 彼らはまた、他のほとんどの哺乳類や鳥類(における腸内細菌叢の自然な部分である8)。 腸球菌は、土壌、植物、および水にも見出される。 それらが水中で発見されたとき、それは典型的には水が糞便で汚染されていたためである。 E.faecalisは、植物にあまりにも頻繁に表示されませんが、腸球菌の他の株は、植物の中で発見され、汚染された水源(に行う可能性が最も高いされている8)。環境中の抗生物質耐性および病原性遺伝子導入の生態学はまだ十分に理解されていない。 腐敗している有機材料で発生するヤドリギ(HF)のような昆虫は、動物や他の腐敗している有機基質の肥料から抗生物質耐性細菌を居住環境に伝達す HFは、それらが発達する生息地(例えば糞便)に存在する生きている微生物群集のために完全な送信機である。 よい移動の質に加えることはHFが人間の食糧への若者(逆流)そして魅力に与える方法である。 HFは長距離を飛ぶことができるので、この昆虫は、ヒトおよび動物の病原体、およびおそらく腸球菌の抗生物質耐性株を含む糞便細菌を広げるのに非常に優れています(7)。 KanasasのファーストフードのレストランのHFからの腸球菌の抗生の抵抗そして病原性の遺伝子のために選別される最近の調査。 この研究は、「食品取り扱いおよび提供施設のイエバエは、抗生物質耐性遺伝子を他の細菌に水平移動させる能力を有する抗生物質耐性および潜在的に毒性のある腸球菌を運ぶことができる」ことを示した(7)。その効果はE. faecalisは環境でより否定的でありがちである持っています。 彼らは通常、感染した植物だけでなく、人々の感染につながることができます水の供給を汚染します(8)。 抗生物質因子はまた、様々な昆虫(例えば、ハウスハエ)および動物によって輸送され、毒性のあるE.faecalisの数を増加させることができる。
病理学
腸球菌は院内感染の主要な原因として浮上しており、このグループ内では腸球菌faecalisがヒト腸球菌感染の大部分を引き起こ これらの感染症は、局所的または系統的であり、尿路および腹部感染症、創傷感染症、菌血症、および心内膜炎(含むことができる2)。 E.faecalisは多数の環境の挑戦を存続することができるので(胆汁塩の極端な温度そして存在のような)および多数の抗生物質への抵抗を得ることがで 国立院内感染サーベイランス(NNIS)システムは、1989年以来、バンコマイシン耐性腸球菌(VRE)による感染の発生率の増加を報告している(1)。 これはvreの伝染のための利用できる抗生療法の欠乏を含む深刻な健康上の問題を意味できますほとんどのVREの緊張がバンコマイシン(例えばaminoglyscoidesおよびampicillin)のほかの多数の抗生物質への抵抗を抱くので。 Vreから他のグラム陽性病原体へのバノクマイシン耐性遺伝子の移動は、深刻な公衆衛生上の懸念である。 E.faecalis原因感染が病院/長期介護施設で発生する最も一般的な方法は、患者(間のe.faecalisの伝達である8)。 腸球菌は、医療従事者の手で運ばれ、ある患者から別の患者に運ばれる(移送される)ことができる。 手のVREは最大60分間持続することが示されています(8)。 医療従事者の手から患者への伝達は、患者の静脈内または尿カテーテルとの接触時に起こる可能性がある。 使用後に適切に洗浄されていない直腸温度計は、患者から患者にVREを同様に送信することができる。 時々伝達は得られた緊張が付いている患者のGI地域の植民地化で起因できます。 新しい株は、その後、患者の内因性植物相の一部となる(8)。 抗生物質耐性遺伝子を有する取得株は、消化管に生息することができる。 感染症は、これらの新たに取得されたE.faecalis株から発生します。E.faecalisは、人体内の多くの感染症を引き起こす可能性があります。 腸球菌によって引き起こされる最も一般的な感染症は、尿路の感染症である。 E.faecalisは、膀胱炎、前立腺炎、および精巣上体炎などの下部尿路感染症(UTI)を引き起こす可能性があります(8)。 E.のfaecalisは内部腹部、骨盤の、および柔らかいティッシュの伝染にまたあります。 E. 糞便は院内菌血症を引き起こす可能性があります。 菌血症の原因は、感染した静脈内カテーテルから生じる尿路であることが最も多い。 心内膜炎は、心臓弁の炎症を引き起こすので、最も重篤な腸球菌感染症である。 心内膜炎の多くの場合、抗生物質治療が失敗し、感染した弁を除去する手術が必要である(8)。 E.faecalisによって引き起こされるより少なく共通の伝染は髄膜炎、hematogenous、骨髄炎、敗血症性関節炎および(非常にまれに)肺炎を含んでいます。 多くの抗生物質に対する腸球菌の耐性のために、これらの感染症の治療は困難である。
バイオテクノロジーへの応用
腸球菌は、プロバイオティクス(摂取すると腸内微生物叢の組成に有益に影響すると考えられる生きている非毒性微生物細胞を含む栄養補助食品)としての使用が可能であることが研究されている。 E.faecalis株の投与は、下痢を軽減することが示されている。 E.faecalisプロバイオティクスは、動物の下痢を下げるために鶏/豚/牛の飼料に使用されています(8)。
E.faecalisの高い病気の原因となる特性のために、E.faecalisの有益な使用よりもE.faecalisの病原性を止める方法についてはるかに多くの研究が行われています。
現在の研究
1.)Enterococcus faecalisによる感染症への希望(4)
バンコマイシン耐性菌(e.faecalisなど)は社会に多くの問題をもたらし、ヒトには治療が困難な細菌感染を引き起こすことが知られている。 腸球菌感染症は、生物が耐性遺伝子を迅速に獲得し、普及させる能力を有するため、挑戦的である。 グラム陽性球菌に対する研究用セファロスポリンとしてセフトビプロール(BPR)を用いた。 BPRはグラム陽性およびグラム陰性のペニシリン結合蛋白質からの高い親和性の広いスペクトルの非経口的なセファロスポリンです。 また、β-ラクタマーゼによる加水分解に対して安定性を示す。バンコマイシン耐性分離株に対するBPR殺菌活性を見て,e.faecalisの大規模なコレクションに対するBRPの活性を調べた。 E.faecalisにおけるBPRに対する感受性は,バンコマイシン耐性の存在またはβ-ラクタマーゼ産生によって影響されないことが分かった。 バンコマイシン耐性(VanaおよびVanb表現型)またはアンピシリン耐性を示すE.faecalis株では,BPRは殺菌性であった。 研究者らは、BPRが750mgの用量でE.faecalisに対して殺菌活性を示し、E.faecalis活性の100%を阻害することを示した。 酵素β-ラクタマーゼの存在はE.faecalisではまれであるが、その存在は最も効果的な抗腸球菌β-ラクタム(例えばアンピシリン)の使用を妥協する。 BPRはβ-ラクタマーゼ酵素の貧弱な基質であり,e.faecalisを産生するβ-ラクタマーゼに対する優れた活性を説明している。この研究は、BPRがE.faecalisの非常に大規模なコレクションに対して強力な活性を有することを実証した。 Bprの活性はバンコマイシン耐性やβ-ラクタマーゼの産生に影響されなかった。 従って、BPRは人間のβラクタマーゼの作成およびバンコマイシン抵抗力があるE.faecalisの伝染を扱う使用のための希望に満ちた代理店です。
2.)Enterococcus faecalisがどのように薬剤linezolidに耐性になるかを調べる(5)
抗生物質が細菌感染の治療に使用されると、腸内細菌叢に影響を与える可能性があります。 耐性菌は、腸球菌などの治療中に選択することができ、潜在的に病原性である。 耐性の出現は、抗生物質の有用性を危険にさらす可能性があるため、新しい抗生物質の問題です。この研究では、E.faecalisによる抗生物質に対する耐性の出現を検討した。 より具体的には、研究者らは、リネゾリド(「オキサゾリジノン」として知られる新しいクラスの抗生物質の最初のもの)に対する耐性を調べた。 LinezolidはVREを含む多数薬剤抵抗力があるグラム陽性の球菌に対して、使用することができます。 それは50s ribosomalサブユニットの範囲にとりわけ不良部分によって細菌蛋白質の統合を禁じ、他の抗生物質に影響を与える抵抗のメカニズムによっ 本研究では、gnotobioticマウスの消化管におけるlinezolid耐性E.faecalis変異体の出現率を調べました。 リネゾリドのdoは、0.5、0.005から0.005g/Lまで変化する用量で水中に供給された変異体は、すべて与えられたリネゾリドに依存していた、抵抗のレベルは、暴露の持続時間とともに増加した。 リネゾリドの非存在下では変異体は単離されず,リネゾリドに対するdenovo耐性は腸球菌では珍しいことを示唆した。この研究は、単一の23S rRNA遺伝子の突然変異がリネゾリド耐性の出現における重要なステップであることを見出した。 単一変異変異体による一次コロニー形成は、マウスにおける治療開始後5日には早くも観察された。マウスを含むこれらの実験は、臨床分離株で観察されたリネゾリドに対する耐性の出現のパターンを説明するのに役立つ。 研究チームは、線量が抵抗のダイナミクスに重要であることを示しました。 これらの知見は、おそらく多くの命を救う、臨床現場での抵抗の出現を最小限に抑えるための最良の治療戦略を定義するのに役立つはずです。
3.)Enterococcus faecalisのSer/Thrキナーゼは抗菌抵抗性を仲介することがわかっています(6)
Enterococcus faecalisは、特定の抗生物質に対する固有の抵抗性と腸管内で生存し増殖する能力の結果、病院で抗生物質耐性感染の多くを引き起こす。Eに見られる抵抗性の遺伝的基礎。 糞便はよく知られていませんが、この研究は抵抗の原因を特定しようとしています。 研究者らは、PrkC、真核生物型Ser/Thrキナーゼドメインを含む一成分シグナル伝達タンパク質は、固有の抗菌耐性とE.faecalisの腸の持続性を可能にすることを示した。 彼らは、PrkCを欠いているE.faecalis変異体は、抗菌ストレスの非存在下で野生型の速度で成長したが、細胞壁の生物形成と胆汁洗剤を標的とした抗生物質を含む細胞エンベロープ活性化合物に対する感受性の強化を示したことを発見した。PrkCは、院内病原体としての成功の鍵であるE.faecalisの生理学的プロセスを調節する。 PrkCの研究者の予測構造は、架橋されていないペプチドグリカンに結合すると考えられる膜貫通セグメントによって分離された細胞質キナーゼドメインであった。 このことは,Prkcがe.faecalis細胞壁の完全性を監視し,その相互作用を維持するための適応応答を媒介する膜貫通受容体であることを示唆した。 PrKCはEにとって重要です。 糞便は院内感染を引き起こし、シグナル伝達タンパク質が抗生物質耐性腸球菌による感染を予防する治療法の開発の標的であることを示唆している。
1.)I.T.Paulsen,L.Banerjei,G.S.A.Myers,K.E.Nelson,R.Seshadri,T.D.Read,D.E.Fouts,J.A.Eisen,S.R.Gill,J.F.Heidelberg,H.Tettelin,R.J.Dodson,L.Umayam,L.Brinkac,M.Beanan,S.Daugherty,R.T.DeBoy,S.Durkin,J.Kolonay,R.Madupu,W.Nelson,J.Vamathevan,B.Tran,J.Upton,T.Hansen,J.Shetty,H.Khouri,T.Utterback,D.Radune,K.A.Ketchum,B.A.Dougherty,C.M. フレイザー “バンコマイシン耐性Enterococcus faecalisの進化におけるモバイルDNAの役割。”科学。 2003年3月。 Vol. 299位5615件中 p.2071-2074
2.)と表記されることもある。 1998年5月。 “多剤耐性腸球菌の間の多様性。”新興感染症。 Vol. 4、1番。 46-65頁
3. とができることを示しています。 医療細菌学のカラーアトラス。 ワシントンDC:アメリカ微生物学会出版、2004年。
4.)アリアスC.、シンK.、パネッソD.、マレー BE。 “Γ-ラクタマーゼ産生およびバンコマイシン耐性分離株を含むEnterococcus faecalisに対するセフトビプロールのタイムキルおよび相乗効果の研究。”抗菌剤および化学療法。 2007年6月。 Vol. 51番6号 2043-2047頁
5.)Bourgeois-Nicolaos N.、Massias L.、Couson B.、Butel MJ、Andremont A.、Doucet-Populaire F.”Enterococcus faecalis In VivoでのLinezolidに対する耐性の出現の用量依存性。”感染症のジャーナル。 2007. Vol. 195. 1480年-1488年。
6.)クリスティC.、ウェルズC.、ダニー G. “Enterococcus faecalisの真核生物型Ser/Thrキナーゼは、抗菌抵抗性および腸の持続性を仲介する。”アメリカ合衆国の国立科学アカデミーの議事録。 2007年二月。 Vol. 104番9号 3508-3513
7.)Macovei、L.、Zurek、L.”抗生物質耐性遺伝子の生態学:食品の設定で収集されたハウスフライからの腸球菌の特性評価。”応用および環境微生物学。 2006年6月。 Vol. 72番6号 4028-4035頁
8.)ギルモア、マイケル… 腸球菌:病因、分子生物学、および抗生物質耐性。 ワシントンDC:アメリカ微生物学会出版、2002年。
9.)Nallapareddy SR,Singh KV,Sillanpää J,Garsin DA,Höök M,Erlandsen SL,Murray BE.. “Enterococcus faecalisの心内膜炎およびバイオフィルム関連線毛。”臨床調査のジャーナル。 2006年10月。 第116号 2799-2807頁UCサンディエゴのRichard A.Martinez、Rachel Larsenの学生によって編集されました。