ビデオ\(\PageIndex{1}\):メンデレーエフの天才への簡単な紹介。
初期の化学者が鉱石を精製し、より多くの元素を発見したように、彼らは様々な元素がそれらの同様の化学的挙動によって一緒にグルー そのようなグループの一つには、リチウム(Li)、ナトリウム(Na)、およびカリウム(K)が含まれる: これらの要素はすべて光沢があり、熱と電気をよく伝導し、同様の化学的性質を持っています。 第二のグループ化は、カルシウム(Ca)、ストロンチウム(Sr)、およびバリウム(Ba)を含み、これはまた、熱と電気の光沢のある、良好な導体であり、共通の化学的性質を しかし、これらの2つのグループの特定の特性は、互いに顕著に異なる。 例えば、Li、Na、およびKは、Ca、Sr、およびBaよりもはるかに反応性があります。; Li、Na、Kは酸素原子の2対1の割合で酸素を有する化合物を形成し、Ca、Sr、Baは酸素原子の1対1の割合で酸素を有する化合物を形成する。 フッ素(F)、塩素(C L)、臭素(B r)、およびヨウ素(i)も、互いに同様の特性を示すが、これらの特性は、上記のいずれの元素の特性とも大きく異なる。
ロシアのDimitri Mendeleev(1869年)とドイツのLothar Meyer(1870年)は、当時知られていた要素の特性の間に周期的な関係があることを独立して認識しました。 原子質量の増加に応じて配置された要素を持つ両方の公開されたテーブル。 しかし、MendeleevはMeyerよりも一歩進んだ:彼は彼のテーブルを使って、アルミニウムやシリコンに似た特性を持つ要素の存在を予測したが、まだ不明であった。 ガリウム(1875年)とゲルマニウム(1886年)の発見は、メンデレーエフの仕事のための大きなサポートを提供しました。 MendeleevとMeyerは優先順位について長い論争をしていましたが、周期表の開発へのMendeleevの貢献は現在より広く認識されています(図\(\PageIndex{1}\))。
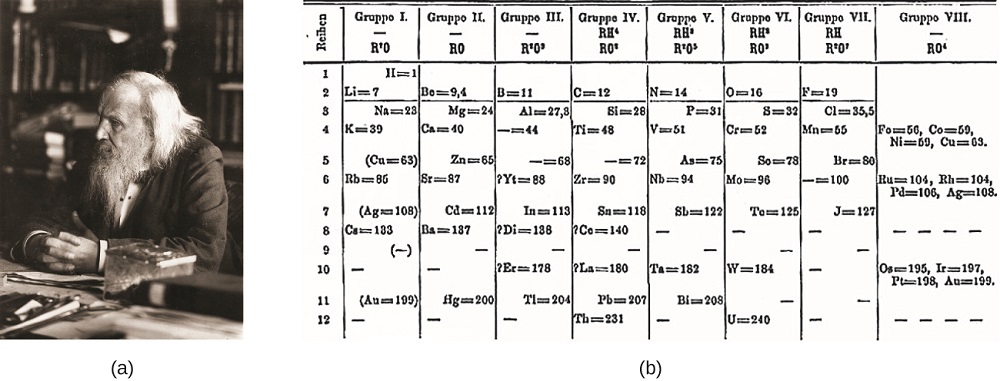
図\(\PageIndex{1}\): (a)Dimitri Mendeleevは、(b)元素の最初の周期表を作成したことで広く信じられています。 (クレジットa:セルジュ-ラキノフによる作品の修正;クレジットb:”Den fjättrade ankan”/ウィキメディア-コモンズによる作品の修正)
Video\(\PageIndex{2}\):周期表の周期とグループへの組織化の紹介。 この組織は、私たちが化学の原則に基づいて構築し続けるように重要になります。
二十世紀までに、周期的な関係は原子質量ではなく原子番号が関与していることが明らかになりました。 この関係の現代的な声明、周期律は次のとおりです:要素の特性はそれらの原子番号の周期関数です。 現代の周期表は、同じ垂直列(図\(\PageIndex{2}\))に同様の性質を持つ原子番号とグループ原子の増加順に要素を配置します。 各ボックスは要素を表し、その原子番号、記号、平均原子質量、および(時には)名前が含まれています。 要素は、ピリオドまたはシリーズと呼ばれる7つの水平の行と、グループと呼ばれる18の垂直の列に配置されています。 グループは、各列の上部にラベル付けされています。 米国では、ラベルは伝統的に大文字の数字でした。 ただし、IUPACでは、1から18までの数字を使用することを推奨しており、これらのラベルはより一般的です。 テーブルが1ページに収まるようにするには、通常、テーブルの本体の下に合計14列の行の2つの部分が書き込まれます。
 図\(\PageIndex{2}\):周期表の要素は、そのプロパティに応じて編成されています。
図\(\PageIndex{2}\):周期表の要素は、そのプロパティに応じて編成されています。
多くの要素は、その化学的および物理的性質が劇的に異なりますが、いくつかの要素は、それらの挙動が類似しています。 例えば、多くの要素は光沢があり、可鍛性(破損することなく変形することができる)および延性(ワイヤに引き込むことができる)であり、熱および電気を 他の要素は光沢があり、可鍛性、または延性がなく、熱および電気の貧弱な導体である。 私たちは、共通の特性を持つ大規模なクラスに要素を並べ替えることができます:金属(光沢のある、可鍛性、熱と電気の良好な導体である要素—黄色の影);非金属(熱と電気の鈍い、貧弱な導体に見える要素—緑の影); そして、メタロイド(熱と電気を適度に伝導し、金属のいくつかの特性と非金属のいくつかの特性を有する元素—陰影のある紫色)。
要素は、1、2、および13-18とラベルされた列の主族元素(または代表元素)、3-12とラベルされた列の遷移金属、表の下部の二つの行の内部遷移金属に分類することができる(上の行の要素はランタニドと呼ばれ、下の行の要素はアクチニドである;図\(\PageIndex{3}\))。 元素は、それらが形成する化合物の組成などのより具体的な特性によってさらに細分化することができる。 例えば、第1族(第1列)の元素は、元素の1原子と水素の1原子からなる化合物を形成する。 これらの元素(水素を除く)はアルカリ金属として知られており、それらはすべて同様の化学的性質を有する。 第2族(第2列)の元素は、元素の1個の原子と水素の2個の原子からなる化合物を形成する:これらはアルカリ土類金属と呼ばれ、そのグループのメンバーの間で同様の特性を有する。 特定の名前を持つ他のグループは、pnictogen(グループ15)、カルコゲン(グループ16)、ハロゲン(グループ17)、および希ガス(グループ18、不活性ガスとしても知られている)です。 基はまた、基の最初の要素によって参照することができる:例えば、カルコゲンは、酸素基または酸素ファミリーと呼ぶことができる。 水素は、第1族元素と第17族元素の両方に類似した特性を持つユニークな非金属元素です。 その理由のために、水素は両方の基の上部に、またはそれ自体で示されていてもよい。
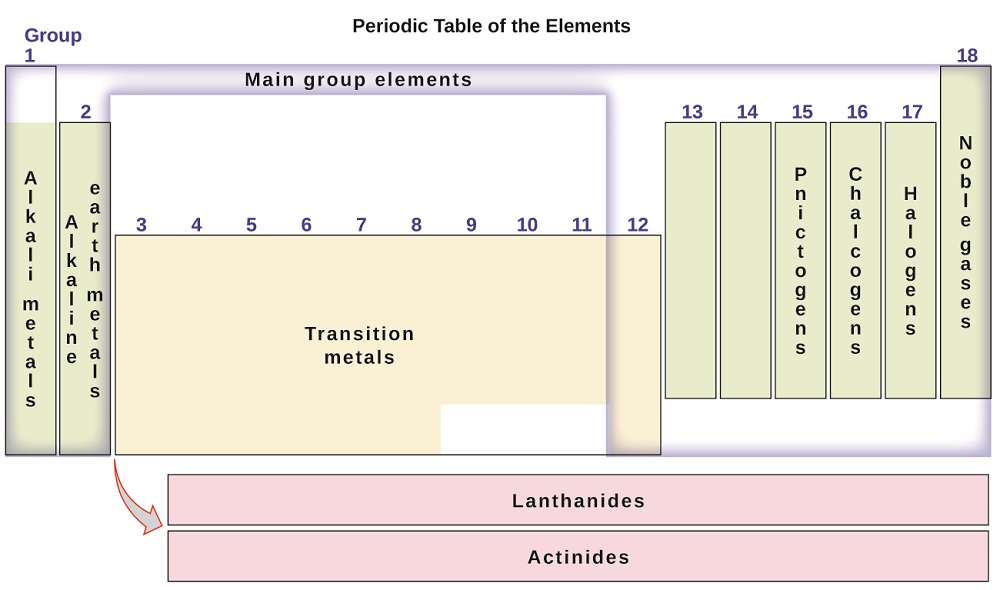
図\(\PageIndex{3}\):周期表は、同様のプロパティを持つ要素をグループに整理します。
例\(\PageIndex{1}\):要素のグループの名前付け
次の各要素の原子は生命に不可欠です。 次の要素のグループ名を指定します:
- chlorine
- calcium
- sodium
- sulfur
Solution
The family names are as follows:
- halogen
- alkaline earth metal
- alkali metal
- chalcogen
Exercise \(\PageIndex{1}\)
Give the group name for each of the following elements:/li>
希ガス
回答b
カルコゲン
回答c
アルカリ土類金属
回答d
アルカリ金属
アルカリ金属アルカリ金属アルカリ金属アルカリ金属アルカリ金属アルカリ金属アルカリ金属アルカリ金属アルカリ金属アルカリ金属アルカリ金属アルカリ金属アルカリ金属周期表の研究では、いくつかの元素の原子質量について何かに気づいたかもしれません。 元素43(テクネチウム)、元素61(プロメチウム)、および原子番号84(ポロニウム)以上の元素のほとんどは、角括弧で与えられた原子質量を持っています。 これは、完全に不安定な放射性同位体で構成されている元素に対して行われます(放射能については、核化学の章で詳しく学びます)。 それらの放射性同位体は、ソースに応じて、相対的な存在量が大幅に変化したり、自然界にさえ存在しない可能性があるため、これらの元素の平均原子量を決定することはできません。 角括弧内の数は、その元素の最も安定な同位体の原子質量数(およびおおよその原子質量)である。P>
概要
Video\(\PageIndex{3}\):周期表の発見と特性の概要。
要素の間で同様の特性の周期的な再発の発見は、要素が周期として知られている行とグループとして知られている列に原子番号を増加させる順に配置されている周期表の定式化につながった。 周期表の同じグループの元素は、同様の化学的性質を有する。 元素は、金属、半金属、および非金属として、または主基元素、遷移金属、および内部遷移金属として分類することができる。 グループは、左から右に1-18の番号が付けられています。 第1族の元素はアルカリ金属、第2族の元素はアルカリ土類金属、第15族の元素はピニクトゲン、第16族の元素はカルコゲン、第17族の元素はハロゲン、第18族の元素は希ガスである。div