学習目標
このセクションの終わりまでに、次のことができます。
- ガス中の微視的量と巨視的量の関係を説明
- ガスの混合物を含む問題を解決する
- ガス分子の衝突間の距離と時間を含む問題を解決する
我々は、それらの巨視的な定義に基づいて圧力と温度を調べました。 圧力は力が加わる面積で割った力であり、温度は温度計で測定されます。 我々は、ガスの運動論、ガスの巨視的性質をそれらが構成する分子の運動に関連付ける理論から圧力と温度のより良い理解を得ることができます。 まず、理想気体中の分子について二つの仮定を行います。
- 非常に多くのN個の分子があり、すべて同一であり、それぞれが質量mを有する。
- 分子はニュートンの法則に従い、連続運動しており、ランダムで等方的であり、すなわちすべての方向で同じである。
理想気体の法則と、典型的な分子のエネルギーなどの微視的な量と温度などの巨視的な量との関係を導出するために、剛体容器内の理想気体のサン:分子はそれらの間の平均距離よりもはるかに小さいので、それらの総体積はそれらの容器(体積Vを有する)のそれよりもはるかに小さい。 言い換えれば、我々は、容器内のガスのモルの体積と比較して無視できるように、ガス分子のモルの体積であるファンデルワールス定数bを取ります。
分子間の衝突は、理想気体の法則の導出には現れません。 ランダムな速度で移動する分子間の衝突は新しいランダムな速度を与えるので、それらは導出を妨げない。 さらに、容器内の気体分子の速度が最初はランダムで等方的ではない場合、分子衝突はそれらをランダムで等方的にするものです。
計算を単純化するが結果には影響しないような仮定をさらに行います。
まず、コンテナを長方形の箱にします。 第二に、我々は単原子ガス、その分子は、ヘリウムなどの単一原子からなるものを考慮することから始めます。 そして、原子は並進運動エネルギーを除いてエネルギーを持たないと仮定することができます。 (後に、実際の単原子ガスに対するこの仮定の妥当性について議論し、二原子および多原子ガスを考慮するためにそれを省略する。図\(\PageIndex{1}\)は、気体分子と容器の壁との衝突を示しているので、(ニュートンの第3の法則によって)壁に力を発揮します。 これらの衝突は、ガス中の圧力源である。 分子の数が増加するにつれて、衝突の数、したがって圧力が増加する。 同様に、分子の平均速度がより高い場合、ガス圧はより高い。p>
容器内のガスのサンプルでは、分子運動のランダム性は、一定の時間内に壁の任意の部分と分子の衝突の数を変動させます。 しかし、膨大な数の分子が短時間で壁に衝突するため、私たちが測定する時間と空間のスケールでの衝突の数は、平均からわずかで、通常は観察できない この状況をカジノの状況と比較することができます,賭けの結果はランダムであり、カジノのtakingsは分と時間によって変動します. しかし、一年のような長い時間にわたって、カジノの服用はオッズから期待される平均に非常に近いです。 ガスのタンクは、カジノが賭けを持っているよりも非常に多くの分子を持っており、分子はカジノが賭けを持っているよりも秒で非常に多くの衝突
箱の壁に分子が及ぼす平均力の計算は、理想気体の法則と温度と分子運動エネルギーとの関係につながります。 (実際には、2つの平均を取ります:与えられた速度を持つ1つの分子によって及ぼされる平均力を得るために時間をかけて1つ、そして異なる速度を)このアプローチは、流体の流れ(流体力学)に関する彼の仕事のために物理学で最もよく知られているDaniel Bernoulli(1700-1782)によって開発されました。 驚くべきことに、ベルヌーイは、ダルトンが原子からなるものとしての物質の見解を確立する前に、この作業をしました。
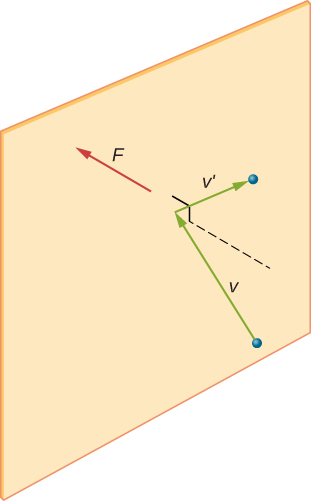
図\(\PageIndex{2}\)は、ガスでいっぱいの容器と、ガス分子と容器の壁との弾性衝突の展開図を示し、コンポーネントに分解されています。
図\(\PageIndex{2}\)は、ガスでいっぱいの容器と、ガス分子と容器の壁との弾性衝突を示しています。 分子はガス中の分子の分離に比べて小さく、他の分子との相互作用は無視できると仮定してきました。 これらの条件下では、理想気体の法則は実験的に有効である。 我々はまた、壁が剛性であり、粒子が点であると仮定しているので、衝突は弾性的である(エネルギーの保存によって—粒子の運動エネルギーがどこにもない)。 したがって、分子の運動エネルギーは一定のままであり、したがって、その速度およびその運動量の大きさも同様に一定のままである。 この仮定は必ずしも有効ではありませんが、このモジュールの残りの部分の結果は、分子がエネルギーと運動量を壁と交換させるモデルでも得られます。
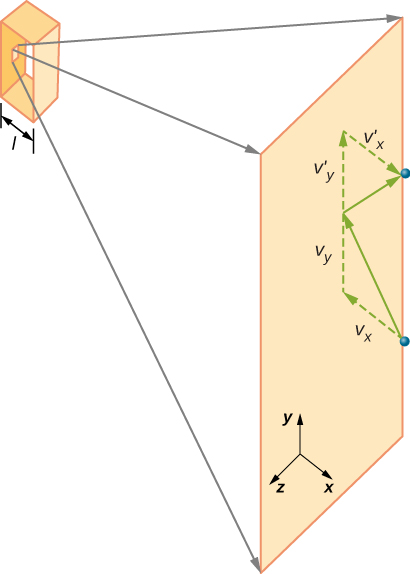
(この式だけでは、pは圧力ではなく運動量を表す。)分子が壁に触れている間を除いて、壁と分子との間に力はない。 衝突の短い時間の間に、分子と壁の間の力は比較的大きいですが、それは私たちが探している力ではありません。 私たちは平均力を探しているので、\(\Delta t\)を与えられた分子とこの壁との衝突の間の平均時間、つまり1つの衝突が見つかると予想される時間とします。\(\Delta t\) Lがx方向のボックスの長さを表すとします。 次に、\(\Delta t\)は、分子がボックスを横切って戻ってくるのにかかる時間、距離2l、\(v_x\)の速度です。 したがって、\(\delta t=2l|v_x\)となり、力の式は
\
この力は1つの分子によるものです。 壁の総力Fを見つけるには、すべてのN分子の寄与を追加する必要があります:ここで、棒で表す平均の定義を使用して、力を見つけます。
\
速度のx成分ではなく、速度vの観点から力を求めます。
\
速度のx成分ではなく、速度vの観点から力を求めます。
\
速度のx成分ではなく、速度vの観点から力を求めます。
速度vの観点から力を求めます。
総速度の二乗はその成分の二乗の合計であることに注意してください。
\
等方性を仮定すると、右側の三つの平均は等しいので、
\
これをfの式に代入すると、
\
圧力はF/Aとなるので、
\ここで、体積に\(V=Al\)を使用しました。 これは重要な結果を与えます
\
この方程式を\(pV=Nk_Bt\)と組み合わせると
\
分子の平均運動エネルギーを得ることができます。\(\frac{1}{2}m\overline{v}^2\)nを除算して3/2を掛けることによって方程式の左側から得ることができます。分子の平均運動エネルギーは、その絶対温度に正比例します。\(\overline{K}=\frac{3}{2}K_bt\)は、分子あたりの平均運動エネルギーです。\(\overline{K}=\frac{3}{2}K_bt\)は、分子あたりの平均運動エネルギーです。\(\overline{K}=\frac{3}{2}K_bt\)は、分子の平均運動エネルギーです。\(\overline{K}=\frac{3}{2}K_bt\)は、分子ごとの平均運動エネルギーです。\(\overline{K}=\frac{3}{2}K_bt\)は、分子ごとの平均運動エネルギーです。 特に、この式の何もガス、圧力、または温度以外の何かの分子量(または任意の他の特性)に依存しないことに注意してください。 非常に異なる分子量を持つヘリウムとキセノンガスのサンプルが同じ温度にある場合、分子は同じ平均運動エネルギーを有する。
熱力学系の内部エネルギーは、その中のすべての分子の機械的エネルギーの合計です。
熱力学系の内部エネルギーは、その中のすべての分子 ここで、単原子理想気体の内部エネルギーの方程式を与えることができます。 このようなガスでは、分子の唯一のエネルギーはそれらの並進運動エネルギーである。 したがって、内部エネルギーを\(E_{int}\)で表すと、単純に\(e_{int}=N\overline{K}\)、または
\
この方程式をモルの観点から使用したいと思います。
\
\(\overline{K}=\frac{1}{2}m\overline{v}2 2=\frac{3}{2}k_bt\)を解くことができます。分子の二乗平均平方根(rms)速度として知られているものを決定するための温度の面で理想的なガス中の分子の典型的な速度。
分子のRMS速度
分子の二乗平均平方根(rms)速度、または速度の二乗の平均の平方根\(\overline{v}^2\)は、
\
rms速度は、分子速度の分布で見るように、分子の平均….. ここでも、ガス定数Rとモル質量M(kg/mol)の観点からこの式を書くことができます:理論的な点粒子の代わりに原子にモデルを適用すると、回転運動エネルギーは私たちの結果を変えますか?
\
私たちはあなたに起こったかもしれな この質問に答えるために、我々は量子力学にアピールする必要があります。 量子力学では、回転運動エネルギーは任意の値を取ることはできません。 原子の回転慣性は、その質量のほとんどすべてが核内にあり、通常は半径が\(10^{-14}m\)未満であるため、小さくなります。 したがって、原子の最小回転エネルギーは、達成可能な温度では\(\frac{1}{2}K_bt\)よりはるかに多く、利用可能なエネルギーは原子を回転させるのに十分では 次のセクションで二原子ガスと多原子ガスについて議論するときは、この点に戻ります。
例\(\PageIndex{1}\): ガス分子の運動エネルギーと速度を計算する
- \(20.0^oC\)(室温)でのガス分子の平均運動エネルギーは何ですか?この温度での窒素分子のrms速度(\(N_2\))を求めます。
- この温度での窒素分子のrms速度(\(N_2\))を求めます。この方程式に値を代入する前に、与えられた温度をケルビンに変換する必要があります:\(T=(20.0+273)\、K=293\、K\)。 式を使用して窒素分子のrms速度を見つけることができます
\
しかし、最初に窒素分子の質量を見つける必要があります。 周期表から窒素のモル質量を求めると、
\
解
- 温度だけで平均並進運動エネルギーを見つけることができます。 温度を並進運動エネルギー方程式に代入すると、この質量と\(k_b\)の値を\(v_{rms}\)の方程式に代入すると、\
有意性
分子の平均運動エネルギーは分子の種類に依存しないことに注意してください。 平均並進運動エネルギーは絶対温度にのみ依存する。 運動エネルギーは巨視的エネルギーに比べて非常に小さいので、空気分子が私たちの肌に当たっているときに私たちは感じません。 一方、分子が部屋の上から下に移動するとき、それは重力ポテンシャルエネルギーの典型的な違いよりもはるかに大きいので、私たちの重力の無視は典型的な現実世界の状況で正当化されます。 窒素分子のrms速度は驚くほど大きい。 これらの大きな分子速度は、分子が等しい可能性を持ってすべての方向に移動するので、空気の巨視的な動きをもたらさない。 空気中の分子の平均自由経路(分子が衝突の間に平均して移動する距離、このセクションで少し後で説明します)は非常に小さいので、分子は急速に移動しますが、1秒ではそれほど遠くには行きません。 Rms速度の高い値は、室温で約340m/sの音速に反映されます。 空気分子のrms速度が高いほど、より速い音の振動を空気中に伝達することができる。 音の速度は温度とともに増加し、ヘリウムのような小さな分子質量を持つガスではより大きくなります(図\(\PageIndex{3}\)参照)。p>
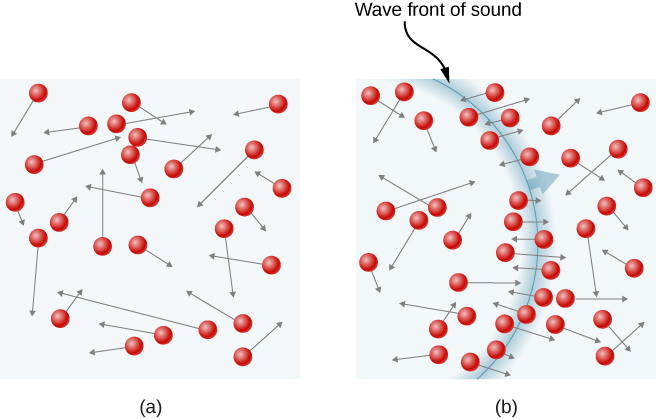
図\(\PageIndex{3}\): (a)通常のガスでは、非常に多くの分子が非常に速く移動し、毎秒数十億回衝突します。 (b)個々の分子は、少量の時間で非常に遠くに移動することはありませんが、音波のような外乱は、分子速度に関連する速度で伝達されます。
例\(\PageIndex{2}\):温度を計算する:ヘリウム原子の脱出速度
地球の重力を脱出するには、大気の頂上付近(高度100km)の物体は11.1km/sで地球から離れて移動しなければならない。 ヘリウム原子はどの温度で脱出速度に等しいrms速度を持っていますか?
戦略
knownsとunknownsを特定し、問題を解決するために使用する方程式を決定します。
戦略
knownsとunknownsを特定します。
解
- 既知を特定する:vは脱出速度、11.1km/sです。
- 未知数を特定する:温度、Tについて解く必要があります。
- 必要な方程式を決定します。
- ヘリウム原子の質量mを得るために、周期表からの情報を使用することができます: \
- 温度Tを解くには、\を並べ替えることができます\
- 既知の値を方程式に代入し、未知数を解く\と\
有意性
この温度は、高度で約250K(\(-25^oC\)または\(-10^oF\))である大気温度よりもはるかに高い。 非常に少数のヘリウム原子が大気中に残っているが、多くは大気が形成されたときに存在していた、とより多くは、常に放射性崩壊によって作成されています(核物理学の章を参照してください)。 ヘリウム原子の損失の理由は、ヘリウム原子の数が少ないことが、常温でも地球の脱出速度よりも高い速度を有するからである。 ヘリウム原子の速度はある衝突から次の衝突に変化するので、任意の瞬間に、原子の速度が脱出速度よりも大きい小さいがゼロでない可能性がある。 チャンスは、地球の寿命にわたって、大気中にあったほぼすべてのヘリウム原子が高高度で脱出速度に達し、地球の重力の引きから脱出したことを十分に高くなっています。 酸素、窒素、水などのより重い分子はrms速度が小さいため、それらのいずれかが脱出速度よりも大きな速度を持つ可能性ははるかに低くなります。 実際、その可能性は非常に小さいため、大気からかなりの量の重い分子を失うのに数十億年が必要です。 図\(\PageIndex{4}\)は、月の大気不足の影響を示しています。 月の引力ははるかに弱いので、それはほとんどその全体の大気を失っています。 地球と他の体の大気は、この章の演習で比較されます。

運動\(\PageIndex{2}\)
花粉の粒のような非常に小さな物体をガス中で考えると、その表面に衝突する分子の数も あなたは花粉の粒が一定の時間内にそれを打つガス分子の数の統計的変動のために圧力の変動を経験することを期待しますか?
答え答え答え このようなゆらぎは、実際にはガス中の任意のサイズの天体で発生しますが、巨視的な天体では分子の数が膨大であるため、ゆらぎは衝突数のわずかな割合であり、このセクションで話されている平均はいつの間にか変化しています。 大まかに言えば、揺らぎは衝突数の平方根に反比例するので、小さな物体では重要になる可能性があります。 これは実際には19世紀に水中の花粉粒子について観測され、ブラウン運動として知られています。
蒸気圧、分圧、およびダルトンの法則
ガスが利用可能な全体積を占めていた場合に生成する圧力は、ガスの分圧と呼ばれます。 二つ以上のガスが混合されている場合、それらは分子間の衝突の結果として熱平衡に来るでしょう; このプロセスは、温度と熱に関する章で説明されているように、熱伝導に類似しています。 我々が速度論から見たように、ガスが同じ温度を有するとき、それらの分子は同じ平均運動エネルギーを有する。 従って、各ガスは理想的なガスの法律に別に従い、単独であったら容器の壁の同じ圧力を出す。 したがって、ガスの混合物では、全圧は、理想的なガス挙動と成分間の化学反応を仮定して、成分ガスの分圧の合計である。 この法則は、それを提案した英国の科学者John Dalton(1766-1844)にちなんで、Dalton’s law of partial pressuresとして知られています。 ダルトンの法則は、圧力がパスカルの原則に従って追加されるという事実と一致しています。
熱平衡における理想気体の混合物において、各気体の分子数はその分圧に比例する。 この結果は、\(p/n=RT/V\)の形でそれぞれに理想気体の法則を適用することに従います。 右側は、所与の体積の容器内の所与の温度における任意のガスに対して同じであるため、左側も同様である。分圧は、ガスが単独で存在する場合に生成される圧力です。
- 分圧は、ガスが単独で存在する場合に生成される圧力です。
- ダルトンの法則は、全圧は存在するすべてのガスの分圧の合計であると述べています。容器内で平衡状態にある任意の2つのガス(1と2のラベル)について、\(\frac{p_1}{n_1}=\frac{p_2}{n_2}。分圧の重要な適用は、化学において、反応速度を決定する際のガスの濃度として機能することである。 ここでは、人の肺の酸素の分圧が人生と健康にとって重要であることだけを言及します。 酸素分圧が0.16気圧以下の呼吸空気は、特に高度に順応していない人では、調整と判断を損なう可能性があります。 0.06気圧以下の分圧はすぐに致命的になる可能性があり、人が救助されたとしても永久的な被害が発生する可能性があります。 しかし、息をする必要があるという感覚は、呼吸を保持するときのように、低濃度の酸素よりも血液中の高濃度の二酸化炭素によってはるかに引き起こ したがって、小さな部屋やクローゼットが酸素濃度の低い空気で満たされている場合、おそらく圧縮されたガスの漏れたシリンダーがそこに貯蔵されているため、人は”窒息”感を感じず、何か間違ったことに気付かずに痙攣したり意識を失ったりする可能性があります。 安全技術者はこの危険にかなりの注意を払っています。
分圧のもう一つの重要な適用は、同じ物質の液体(または昇華の場合は固体)相と平衡にある蒸気の分圧である蒸気圧である蒸気圧である。 任意の温度では、空気中の水の分圧は、分圧が蒸気圧に達するたびに、水が空気から凝縮するため、その温度での水の蒸気圧を超えることはできません。 露はこの凝縮の一例です。 凝縮が空気のサンプルのために起こる温度は露点と呼ばれます。 それはゆっくり金属球を冷却することによって容易に測定されます;露点は凝縮が最初に球で現われる温度です。気象学のための関心のあるいくつかの温度での水の蒸気圧は、表\(\PageIndex{1}\)に与えられています。
水の蒸気圧は、表\(\PageIndex{1}\)に与えられています。p>
テーブル\(\PageIndex{1}\):様々な温度での水の蒸気圧 T(\(^oC\)) 蒸気圧(Pa) 0 610.5 3 757.9 5 872.3 8 1073 10 1228 13 1497 15 1705 18 2063 20 2338 23 2809 25 3167 30 4243 35 5623 40 7376 The relative humidity (R.H.)温度Tで定義されます
\
\(100\%\)の相対湿度は、水の分圧が蒸気圧に等しいことを意味します。たとえば\(\PageIndex{3}\):相対湿度の計算
気温が\(25^oC\)で露点が\(15^oC\)のときの相対湿度は何ですか?
戦略
我々は、単に与えられた温度での蒸気圧と露点での蒸気圧を調べ、比を見つける。
解決策
意義
R.H.は私たちの快適さにとって重要です。 \(53.8\%\)の値は、屋内での快適さに推奨される\(40\%\)から\(60\%\)の範囲内です。
温度と熱の章で述べたように、露点または霜点に達すると、水が凝縮して比較的大量の気化潜熱を放出するため、温度は露点を下回ることはほとん
平均自由パスと平均自由時間
ここで、衝突を明示的に検討します。 通常の最初のステップ(これは私たちが取るすべてです)は、分子が他の分子との衝突の間に移動する平均距離である平均自由経路、\(\lambda\)と、分子の衝突の間の平均時間である平均自由時間\(\tau\)を計算することです。 すべての分子が半径\(r\)の球であると仮定すると、分子の中心がお互いの距離2r以内にある場合、分子は別の分子と衝突します。\(r\)が半径\(r\)の球で 与えられた粒子について、その半径を持つ円の面積、\(4\pi r^2\)は、衝突の「断面」であると言います。 粒子が移動すると、その断面積を持つ円柱がトレースされます。 平均自由経路は長さ\(\lambda\)で、長さ\(\lambda\)と断面\(4\pi r^2\)の円柱内の他の分子の予想数が1になるような長さ\(\lambda\)です。 私たちが見ているもの以外の分子の動きを一時的に無視すると、期待される数は分子の数密度、n/V、体積の倍であり、体積は\(4\pi r^2\lambda\)なので、\((N/V)4\pi r^2\lambda=1\)、または
\
すべての分子の動きを考慮すると計算がはるかに難しくなりますが、唯一の変化は\(\sqrt{2}\)の要因です。 結果は、理想気体では、\(V/n=k_bt/p\)を代入して
\
平均自由時間\(\tau\)は、単純に平均自由経路を典型的な速度で割ったものであり、通常の選択はrms速度である。 \(0^oC\)の温度と1.00気圧の圧力でのアルゴン原子(\(M=39.9\,g/mol\))の平均自由時間を求めます。\(m=39.9\,g/mol\)の平均自由時間を求めます。\(m=39.9\,g/mol\)の平均自由時間を求めます。\(m=39.9\,g/mol\)の平均自由時間を求めます。\(m=39.9\,g/mol\)の平均自由時間を求めます。\(m=39.9\,g/mol\) アルゴン原子の半径を\(1.70\times10^{-10}\space m\)とする。
ソリューション
- knownsを識別し、SI単位に変換します。 モル質量は0であることがわかっています。1.01\times10^5\,Pa\)であり、半径は\(1.70\times10^{-10}\,m\)である。rms v_{rms}=\sqrt{\frac{3RT}{M}}=413\,m/s\)であることを証明してください。
- 平均自由時間の方程式に代入します:\
有意性
この結果をガス分子についての直感と比較することはほとんどできませんが、分子が非常に高運動\(\PageIndex{4}\)
空気中のより長い平均自由経路、液体の水または水蒸気を持っていますか?
空気中のより長い平均自由経路、液体の水または水蒸気を持っていますか?
回答
液体中では、分子は非常に近く、常に互いに衝突しています。 空気が通常の条件下にあるので、ガスがほぼ理想的であるためには、分子は非常に遠く離れていなければなりません。 したがって、平均自由経路は、空気中ではるかに長いです。
貢献者と属性
-
Samuel J.Ling(トルーマン州立大学)、Jeff Sanny(Loyola Marymount大学)、Bill Moebs(多くの貢献者を持つ)。 この作品は、クリエイティブ*コモンズ表示ライセンス(4.0によって)の下でOpenStax大学物理学によってライセンスされています。
div