アリルカルボカチオンの分子軌道
プロペンのカルボカチオンの安定性は共役π電子系に起因する。 「二重結合」は実際には存在しません。 代わりに、それは共役π電子系と呼ばれる3つの隣接した重複した非ハイブリダイズされたp軌道の群である。 あなたは明らかに本当に安定した陽イオンをもたらす三つの炭素からp軌道のすべての三つの間の相互作用を見ることができます。 それはすべて、電子欠乏炭素の位置がどこにあるかに帰着する。
分子軌道の説明は、2-プロペニルを使用してさらに別の方法でアリル安定性を説明することができます。 図1.1.1.6
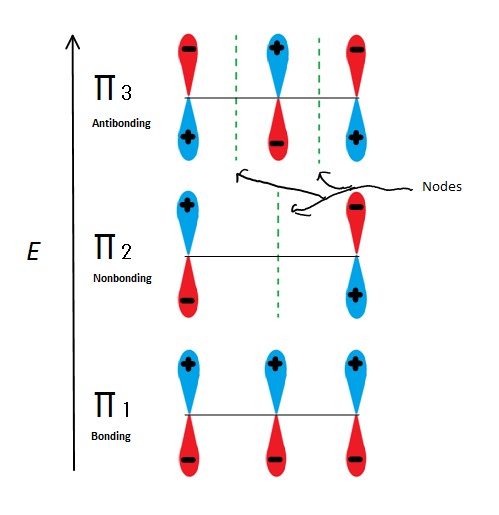
図。図6は、2-プロペニルの3つの可能な分子軌道を示しています
sのいずれかではなくπ分子軌道を取ると、それらのうちの三つが得られます。 σ1は節点を持たない結合であり、σ2は節点を持つ非結合(言い換えれば、規則的なp軌道と同じエネルギー)であり、σ3は2つの節点を持つ反結合である(いずれの軌道も相互作用していない)。 最初の2つの電子は、それが陽イオン、ラジカル、または陰イオンであるかどうかにかかわらず、π1分子軌道に入ります。 それがラジカルまたはアニオンであれば、次の電子はπ2分子軌道に入る。 最後の陰イオン電子も非結合軌道に入る。 したがって、どのような種類の炭素中心が存在しても、電子は反結合軌道に入ることはありません。
結合軌道は最低エネルギー軌道であり、有利であるため、最初に満たされます。 非結合軌道を満たすことができるにもかかわらず、系の全体的なエネルギーは、充填された結合分子軌道のために、より低く、より安定である。
この図は、π2がエレクトリオンが異なる唯一の分子軌道であり、単一のノードが中央を通過する場所でもあることを示しています。 このため、分子の電荷は主に2つの末端炭素にあり、中間炭素にはありません。
この分子軌道の記述は、図7のアリル炭素中心の安定性を説明することもできます。
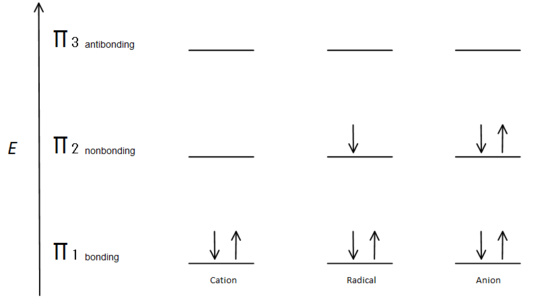
図。図7Aufbau原理に基づいて電子がどのように充填されるかを示す図。p>
π結合軌道は非結合p軌道よりもエネルギーが低い。 示されているすべての炭素中心は、より低いエネルギー、結合π軌道に二つの電子を有するので、各系のエネルギーは、陽イオン、ラジカル、または陰イオンに